苹果锈果类病毒属属级寡核苷酸芯片筛查方法的建立
2013-09-13张永江辛言言朱水芳李世访
张永江 辛言言 朱水芳 李世访
苹果锈果类病毒属(Apscaviroid)属于马铃薯纺锤形块茎类病毒科(Pospiviroidae),根据国际病毒分类委员会(International Committee on Taxonomy of Viruses,ICTV)第九次分类报告,该属包括苹果锈果类病毒(Apple scar skin viroid,ASSVd)、苹果凹类病毒(Apple dimple fruit viroid,ADFVd)、柑橘曲叶类病毒(Citrus bent leaf viroid,CBLVd)、澳洲葡萄类病毒(Australian grapevine viroid,AGVd)、柑橘矮化类病毒(Citrus dwarfing viroid,CDVd;又名柑橘类病毒 III,Citrus viroid III,CiVd III)、柑橘类病毒V(Citrus viroid V,CVd-V)、柑橘类病毒VI(Citrus viroid VI,CVd-VI)、葡萄黄点类病毒 1(Grapevine yellow speckle viroid 1,GYSVd-1)、葡萄黄点类病毒2(Grapevine yellow speckle viroid 2,GYSVd-2)及梨疱状溃疡类病毒(Pear blister canker viroid,PBCVd)等10种类病毒[1]。该属的类病毒可侵染苹果、梨、桃子、柑橘及葡萄等多种重要的果树。苹果锈果类病毒侵染苹果可引起锈果病导致果实变扁、花脸、畸形和裂果,是苹果生产中毁灭性的病害之一[2,3];葡萄黄点类病毒则导致葡萄病株叶片黄色斑点或形状不规则的黄色班块,造成葡萄大量减产[4];柑橘类病毒导致树势减弱,产量降低[5];梨疱状溃疡类病毒危害梨树,导致其产量和品质下降,严重时可引起果树急剧衰退,提早枯死而绝收,给果树生产带来很大的影响[6]。该属类病毒可通过种子、嫁接、生产工具及介体等多种途径传播,而且其寄主在我国广泛种植,因此一旦建立初侵染源,很容易在果园中扩散传播,病情逐年加重并成为全株永久性病害,必须清除病株才能控制病害的蔓延;该病毒会使果实商品价值大大降低,不但严重影响果农收入,同时也制约了我国水果产业的健康发展。为有效防止该属类病毒的传播扩散,除了加强种苗监管及田间管理措施外,有效的检测筛查技术也是必要的手段。
目前已有指示植物法、聚丙烯酰胺凝胶电泳法、核酸斑点杂交法及RT-PCR等多种技术用于该属类病毒的检测。在国内,马先锋等[5]采用指示植物法及RT-PCR技术对湖南省柑橘类样品中的柑橘类病毒III进行了检测;赵英等[7]采用斑点杂交法成功检测到新疆库尔勒香梨上的苹果锈果类病毒,还采用常规RT-PCR、原位RT-PCR及斑点杂交技术在国内首次成功的从苹果树中检测到了苹果凹类病毒[8];吴玉鹏等[9]首次采用RT-PCR技术对新疆库尔勒地区香梨泡状溃疡类病毒进行了检测,结果表明该技术可用于果树无毒苗的生产及种质资源的交流。国际上,Sipahioglu等[10]建立了苹果锈果类病毒的常规RT-PCR检测技术并应用于土耳其部分商业果园中该病毒的分布调查,在263份苹果样品中检测到121份呈阳性 ;Rizza等[11]采用 SYBR Green I 实时RT-PCR技术成功检测了意大利枳苗中的柑桔类病毒III;Hassen等[6]首次采用RT-PCR技术从突尼斯果树中检测到梨疱状溃疡类病毒。另外还有RTPCR-ELISA用于苹果锈果类病毒、苹果凹类病毒及梨疱状溃疡类病毒的检测[12];多重PCR技术用于柑桔曲叶类病毒及柑橘矮化类病毒[13,14],澳洲葡萄类病毒、葡萄黄点类病毒1及葡萄黄点类病毒2[15],苹果锈果类病毒、苹果凹类病毒及梨疱状溃疡类病毒[16,17]的检测。上述检测方法在苹果锈果类病毒属类病毒的检测中起到了重要的作用,然而这些方法通量低,一次只能检测样品中的一种或几种类病毒;而且属于特异性检测,无法对变异大且变异位点多的类病毒进行检测;特别是对于该属内可能出现的新种,缺乏有效的筛查能力,所以在检疫中容易造成类病毒漏检进而造成传播扩散,导致巨大的经济损失和不良的社会影响。
为了弥补上述技术的缺陷,国内外研究人员开展了广谱性高通量筛查技术的研究,结果表明,从病原物较高的分类水平上进行筛查,可以有效提高新发病原微生物的筛查效果;同时可以结合芯片的高通量特点,从而大大提高筛查的效率。如Zhang等[18]在2010年建立的植物病毒属级寡核苷酸芯片可以有效筛查到植物样品中未知的新病毒。报道的结果表明了这种属级水平芯片技术的实用性,但目前还没有关于苹果锈果类病毒属筛查芯片的报道,本研究希望通过开展该项研究来建立该类病毒属属级水平上的筛查芯片体系。
1 材料与方法
1.1 材料
苹果锈果类病毒及柑橘矮化类病毒阳性材料分别来自中国农业科学院植物保护研究所分子植物病理研究室及湖南农业大学国家柑橘改良中心长沙分中心。
核酸提取试剂Trizol及9N随机引物为Invitrogen产品;ExTaq DNA聚合酶、M-MLV反转录酶、dNTP、RNasin为大连TaKaRa公司产品;CbcScript酶为AMBION 公司产品;RNA及DNA纯化试剂盒购自MN公司。
1.2 方法
1.2.1 RT-PCR体系 用于扩增柑橘矮化类病毒的引物及扩增程序参照马先锋等[5]的方法;用于扩增苹果锈果类病毒的引物及扩增程序参照苏前富等[19]的方法。
总RNA提取:使用Trizol试剂,按说明书进行。
反转录 :体系 20μL,DEPC-H2O 10μL、dNTP 1μL、下游引物 2μL、RNA 模板 1μL ;70℃反应 5min,冰上放置5min;加入M-MLV酶5×buffer 4μL、M-MLV 酶 1μL、RNA 酶抑制剂 1μL,42℃反应1h。
PCR扩增:在0.2mL的反应管中加入cDNA产物 2μL、上游引物0.5μL、下游引物0.5μL、dNTP0.5μL、Taq 酶0.5μL、PCR 缓 冲 液 2μL 及 DEPCH2O 14μL,然后按照PCR反应程序进行扩增,产物进行琼脂糖凝胶电泳检测。
1.2.2 芯片体系
1.2.2.1 探针设计 从美国国立生物技术信息中心(NCBI)及国际病毒学分类委员会(ICTV)数据库下载核酸序列;去除90%以上长度与其他序列有95%相似度的核酸序列;以5个碱基作为间隔,连续提取所有40mer的核酸序列;以40%≤G+C含量≤60%、单个碱基含量≤50%、连续重复碱基数目≤4,且无>6个碱基的发卡结构为标准对核酸序列进行筛选,并在NCBI数据库中进行同源性比较以保证所获得探针的特异性。
1.2.2.2 样品标记 在0.2mL PCR管中加入PCR产 物 5μL、9N 随 机 引 物 2μL、DEPC-H2O 12μL,95℃变性3min,冰浴5min。然后向反应管中加入10×Klenow 酶缓冲液 2.5μL、dNTP 2μL、cy3-dCTP0.5μL、Klenow 酶 1μL。37℃反应 1.5h,70℃变性5min,冰浴5min。
1.2.2.3 芯片杂交 包括2.4μL SSC(终浓度3×)、0.32μL SDS(终浓度0.2%)、4μL甲酰胺(终浓度25%)、1.6μL Denhardt’s(终浓度 5×)和标记样品7.68μL。95℃变性 3min,冰浴 5min,瞬时离心。将杂交液加到芯片上,盖好盖玻片,42℃水浴杂交过夜。
1.2.2.4 芯片洗涤 杂交结束后,将芯片转移到盛有 42℃洗液 I(2×SSC,0.2% SDS)和 II(0.2×SSC)的清洗盒中清洗;然后2000r/min离心1min,除去芯片表面的液体。
1.2.2.5 芯片分析 在扫描仪中用532nm通道扫描分析,探针的信号值为探针前景值的中位值减去背景值的中位值。信噪比(Signal to Noise Ratio,SNR)为图像对应点内所有信号值的中位值与背景值中位值的比值。样品中若至少一条探针的信号值≥600且信噪比≥3,判为阳性(为苹果锈果类病毒属类病毒侵染);探针的信号值<600且信噪比<2,判为阴性(不为苹果锈果类病毒属类病毒侵染);其余情况判为可疑,需重复验证。
1.2.3 芯片探针有效性验证 为了验证所设计探针的有效性,即探针是否能够与荧光标记产物杂交。如能杂交,其杂交的信号值是否能够满足分析的要求,分别取苹果锈果类病毒及柑橘矮化类病毒的RNA作为模板,按照1.2.1的方法进行扩增,将扩增产物按照1.2.2的方法进行标记、杂交及检测,最后通过所获得的数据来分析探针的有效性。
1.2.4 芯片与RT-PCR灵敏度比较试验 将苹果锈果类病毒的总RNA进行10倍梯度稀释后用作模板,分别按照1.2.1和1.2.2的方法进行芯片与RT-PCR检测,通过两种方法能够检测到的总RNA最低稀释倍数来比较两者的灵敏度。
2 结果
2.1 芯片制备
采用生物信息学方法分析苹果锈果类病毒属类病毒的核苷酸序列,根据设定的探针设计原则,设计了35条40mer的属级特异性寡核苷酸探针(具体探针序列已申请国家专利,专利申请号为:201210193394.8),探针5'端用氨基修饰。将寡核苷酸探针通过芯片点样仪点制到醛基基片上,矩阵为10×12(图1),包括4个部分:Hex为芯片固定阳性质控,PC为杂交阳性质控,NC为杂交阴性质控,其他位点为检测探针;芯片使用的固相载体为醛基玻片。

图1 芯片矩阵示意图
2.2 芯片探针有效性验证
应用苹果锈果类病毒及柑橘矮化类病毒的样品对芯片探针进行验证,芯片杂交结果如图2及图3所示。图2中1、4、5、6、9及图3中2、3的信号值均>600,信噪比均>3(表1),达到进行结果判定的标准,说明本研究建立的芯片杂交体系能够在样品检测中获得有效的探针信号点,从而对样品中是否含有该属类病毒进行判断。
2.3 芯片灵敏度检测结果
苹果锈果类病毒总RNA按10、102及103梯度稀释后进行cDNA合成、Klenow酶标记和杂交,反应结束后对芯片进行洗涤扫描。结果如图4所示,随着稀释梯度的增大,探针信号强度越来越小,103稀释梯度已不具有可见信号点,因此该芯片的灵敏度阈值大约是102。具体阳性探针信号值及信噪比如表2所示。
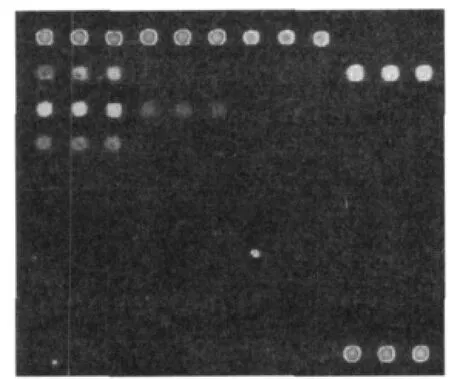
图2 苹果锈果类病毒样品验证结果
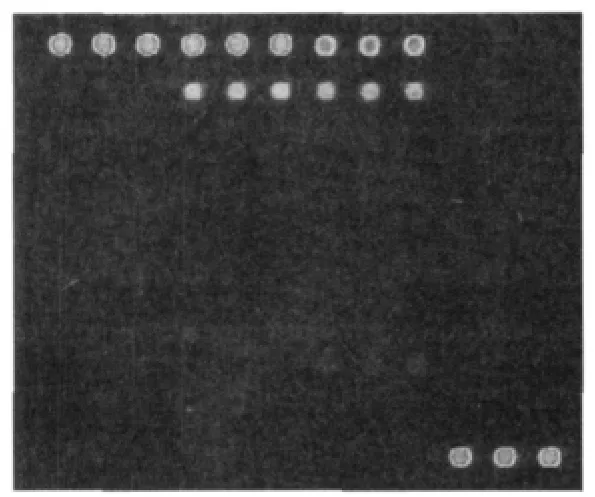
图3 柑橘类病毒III样品验证结果
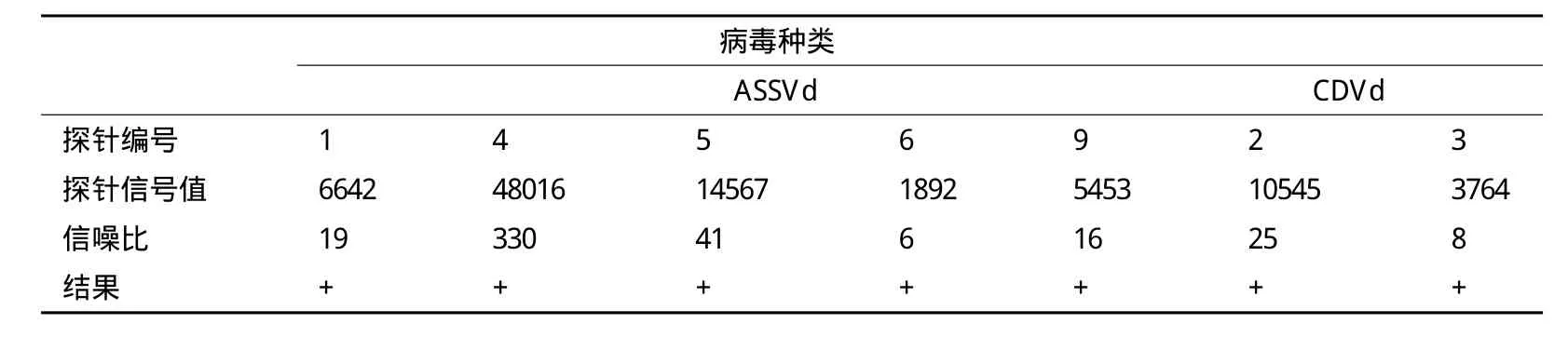
表1 芯片探针有效性验证结果
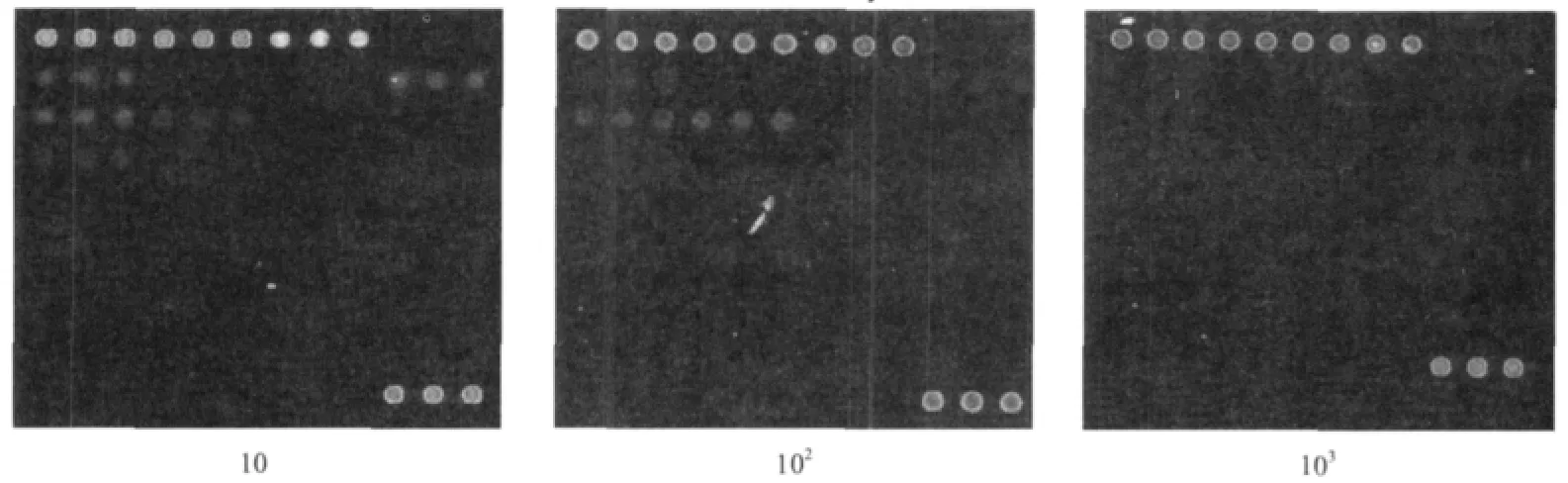
图4 芯片灵敏度结果
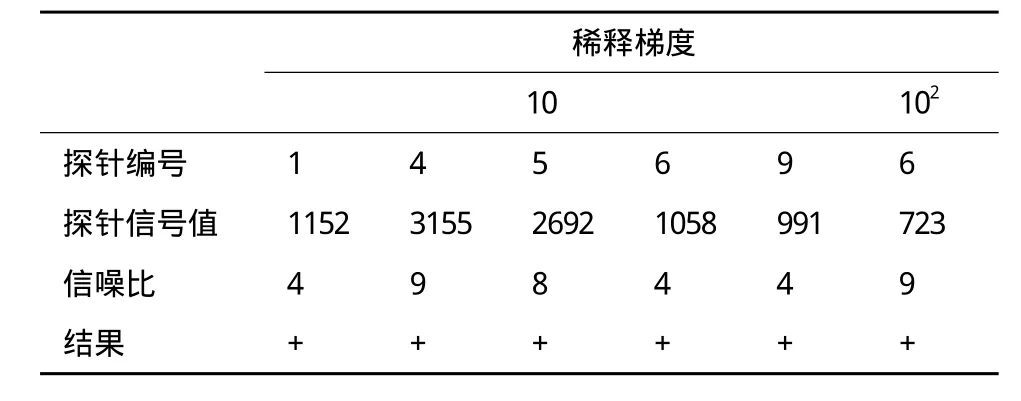
表2 芯片灵敏度结果
2.4 RT-PCR灵敏度检测结果
苹果锈果类病毒总RNA按10、102及103梯度稀释后进行RT-PCR检测,电泳结果(图5)表明可从阳性材料中扩增出约330bp的特异性目标条带。随着检测总RNA稀释倍数的增大,可以观察到明显的浓度梯度谱带,稀释梯度限点为102。
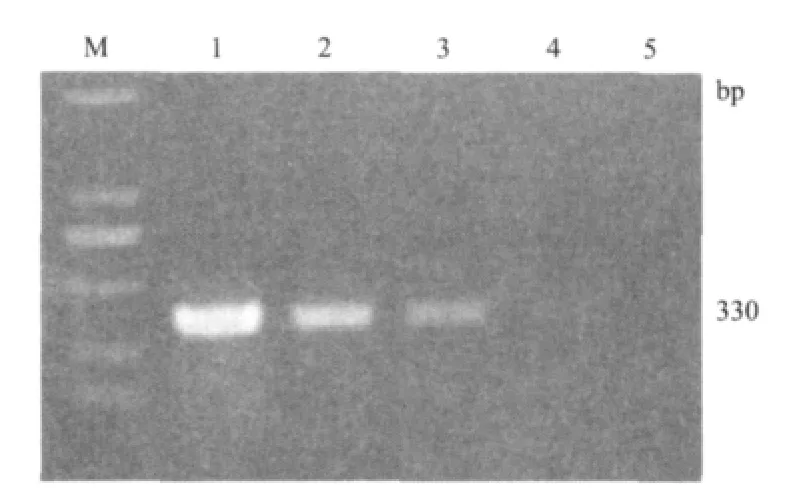
图5 RT-PCR灵敏度检测结果
3 讨论
属级筛查芯片技术是近年出现的一种用于某类病原物筛查的技术,该技术将芯片的高通量特性与属级探针的兼容性特点相结合,大大提高了病原微生物筛查鉴定的能力,已在多种病原生物的筛查中得到应用。Chou等[20]对属级探针芯片进行了有益的尝试,通过试验确证了属级芯片在新发病毒鉴定中的作用;Palacios 等[21]建立了一种名为GreeneChipPm的传染病诊断芯片平台,包括了病毒、细菌、真菌和寄生虫的29455条探针,使用该平台诊断出不明死因病人的病原生物为细菌。Huyghe等[22]对细菌序列进行探针筛选,获得9 500余条探针,在此基础上建立的芯片可区分混合细菌样品里的未知细菌。Zhang等[18]建立了13属植物病毒的属级筛查芯片,发现了三七样品中的一种新病毒;这些报道的结果证实了这种芯片技术的实用性。本研究以植物类病毒为研究对象,初步建立了苹果锈果类病毒属的属级芯片筛查技术。与以往的生物学测定、正反向聚丙烯酰胺凝胶电泳、Northern杂交及RT-PCR等技术相比,该技术有以下优点:芯片的探针是属水平上的而非目前报道中针对特定类病毒种的特异性检测探针,具有属的特征,所以能够兼容属内的所有类病毒;该技术通量高,一次反应能够确定某一样品中是否含有该属的类病毒(包括已知及未知的类病毒)。标准样品验证结果显示,建立的芯片技术可得到有效的探针信号,表明了所设计探针的有效性。
如何获得足够的标记产物以便得到有效的杂交信号是芯片检测过程中的一个重要环节。产物标记主要包括3种方式:样品中病原物含量足够多时,可在随机引物进行的反转录过程中加入荧光标记的dNTP,从而获得标记cDNA后直接进行杂交;含量中等的病原物可采用随机引物进行反转录,在随后的特异性引物PCR扩增中加入荧光标记的dNTP;含量较低的病原物需要在反转录时采用特异性引物,在PCR扩增时使用特异性引物或随机引物并加入荧光标记的dNTP。本研究的重点在于验证所设计的属级探针的适用性,所以采用了特异性引物进行RTPCR扩增来获得标记产物,但从实际应用角度考虑,应选择使用随机引物来获得标记产物,这需要进一步的试验。另外,对于含量低的病原物,为了既能获得足够的标记产物,又减少特异性扩增每种病原物的繁琐,可以采用属级或科级简并引物来进行PCR扩增。
4 结论
本研究通过属级探针设计及标准样品验证,建立了可用于苹果锈果类病毒属类病毒筛查的芯片技术。该技术的建立将有助于主动式筛查该属已知及未知的类病毒,为防止该属类病毒的传播扩散提供技术支持,从而为苹果等产业的健康发展提供一定的保障。
[1] King AMQ, Lefkowitz E, Adams MJ, et al.Virus taxonomy:Ninth report of the international committee on taxonomy of viruses[C].Amsterdam:Elsevier/Academic Press, 2011.
[2] 张振英, 姜中武.苹果锈果病的发生途径与预防措施.河北果树 , 2008(1):39-40.
[3] 李锦.苹果锈果病的鉴别与防治.安徽农业科学, 2008, 36(1):40- 41, 43.
[4] 范旭东, 董雅凤, 张尊平, 等.4种葡萄类病毒检测及序列分析.中外葡萄与葡萄酒, 2011, 5:13-17.
[5] 马先锋, 李芳, 胡春华, 等.柑橘类病毒CVd-III的检测及鉴定.植物病理学报, 2009, 39(2):207-211.
[6] Hassen IF, Kummert J, Marbot S, et al.First report of Pear blister canker viroid, Peach latentmosaic viroid, and Hop stunt viroid infecting fruit trees in Tunisia.Plant Disease, 2004, 88(10):1164.
[7] 赵英, 牛建新.应用RT-PCR和斑点杂交法检测新疆梨树上的苹果锈果类病毒.果树学报, 2007, 24(6):761-764.
[8] 赵英, 牛建新.苹果凹果类病毒(ADFVd)的检测与序列分析.果树学报, 2008, 25(5):682-685.
[9] 吴玉鹏, 牛建新.利用RT-PCR检测库尔勒香梨泡状溃疡类病毒.广西园艺, 2006, 17(3):7-8.
[10] Sipahioglu HM, Usta M, Ocak M.Development of a rapid enzymatic cDNA amplification test for the detection of Apple Scar Skin Viroid(ASSVd)in apple trees from eastern Anatolia, Turkey.Archives of Phytopathology and Plant Protection, 2009, 42(4):352-360.
[11] Rizza S, Nobile G, Tessitori M, et al.Real time RT-PCR assay for quantitative detection of Citrus viroid III in plant tissues.Plant Pathology, 2009, 58(1):181-185.
[12] Shamloul AM, Faggioli F, Keith JM, et al.A novelmultiplex RT-PCR probe capturehybridization(RT-PCR-ELISA)for simultaneous detection of six viroids in four genera:Apscavroid,Hosuviroid, Pelamoviroid, and Pospiviroid.Journal of Virological Methods, 2002, 105(1):115-121.
[13] Cohen O, Batuman O, Stanbekova G, et al.Construction of amultiprobe for the simultaneous detection of viroids infecting citrus trees.Virus Genes, 2006, 33:287-292.
[14] Wang XF, Zhou CY, Tang KZ, et al.A rapid one-stepmultiplex RTPCR assay for the simultaneous detection of five citrus viroids in China.Eur J Plant Pathol, 2009, 124:175-180.
[15] Hajizadeha M, Navarrob B, Bashira NS, et al.Development and validation of amultiplex RT-PCRmethod for the simultaneous detection of five grapevine viroids.Journal of Virological Methods,2012, 179(1):62-69.
[16] Ragozzino E, Faggioli F, Barba M.Development of a one tubeone step RT-PCR protocol for the detection of seven viroids in four genera:Apscairoid, Hostuviroid, Pelamoviroid and Pospiviroid.Journal of Virological Methods, 2004, 121:25-29.
[17] Lin LM, Li RH, Mock R, et al.Development of a polyprobe to detect six viroids of pome and stone fruit trees.Journal of Virological Methods, 2011, 171(1):91-97.
[18] Zhang YJ, Yin J, Li GF, et al.Oligonucleotidemicroarray with aminimal number of probes for the detection and identification of thirteen genera of plant viruses.Journal of Virological Methods,2010, 167(1):53-60.
[19] 苏前富, 郭瑞, 李世访, 等.苹果锈果类病毒的几种提取方法及RT-PCR检测灵敏度的比较.植物保护, 2006, 32(2):95-97.
[20] Chou CC, Lee TT, Chen CH, et al.Design ofmicroarray probes for virus identification and detection of emerging viruses at the genus level.BMC Bioinformatics, 2006, 7:232.
[21] Palacios G, Quan PL, Jabado OJ, et al.Panmicrobial oligonucleotide array for diagnosis of infectious diseases.Emerg Infect Dis, 2007,13(1):73-81.
[22] Huyghe A, Francois P, Charbonnier Y, et al.Novelmicroarray design strategy to study complex bacterial communities.Applied and Environmental Microbiology, 2008, 74(6):1876-1885.
