坏死性凋亡参与NMDA诱导大鼠皮层神经元的兴奋性神经毒作用
2013-09-13李艳丽
李艳丽,张 策,张 虹
谷氨酸是中枢神经系统重要的兴奋性神经递质。谷氨酸受体的活化在突触可塑性、学习和记忆中起重要作用[1]。在中枢神经系统,兴奋性突触传递主要由离子型谷氨酸受体介导。离子型谷氨酸受体包括AMPA受体、KA受体和NMDA受体[2]。
NMDA受体为配体门控离子通道,在许多突触活动中起重要作用[3]。但是NMDA受体的过度活化,可引起细胞内钙超载,引发一系列酶的级联反应,并最终诱导神经元死亡,被称为“兴奋性神经毒”[4]。许多急性或慢性脑组织损伤性疾病都与NMDA受体介导的兴奋毒性有着重要的联系,比如中风、癫痫和某些神经变性疾病等[5]。数据显示NMDA型谷氨酸受体通道在创伤性脑损伤的病理生理过程中具有重要的作用[6]。而且NMDA受体的过度活化是创伤性脑损伤引起神经学缺陷的主要原因,NMDA受体拮抗剂可抑制这些症状[7]。
传统上,细胞死亡被分为细胞坏死和凋亡。凋亡是一种程序化的主动性细胞死亡,且无炎症反应。坏死是病理产生的被动死亡,且这种细胞死亡方式会导致炎症物质的释放[8,9]。最近,Degterev等[10]研究发现,在细胞内不存在凋亡信号时,Fas/TNFR能活化一种非凋亡的死亡途径,称为坏死性凋亡。因同时具有坏死和凋亡的生化特征和超微结构特征而得名。同时。他们发现一种小分子物质 Necrostatin-1(Nec-1),可以特异且有效地抑制坏死性凋亡,为坏死性凋亡的鉴别提供了一个有效的工具。迄今为止,坏死性凋亡的机制并不清楚,Nec-1的发现为评价坏死性凋亡的特征及作用提供了唯一的可能。因此,本研究通过观察Nec-1对NMDA诱导的兴奋毒的抑制作用,从而明确NMDA诱导的兴奋神经毒中是否存在坏死性凋亡。
1 材料与方法
1.1 试 剂 DMEM/F-12 和 胎 牛 血 清 (Gibco-BRL);Cell Counting Kit-8(CCK-8)、calcein-AM(Dojindo);NMDA、阿糖胞苷、MK-801、多聚赖氨酸、Nec-1(Sigma);胰蛋白酶(Biosharp);乳酸脱氢酶(LDH)(南京建成生物工程研究所)。
1.2 原代细胞培养 取新生1d~3dWistar大鼠,分离大脑皮层,用胰酶消化制备单细胞悬液。细胞悬液经1 000r/min离心5min,弃上清,用完全培养液(DMEM/F-12培养基+15%胎牛血清)重悬细胞。然后接种于培养瓶或培养板上,在37℃,5%CO2的孵育箱培养。24h后加入10μmol/L阿糖胞苷。成熟的神经元(8d~10d)用于实验。
1.3 NMDA诱导兴奋性神经毒 将成熟神经元暴露于NMDA。用无镁Locke’s液洗涤细胞两次,然后用无镁Locke’s液(含或不含NMDA)孵育细胞。2h后将毒性介质移出,相应的培养液返回[11]。Nec-1组在毒性诱导前24h加入不同浓度的Nec-1(10μmol/L,30μmol/L,100μmol/L)预孵育。
1.4 细胞活力检测 细胞在96孔板培养(每孔100μL),NMDA处理2h后,将毒性介质移出,培养液返回。继续培养24h,向各孔加入10μL CCK-8溶液,在37℃,5%CO2的孵育箱孵育2h,用酶标仪测定490nm处OD值。
1.5 LDH检测 当细胞遭受损伤时,LDH由胞浆释放到胞外。NMDA毒性诱导之后,继续培养24h,收集培养液检测LDH活性。
1.6 calcein-AM染色 在Locke’s液介质中细胞与calcein-AM避光孵育20min,PBS避光洗涤两次,在490nm激发波长,515nm发射波长的滤光片的荧光显微镜下观察细胞。
2 结 果
2.1 Nec-1抑制NMDA引起的细胞活力的下降 CCK-8细胞活力检测发现NMDA引起皮层神经元兴奋毒损伤(见图1)。与对照组相比,将神经元暴露于NMDA(100μmol/L)2h使细胞活力降至(42.55±2.86)%(P<0.01)。NMDA引起的神经毒可以被NMDA受体的非竞争性拮抗剂 MK-801(10μmol/L)完全阻断,说明这种损伤是由NMDA引起的。
在NMDA作用前24h用Nec-1预处理神经元可以抑制NMDA引起的细胞活力的下降,也就是说Nec-1预处理引起细胞 活 力 的 增 加 (见 图 1)。Nec-1(30μmol/L)和 Nec-1(100 μmol/L)分别使其增加12%(P<0.05)和26%(P<0.01),但Nec-1(10μmol/L)并不能抑制NMDA引起的细胞活力的降低。
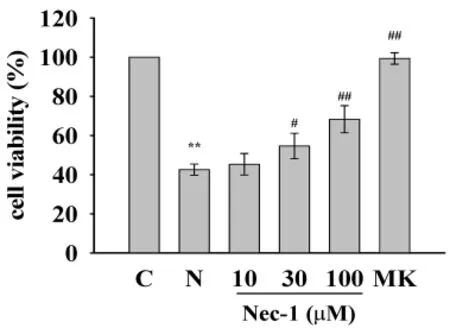
图1 Nec-1抑制NMDA引起的细胞死亡
2.2 Nec-1抑制NMDA引起的LDH释放的增加 皮层神经元暴露于NMDA可引起LDH的释放(见图2)。NMDA处理后,LDH水平与对照组相比增加54.38%(P<0.01),MK-801(10μmol/L)完全阻断 NMDA引起的 LDH 的释放。Nec-1(30 μmol/L)和 Nec-1(100μmol/L)预处理分别使 LDH 释放减少14%(P<0.05)和28%(P<0.01)。
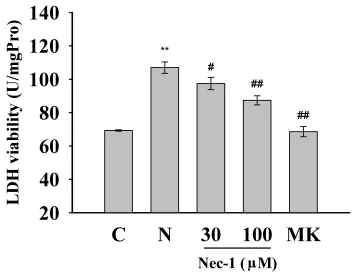
图2 Nec-1抑制NMDA引起的LDH释放
2.3 Nec-1抑制NMDA引起的活细胞数的减少 calcein-AM染色结果发现NMDA可引起活细胞数减少。NMDA处理后,calcein-AM染色阳性的神经元(代表活细胞)与对照组相比减少55.87% (P<0.01)。 与 NMDA 处 理 组 相 比,Nec-1(30 μmol/L)和Nec-1(100μmol/L)分别使活细胞数增加11%(P<0.05)和23%(P<0.01)。
3 讨 论
谷氨酸是中枢神经系统重要的兴奋性神经递质。谷氨酸受体的活化在生理状态下起重要作用[1]。同时,谷氨酸也可产生毒性作用,引起NMDA受体的过度活化,被称为兴奋性神经毒[12]。越来越多的研究表明,在许多急慢性神经性疾病,兴奋性神经毒是引起神经元死亡的机制之一,包括亨廷顿症(Huntington,s disease,HD)[13]、帕金森 氏症(Parkinson’s disease,PD)[14]和阿尔茨海默病(Alzheimer’s disease,AD)[15]。在脑缺血或中风疾病中,兴奋性神经毒也是引起神经元坏死或凋亡的机制。
坏死性凋亡是新近发现的一种细胞死亡方式,其特征为坏死的细胞死亡形态和自噬的活化[10]。据报道Nec-1可选择性抑制坏死性凋亡,用来鉴定坏死性凋亡的存在。研究发现大脑中动脉阻塞后,脑室内注射Nec-1可显著减少梗死面积,表明脑缺血损伤中有坏死性凋亡的发生[10]。
本研究最重要的发现是Nec-1抑制NMDA诱导的培养皮层神经元的损伤。已证实Nec-1抑制NMDA引起的细胞活力的降低、LDH释放和活细胞数的减少。这些结果均表明坏死性凋亡参与了NMDA诱导的细胞损伤,也就是说在NMDA诱导的兴奋性神经毒有坏死性凋亡的发生。
众所周知,NMDA受体过度活化是引起脑缺血神经元死亡的主要原因[16]。NMDA受体过度活化在许多急慢性脑损伤中起重要作用,如中风或脑缺血及某些神经变性疾病[5]。在这些神经病理过程中,由于起始损伤的严重程度不同,NMDA可诱导神经元发生凋亡或者坏死[8]。本研究证实NMDA可诱导坏死性凋亡,为系统地理解与兴奋性神经毒有关的分子途径提供了新的证据。以前的研究表明在缺血性脑损伤中存在坏死性凋亡[10],本研究表明脑缺血中存在的坏死性凋亡可能是由于缺血引起谷氨酸的过量释放引起NMDA受体的过度活化所致。
总之,NMDA诱导的兴奋性神经毒包括多种细胞死亡方式:坏死、凋亡和坏死性凋亡。坏死性凋亡在其中起重要作用,为兴奋性神经毒有关疾病的治疗提供了新的靶点。而且坏死性凋亡级联反应是可调节的,所以它可能会提供一个新的甚至更有效的治疗靶点。
[1]Maragakis NJ,Rothstein JD.Glutamate transporters in neurologic disease[J].Arch Neurol,2001,58(3):365-370.
[2]Gasic GP,Hollmann M.Molecular neurobiology of glutamate receptors[J].Annu Rev Physiol,1992,54:507-536.
[3]Liu Y,Zhang J.Recent development in NMDA receptors[J].Chin Med J(Engl),2000,113(10):948-956.
[4]Takei N,Endo Y.Ca2+ionophore-induced apoptosis on cultured embryonic rat cortical neurons[J].Brain Res,1994,652(1):65-70.
[5]Choi DW.Glutamate neurotoxicity and diseases of the nervous system[J].Neuron,1988,1:623-634.
[6]Han RZ,Hu JJ,Weng YC,etal.NMDA receptor antagonist MK-801reduces neuronal damage and preserves learning and memory in a rat model of traumatic brain injury[J].Neurosci Bull,2009,25(6):367-375.
[7]Hayes RL,Jenkins LW,Lyeth BG,etal.Pretreatment with phencyclidine,an N-methyl-D-asparatate antagonist,attenuates long-term behavioral deficits in the rat produced by traumatic brain injury[J].J Neurotrauma,1988,5(4):259-274.
[8]Fink SL,Cookson BT.Apoptosis,pyroptosis,and necrosis:Mechanistic description of dead and dying eukaryotic cells[J].Infect Immun,2005,73(4):1907-1916.
[9]Bonfoco E,Krainc D,Ankarcrona M,etal.Apoptosis and necrosis:Two distinct events induced,respectively,by mild and intense insults with N-methyl-D-aspartate or nitric oxide/superoxide in cortical cell cultures[J].Proc Natl Acad Sci USA,1995,92(16):7162-7166.
[10]Degterev A,Huang Z,Boyce M,etal.Chemical inhibitor of nonapoptotic cell death with therapeutic potential for ischemic brain injury[J].Nat Chem Biol,2005,1(2):112-119.
[11]Cebere A,Liljequist S.Ethanol differentially inhibits homoquinolinic acid-and NMDA-induced neurotoxicity in primary cultures of cerebellar granule cells[J].Neurochem Res,2003,28(8):1193-1199.
[12]Beal MF.Role of excitotoxicity in human neurological disease[J].Curr Opin Neurobiol,1992,2(5):657-662.
[13]Tabrizi SJ,Cleeter MW,Xuereb J,etal.Biochemical abnormalities and excitotoxicity in Huntington’s disease brain[J].Ann Neurol,1999,45(1):25-32.
[14]Beal MF.Excitotoxicity and nitric oxide in Parkinson’s disease pathogenesis[J].Ann Neurol,1998,44(3Suppl 1):S110-S114.
[15]Hynd MR,Scott HL,Dodd PR.Glutamate-mediated excitotoxicity and neurodegeneration in Alzheimer’s disease[J].Neurochem Int,2004,45(5):583-595.
[16]Bonde C,Noraberg J,Noer H,etal.Ionotropic glutamate receptors and glutamate transporters are involved in necrotic neuronal cell death induced by oxygen-glucose deprivation of hippocampal slice cultures[J].Neuroscience,2005,136(3):779-794.
