Tim-1分子在约氏疟原虫感染模型中的表达分析
2013-09-12祁赞梅赵国明曹雅明
祁赞梅,赵国明,韩 雪,杨 冀,冯 辉,曹雅明
(中国医科大学基础医学院免疫学教研室,辽宁沈阳 110001)
Tim-1是T细胞免疫球蛋白域和黏液素样域(T cell immunoglobulin domain and mucin domain,Tim)基因家族的分子,表达在T细胞、B细胞、树突状细胞等多种免疫细胞表面,为细胞活化提供协同刺激信号,刺激Th2细胞增殖和分泌细胞因子[1-4]。研究发现,小鼠体内分泌IL-10的调节性B细胞(regulatory B cells,Bregs)表面表达Tim-1,Tim-1结构异常导致Bregs数量和功能缺陷[5-6]。由于Bregs具有抑制Th1应答的作用[7],可以推Tim-1在免疫应答的调节中,特别是Th1/Th2应答的极化发挥重要的作用。疟疾是疟原虫通过媒介昆虫蚊传播的人类最为严重的寄生原虫感染性疾病。抗疟保护性免疫有赖于Th1和Th2型免疫应答的有效建立和协调过渡[8-9]。在约氏疟原虫P.y17XL感染模型中发现,BALB/c小鼠原虫血症难以控制并最终导致死亡与Th1应答难以建立和血浆高水平IL-10有关[10]。由于Tim-1具有调节Th应答和维持Bregs功能的作用,本研究观察了P.y17XL易感和抵抗小鼠中,Tim-1分子表达与Th应答及感染结局的关系,旨在为疟疾免疫应答调控提供新靶点。
1 材料与方法
1.1 材料
1.1.1 实验动物及疟原虫 DBA2和 BALB/c小鼠,6~8周龄,购自北京华阜康生物科技股份有限公司;约氏疟原虫P.yoelii 17XL(P.y17XL)由日本爱媛大学分子寄生虫学教研室赠予曹雅明教授。
1.1.2 主要试剂 抗-CD4-APC(GK 1.5)、抗-CD19-PE/Cy5(6D5)、抗-Tim-1-PE(RMT1-4)、TruStain fcX抗-CD16/CD32(93)及同种型对照均购自美国BioLegend公司,逆转录试剂盒Prime-Script RT Reagent Kit和实时定量 PCR试剂盒SYBR Premix Ex Taq II购自大连宝生物公司。
1.2 方法
1.2.1 实验动物感染 取1× 106P.y17XL寄生的红细胞(pRBC)经腹腔感染小鼠,自感染后3 d经尾静脉采血,制备薄血膜,Giemsa染色,显微镜检计数红细胞感染率。
1.2.2 流式细胞术检测与分析 在感染后第1、3、5天处死小鼠,无菌取出脾脏,常规方法制备脾细胞悬液,用0.17 mol/L氯化铵裂解红细胞。以含10%胎牛血清(FCS)的RPMI 1640调整脾细胞终浓度为1×107/mL。取0.1 mL脾细胞悬液,加入 TruStain fcX(抗-CD16/CD32)封闭抗体1 μg,于冰上孵育15 min。按厂商推荐剂量加入抗-CD4-APC、抗-CD19-PE/Cy5、抗-Tim-1-PE 单克隆抗体或相应荧光标记同种型抗体,于冰上避光孵育30 min。用含0.2%牛血清白蛋白(BSA)的PBS洗涤1次,重悬于含1%多聚甲醛和0.2%BSA的PBS中。于次日进行流式细胞仪(FACAriaⅡ,美国B&D公司)检测,每个样品获取10 000~50 000个细胞。采用WinMDI 2.9软件分析数据,以同种型对照为参考确定阴阳性细胞界限,结果以二维点阵图显示。
1.2.3 实时定量逆转录PCR检测细胞因子mRNA水平 在感染后第1、3、5天处死小鼠,取少量脾组织,使用Trizol试剂提取总 RNA,按 Prime-Script RT Reagent Kit说明书进行逆转录。取100 ng RNA的逆转录产物,按SYBR Premix Ex Ta试剂盒说明书配制20 μL PCR体系,于Corbett Rotor-Gene 6000(Corbett Life Science,Australia)实时定量PCR仪中进行扩增。热循环过程:95℃预变性30 s;95℃ 5 s,60℃ 30 s,45个循环。使用核糖体S17蛋白(RPS17)作为内参,利用两倍系列稀释样品制作标准曲线。使用的特异性引物序列如下:RPS17 F:5'-TGTCGGGATCCACCTCAA TG-3';RPS17 R:5'-CGCCATTATCCCCAGCAAG-3';IFN-γ F:5'-AAAGACAATCAGGCCATCAG-3';IFN-γ R:5'-TGGGTTGTTGACCTCAAACT-3';IL-10 F:5'-CAGTACAGCCGGGAAGACA-3';IL-10 R:5'-GCATTAAGGAGTCGGTTAGCA-3';Tim-1 F:5'-TGTTGAGAGTGACAGTGGTCT-3';Tim-1 R:5'-GCCTTGTAGTTGTGGGTCTT-3'。
1.2.4 统计学分析 应用SPSS 11.5统计学分析软件,Student's t-test比较分析组内和组间均值的显著性差异。P﹤0.05为差异显著。
2 结果与分析
2.1 P.y17XL感染的BALB/c和DBA2小鼠原虫血症水平和生存率比较
如图1所示,BALB/c小鼠感染P.y17XL后,外周血红细胞感染率迅速上升,在感染后6 d达到80%左右,导致8只小鼠在感染后6~7 d全部死亡,而DBA2小鼠的原虫血症一直维持较低水平,不超过10%,8只小鼠中只有1只在感染后6 d死亡,其余小鼠在感染后10 d仍然存活,2种小鼠生存率差异具有统计学意义(P﹤0.05)。
2.2 P.y17XL感染的BALB/c和DBA2小鼠脾中IFN-γ和IL-10水平的比较
BALB/c小鼠感染P.y17XL后,脾组织中Th1型细胞因子IFN-γ mRNA水平上升较慢,在感染后第5天仅为未感染小鼠IFN-γ mRNA水平的20倍,而对P.y17XL抵抗的DBA2小鼠在感染后3 d脾IFN-γ mRNA水平就接近正常小鼠的20倍;感染后第3、5天BALB/c小鼠脾 IFN-γ mRNA水平均显著低于DBA2小鼠,P﹤0.05。同时,BALB/c小鼠脾组织中Th2型细胞因子IL-10 mRNA水平在感染P.y17XL后迅速上升,在感染后第3天和第5天分别为正常小鼠90和200余倍,均显著高于DBA2小鼠(P﹤0.05和P﹤0.01)。
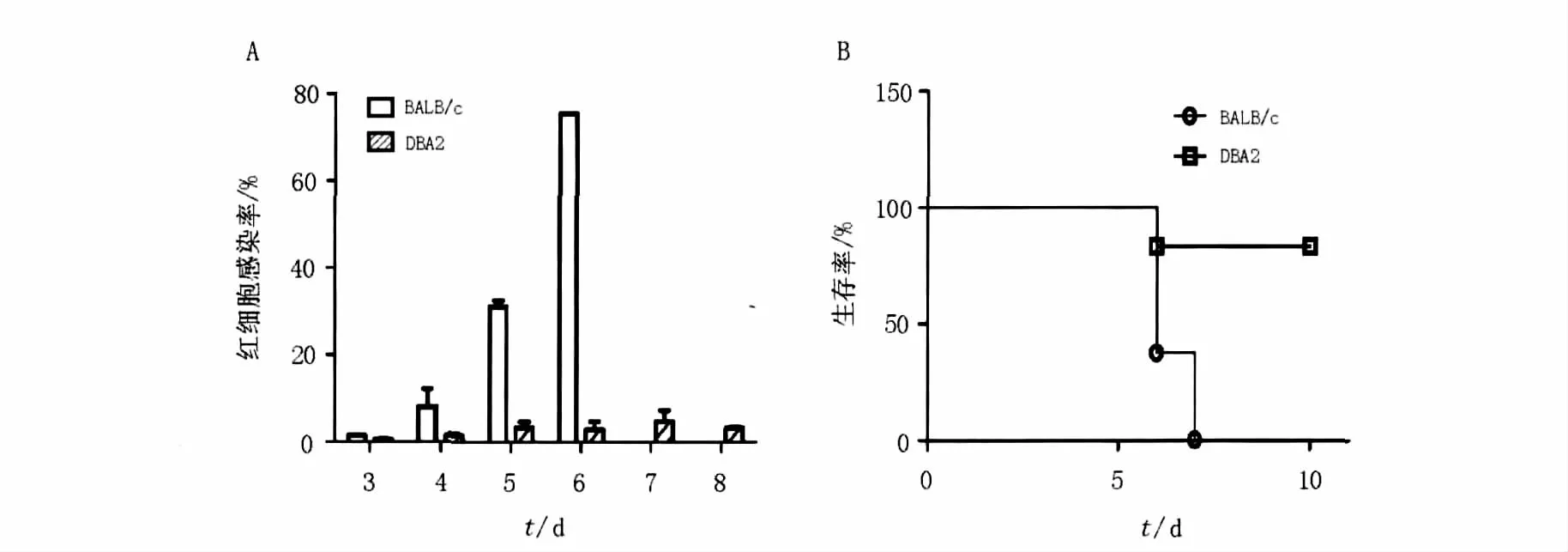
图1 BALB/c和DBA2小鼠感染P.y17XL后的原虫血症水平(A)和生存率(B)Fig.1 Parasitaemia(A)and survival rate(B)of BALB/c and DBA2 mice infected with P.y17XL
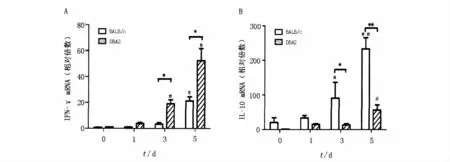
图2 BALB/c和DBA2小鼠感染P.y17XL后脾组织中IFN-γ mRNA(A)和IL-10 mRNA(B)的水平Fig.2 The mRNA level of IFN-γ (A)and IL-10(B)in the spleens of BALB/c and DBA2 mice infected with P.y17XL
2.3 BALB/c和DBA2小鼠感染P.y17XL后T细胞、B细胞表面Tim-1分子表达的动态变化
BALB/c小鼠感染 P.y17XL后第3天、第5天,脾细胞中 CD4+Tim-1+和CD19+Tim-1+细胞百分比均较未感染小鼠显著上升(P﹤0.05),但是,DBA2小鼠脾 CD4+Tim-1+和 CD19+Tim-1+细胞百分比在感染前后未见显著变化(图3)。在BALB/c和DBA2小鼠中,CD19+Tim-1+细胞占脾细胞的百分比均高于CD4+Tim-1+细胞所占百分比,CD19+Tim-1+细胞数量约为CD4+Tim-1+细胞数量的2~3倍(数据未显示)。
2.4 P.y17XL感染的BALB/c和DBA2小鼠脾中Tim-1 mRNA水平的动态变化
P.y17XL感染后,BALB/c和 DBA2小鼠脾组织中Tim-1 mRNA水平逐渐下降,感染后5 d,BALB/c和DBA2小鼠脾组织中Tim-1 mRNA水平均显著低于未感染小鼠(P﹤0.05),与脾T、B细胞表面Tim-1分子表达情况并不一致。但是,P.y17XL感染后3 d,DBA2小鼠Tim-1 mRNA水平显著低于DBA/2小鼠(P﹤0.01)。
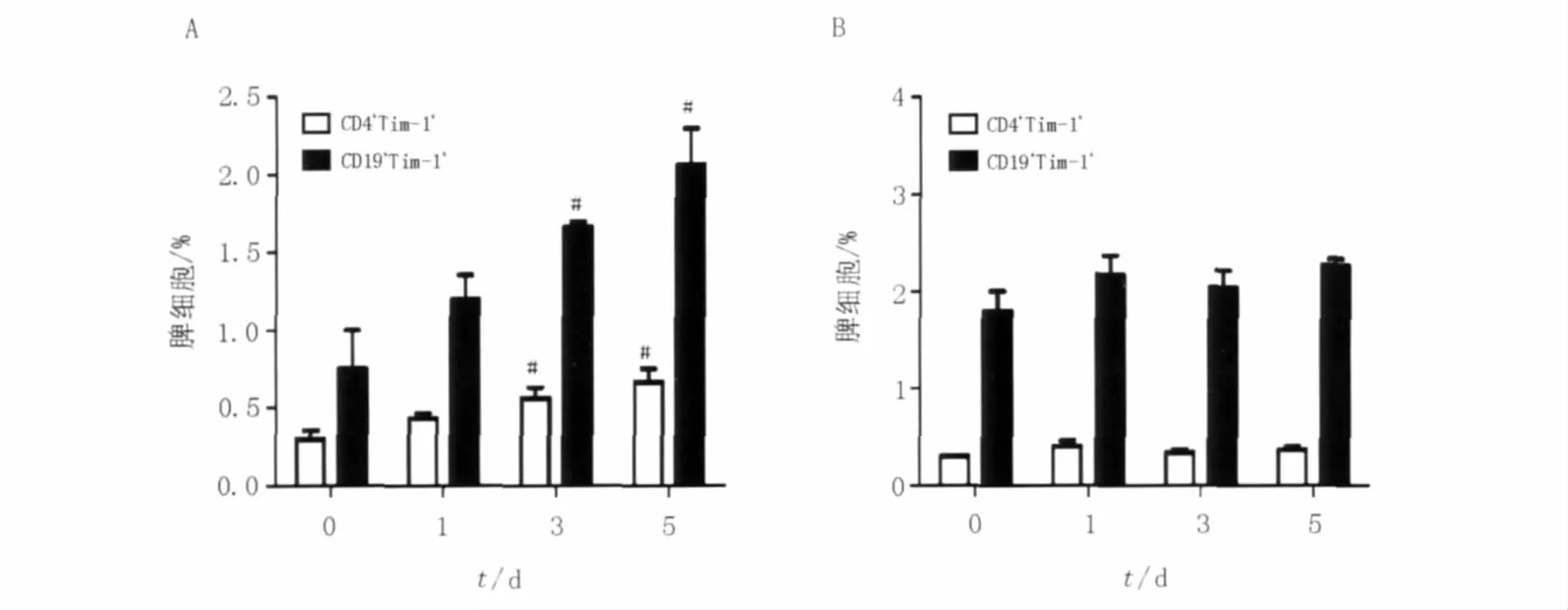
图3 BALB/c(A)和DBA2(B)小鼠感染P.y17XL后脾细胞中CD4+Tim-1+和CD19+Tim-1+细胞的百分比Fig.3 The percentage of CD4+Tim-1+cells and CD19+Tim-1+cells in the splenocytes of BALB/c(A)and DBA2(B)mice infected with P.y17XL
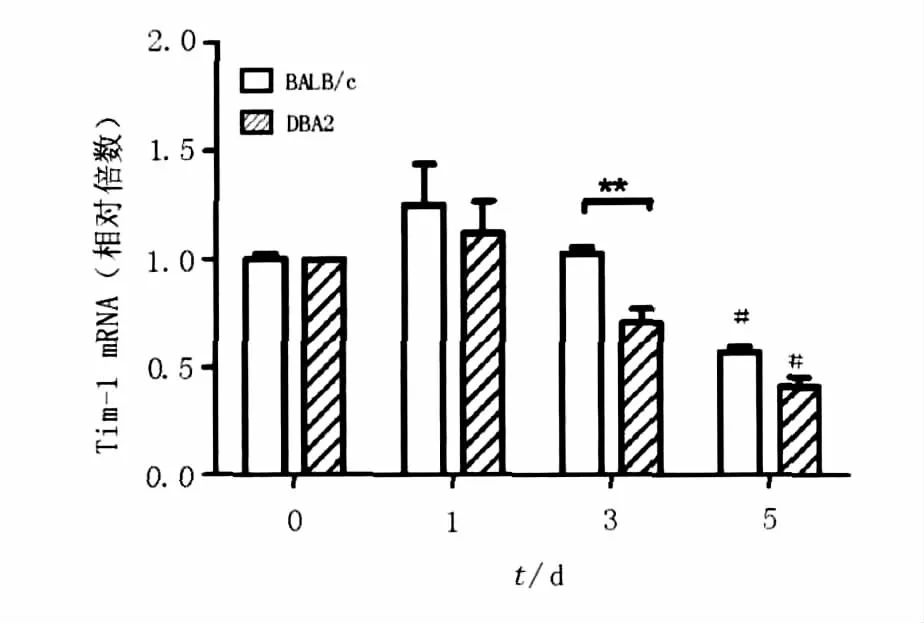
图4 BALB/c和DBA2小鼠感染P.y17XL后脾组织中Tim-1 mRNA的水平Fig.4 The mRNA level of Tim-1 in the spleens of BALB/c and DBA2 mice infected with P.y17XL
3 讨论
本文探讨了鼠疟模型中淋巴细胞表面Tim-1分子表达与细胞因子分泌谱和感染结局的关系。结果显示:对P.y17XL易感的BALB/c小鼠在感染过程中产生高水平的Th2型细胞因子IL-10,脾T、B淋巴细胞中Tim-1+细胞百分比在感染过程中显著上升;而对P.y17XL抵抗的DBA2小鼠在感染过程中产生高水平的Th1型细胞因子IFN-γ,其脾T、B淋巴细胞中Tim-1+细胞百分比无显著变化。提示具有调控 Th1/Th2极化功能的Tim-1分子可能参与抗疟疾免疫应答的调控。
Tim-1分子最初被发现表达在 CD4+T细胞[11],而后,在肥大细胞、B 细胞、树突状细胞、自然杀伤细胞等多种免疫细胞表面都发现有Tim-1分子表达[1-4]。结果显示,在小鼠脾细胞淋巴细胞中,Tim-1主要表达在B细胞表面而非T细胞上,与Rothstein等[5]的报道一致。本课题研究还显示,BALB/c小鼠感染过程中,Tim-1+B细胞百分比逐渐上升,由于大部分调节性B细胞表达Tim-1 分子[5],本研究推测,P.y17XL 感染的 BALB/c小鼠中,Tim-1+调节性B细胞可能被活化,并参与抑制 Th1应答。BALB/c小鼠Tim-1分子与DBA2小鼠比较,有较长的黏蛋白区,该区域对于调节性B细胞的抑制功能有重要作用[6,12]。研究中发现,DBA2小鼠感染过程中,Tim-1+T、B细胞百分比没有出现明显变化,可能与其Tim-1分子黏蛋白区域缺失导致Tim-1信号缺陷有关。另外,P.y17XL感染过程中,虽然BALB/c小鼠脾中Tim-1+T、B细胞百分比在感染过程中逐渐上升,且脾细胞总数也有明显升高,但BALB/c和DBA2小鼠脾组织中Tim-1 mRNA水平却逐渐下降。这种mRNA水平和细胞水平Tim-1分子表达差异的原因尚不清楚,可能存在转录后调控机制;或Tim-1分子在其他类型细胞中的表达下降,导致脾组织中Tim-1 mRNA总体水平降低。
[1] Rennert PD.Novel roles for TIM-1 in immunity and infection[J].Immunol Lett,2011,141(1):28-35.
[2] Khademi M,Illés Z,Gielen A,et al.T Cell Ig-and mucin-domain-containing molecule-3(TIM-3)and TIM-1 molecules are differentially expressed on human Th1 and Th2 cells and in cerebrospinal fluid-derived mononuclear cells inmultiple sclerosis[J].Immunol,2004,172(11):7169-7176.
[3] Nakae S,likura M,Suto H,et al.TIM-1 and TIM-3 enhancement of Th2 cytokine production by mast cells[J].Blood,2007,110(7):2565-2568.
[4] Xiao S,Zhu B,Jin H,et al.Tim-1 stimulation of dendritic cells regulates the balance between effector and regulatory T cells[J].Eur J Immunol,2011,41(6):1539-1549.
[5] Ding Q,Yeung M,Camirand G,et al.Regulatory B cells are identified by expression of TIM-1 and can be induced through TIM-1 ligation to promote tolerance in mice[J].J Clin Invest,2011,121(9):3645-3656.
[6] Xiao S,Brooks CR,Zhu C,et al.Defect in regulatory B-cell function and development of systemic autoimmunity in T-cell Ig mucin 1(Tim-1)mucin domain-mutant mice[J].Proc Natl Acad Sci USA,2012,109(30):12105-12110.
[7] Mauri C,Bosma A.Immune regulatory function of B cells[J].Annu Rev Immunol,2012,30:221-241.
[8] 郑丽,孙晓丹,潘艳,等.BALB/c小鼠感染不同疟原虫CD4+Th应答和凋亡特点的比较研究[J].微生物学杂志,2011,31(1):19-23.
[9] 冯辉,冯永辉,李莹,等.致死型夏氏疟原虫感染BALB/c小鼠CD4+CD25+Foxp3+调节性T细胞在Th2免疫应答极化中的作用研究[J].微生物学杂志,2011,31(6):36-39.
[10]Wu Y,Wang QH,Zheng L,et al.Plasmodium yoelii:distinct CD4(+)CD25(+)regulatory T cell responses during the early stages of infection in susceptible and resistant mice[J].Exp Parasitol,2007,115(3):301-304.
[11]McIntire JJ,Umetsu SE,Akbari O,et al.Identification of Tapr(an airway hyperreactivity regulatory locus)and the linked Tim gene family [J].Nat Immunol,2001,2(12):1109-1116.
[12]McIntire JJ,Umetsu DT,DeKruyff RH.TIM-1,a novel allergy and asthma susceptibility gene[J].Springer Semin Immunopathol,2004,25(3-4):335-348.