多位点序列分型在食源性金黄色葡萄球菌分型中的应用研究
2013-09-12吕国平卫沛楠徐保红
吕国平,卫沛楠,徐保红,芦 飞
(石家庄市疾病预防控制中心,河北石家庄 050000)
金黄色葡萄球菌(Staphyloccocus aureus,简称金葡菌)可引起人和动物的机会性感染,食品受其污染的几率也很高,是引起食物中毒的一种重要病原菌[1]。随着食品卫生越来越受到重视,人们不仅关心食品金葡菌的污染问题,更关注金葡菌引起的食物中毒或其引起卫生事件的溯源问题。基因分型技术逐渐成为微生物学监控的重要手段,MLST技术是近年来才发展起来的一种新型分子分型方法,对细菌的溯源有重要意义,该方法具有分辨率高、数据可靠、重复性好、便于不同实验数据比较,有利于全球范围的分子流行病学数据标准化的优势[2]。本研究应用MLST对从各类食物样品中分离的18株金葡菌进行基因分型研究,了解本地区食源性金葡菌主要流行菌株的基因型特征,为进一步研究本地区食源性金葡菌所致食物中毒的分子流行病学调查提供实验室依据。
1 材料与方法
1.1 材料
1.1.1 菌株 18株从2012年各类食品样本中分离的金黄色葡萄球菌。
1.1.2 主要试剂和仪器 Baird-Parker琼脂培养基(北京陆桥),亚碲酸钾卵黄增菌液(美国BD公司),溶葡萄球菌酶(上海生工生物工程有限公司),基因组提取试剂盒(德国 QIAGEN公司),FRIOCELLⅢ型霉菌培养箱(德国MMM公司),PrimeSTARTM高保真DNA聚合酶(大连宝生物工程有限公司),基因扩增仪(美国MJ Research),Nanodrop2000微量分光光度计(美国 Thermo),QIAXCL毛细管电泳仪(德国 QIAGEN公司)。PCR引物委托上海生工公司进行合成。
1.2 方法
1.2.1 PCR模板的制备 从Baird-Parker琼脂平板上挑取单个典型菌落接种于营养肉汤中,于37℃培养16 h,取1 mL菌液加入1.5 mL EP管中,8 000 r/min离心3 min,去上清,向沉淀中加入50 μg/mL溶葡萄球菌酶溶液(含20 mmol/L Tris·HCl,pH 8.0;2 mmol/L EDTA;1.2%Triton)200 μL,涡旋混匀后,37℃放置1 h。以下步骤按照QIAGEN DNA提取试剂盒操作说明进行,用Nanodrop2000微量分光光度计测定提取DNA的浓度,加超纯水将浓度定至10 ng/μL,-20℃保存备用。
1.2.2 引物的选取 选取 www.mlst.net网站数据库推荐的7个管家基因进行MLST分析,PCR反应选用该网站推荐的7对引物。7个管家基因及相应的PCR引物信息见表1。PCR引物委托上海生工生物工程有限公司合成。

表1 用于MLST分析的管家基因及PCR引物Table 1 The housekeeping genes and PCR primers of MLST
1.2.3 PCR扩增及产物测序 PCR反应选用25 μL体系:5×PrimeSTARTMBuffer(Mg2+plus)5 μL,dNTP Mixture(各2.5 mmol/L)2 μL,上、下游引物(10 μmol/L)各 0.5 μL,模板 DNA(10 ng/μL)3 μL,PrimeSTARTMHS DNA Polymerase(2.5 U/μL)0.25 μL,加超纯水至 25 μL;PCR 扩增条件:94 ℃预热2 min,98 ℃ 10 s,68 ℃ 45 s,35 个循环,72℃延伸5 min;PCR产物经毛细管电泳出现目的条带后,委托上海生工生物工程有限公司进行测序。
1.2.4 测序结果处理与数据分析 双向测序结果经 Sequencer软件比对并拼接后,截取成与MLST国际数据库中所对应标准序列长度一致的片段,将切割后的片段在线提交到MLST数据分析网站(www.mlst.net)进行分析,统计出各等位基因的编码和ST序列型,利用BioNumerics软件进行聚类分析,并绘制ST型别分布的区域图。
2 结果与分析
2.1 管家基因各片段的PCR扩增和测序结果
所有实验菌株均扩增出目的管家基因片段,PCR扩增条件有很好的稳定性和可重复性。7个管家基因的毛细管电泳图谱见图1。上述出现单一目的条带的所有PCR产物送测序,测序结果良好,可用于MLST分型实验研究。
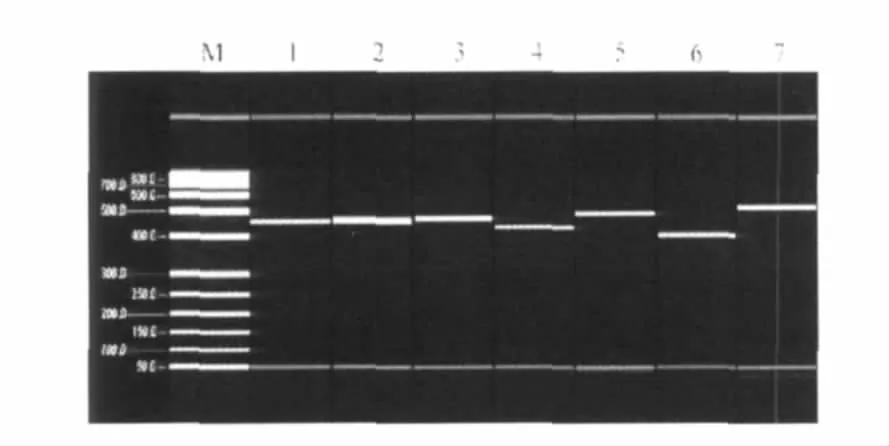
图1 7个管家基因片段的扩增结果Fig.1 The PCR products of seven housekeeping genes
2.2 MLST 分型结果
18株食源性金葡菌7个管家基因片段的测序结果经比对后拼接成标准序列长度,与国际MLST网络数据库中的目标序列进行比对,结果见表2。通过MLST分析,得到10个ST序列型,分别是 ST5型、ST6型、ST7型、ST9型、ST15、ST59型、ST464型和ST2138型;另外还有2个新的ST型别。其中 ST5序列型最多,共5株;其次为ST464序列型,共3株;ST7型和ST15型各2株;ST6型、ST9型、ST59型和ST2138型各1株。
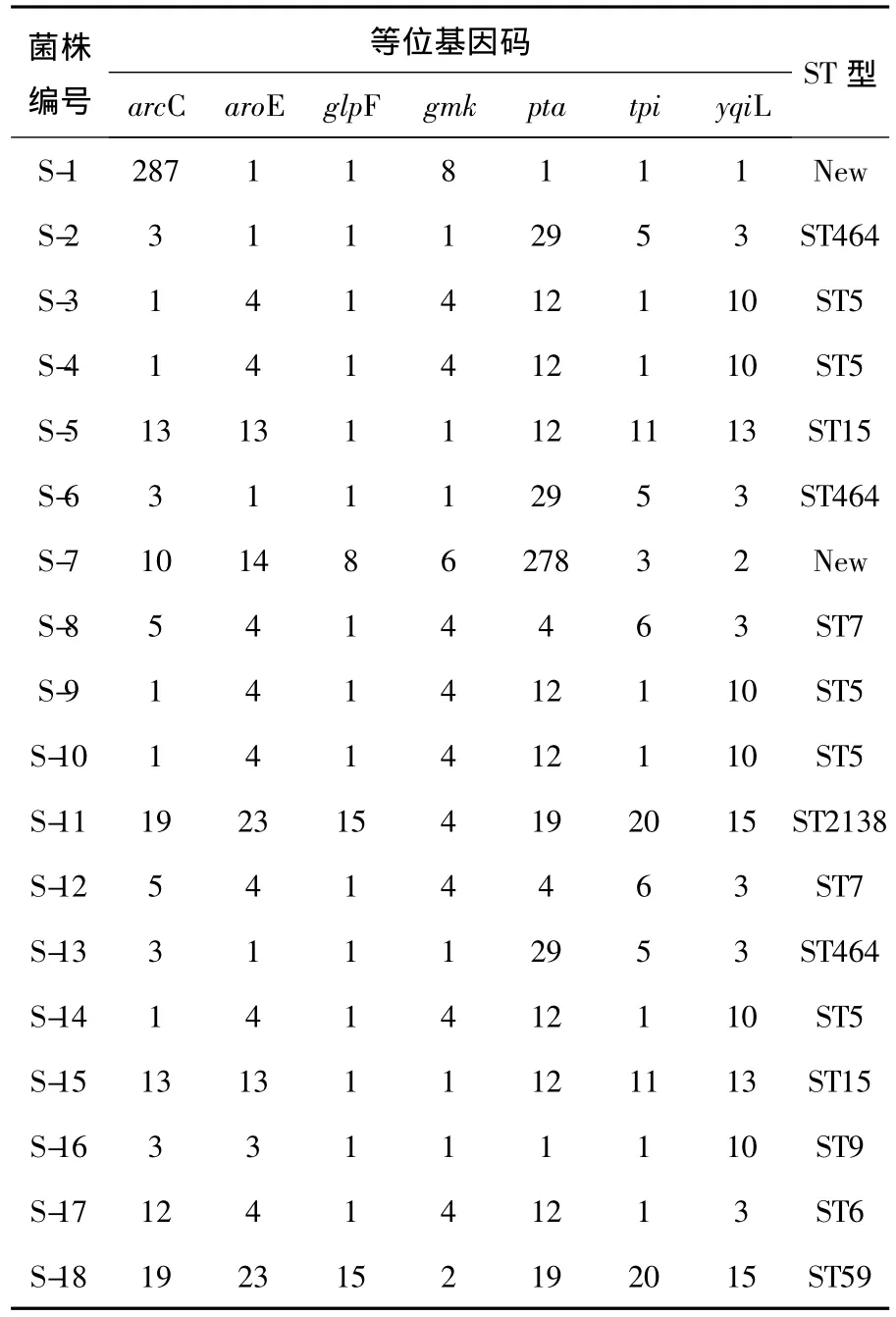
表2 MLST数据分析结果Table 2 The data analysis results of MLST
2.3 聚类分析结果
利用BioNumerics软件对各菌的等位基因码进行聚类分析,MLST分型结果见图2,结果显示18株食源性金葡菌共分为4个簇(A、B、C和D)和10个基因型。其中A簇含4个基因型(7株),分离自熟肉制品、豆制品和焙烤及油炸食品;B簇含3个基因型(8株)分离自熟肉制品、焙烤及油炸食品、豆制品和凉拌菜;C簇含2个基因型(2株),分离自熟肉制品和豆制品;D簇含1个基因型(1株)分离熟肉制品。
2.4 型别的区域分布
ST6型和ST7型金葡菌在平山县有分布,ST464型金葡菌在行唐县有分布,ST5型金葡菌在无极县有分布,ST5型和ST9型金葡菌在正定县有分布,ST15型、ST464型和ST2138型在赵县有分布,ST59型在石家庄市出现轨迹,见图3。

图2 食源性金黄色葡萄球菌的MLST聚类分析图Fig.3 The MLST clusters of foodborne Staphylococcus aureus
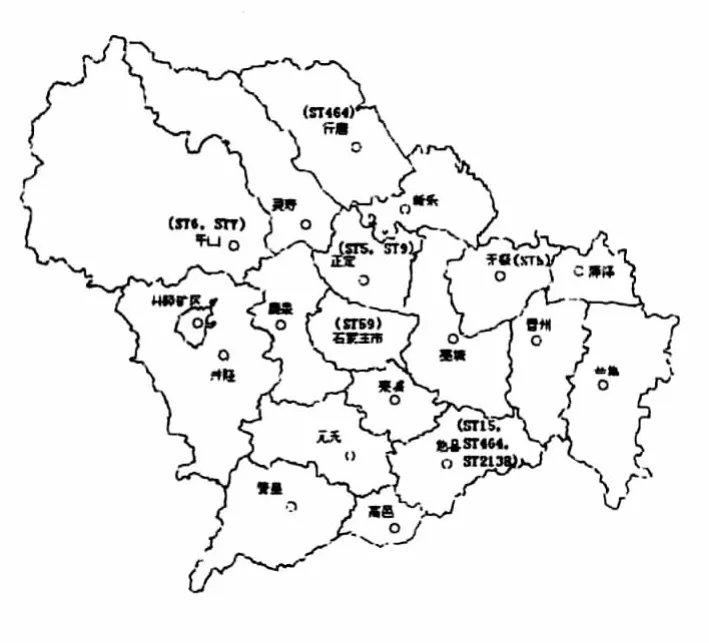
图3 ST型别地理位置分布图Fig.3 The geographical distribution diagram of ST type
3 讨论
金黄色葡萄球菌作为引起细菌性食物中毒的一种重要病原菌,具有致病因子种类多、毒力强、在环境中分布广泛、抵抗力强等特点,食品受到其污染的机会很多。因此对食源性金葡菌进行基因分型,可以为食品安全监控提供理论指导,同时,为控制其流行及临床采取有效防控措施提供理论依据。
MLST由多位点酶凝胶电泳(MLEE)改进而来[3]。MLEE属于表型分型方法,通过生物个体间多位点酶的差异来反映其遗传基础的差异。MLST技术并不分析基因的表达产物,而是分析基因的核苷酸序列。该技术所选择的基因位点序列通常位于其管家基因内部,长度一般为500 bp左右。这类管家基因在待测菌株中的存在性接近100%,并且有足够的变异度[4]。金葡菌的MLST技术针对其共有的7个管家基因设计引物,然后进行PCR扩增和产物测序,得到每个菌株各个位点的等位基因序号,继而进行等位基因图谱或序列类型(sequence types,STs)鉴定,最后再根据等位基因图谱,使用UPGMA等聚类方法构建系统进化树图[5]。MLST技术在实验过程的可操作性及实验结果的可靠性之间取得了平衡,同时该方法简便快捷、重复性强、分辨率高[6-7];此外,各实验室获得的MLST数据可提交到已建立的MLST大型国际数据库中进行比对,为全球金黄色葡萄球菌的流行病学研究提供了一个便捷的平台。该方法适用于长期的、大范围的流行病学调查(如全球流行病学调查),研究菌株的起源和进化。
通过对分离的18株食源性金葡菌进行MLST分型研究发现,本地区金黄色葡萄球菌的ST型别比较丰富,ST型别地域分布比较明显,MLST各聚类簇与地域之间没有明显的关联。本地区优势株主要为ST5型和ST464型等国际流行株,此外还新发现2株国际数据库尚未收录的新的基因型别,现已提交国际数据库等待确认后进行编号收录,以供各国实验室参考比对。由于本实验所涉及的菌株数量较少,所以研究该时间点的地区分布受限,但是对金葡菌进行MLST分型并对其进行地理位置的标注,为进行金葡菌分子流行病学的研究提供了重要的实验室数据,为今后分析金葡菌引起的食物中毒打下了基础。
[1] Elena Ortega,Hikmate Abriouel,Rosario Lucas,et al.Multiple roles of Staphylococcus aureus enterotoxins:pathogenicity,superantigenic activity,and correlation to antibiotic Resistance[J].Toxins,2010,2(8):2117-2131.
[2] Katherine M.E.Turner,Edward J.Feil.The secret life of the multilocus sequence type[J].International Journal of Antimicrobial Agents,2007,29(2):129-135.
[3] Cooper J E,Feil E J.Multilocus sequence typing what is resolved[J].Trends Microbiol,2004,12(8):373-377.
[4] Pullinger G D,López-Benavides M,Coffey T J,et al.Application of Streptococcus uberis multilocus sequence typing:analysis of the population structure detected among environmental and bovine isolates from New Zealand and the United Kingdom[J].Appl Environ Microbiol,2006,72(2):1429-1436.
[5] Maiden M C,Bygraves A,FeilE,et al.Multilocus sequence typing:a portable approach to the identification of cloneswithin population of pathogentic microorganism [J].Proc Natl Acad SciUSA,1998,95(6):3140-3145.
[6] 邓小玲,管大伟,黎薇,等.多位点测序分型技术在病原微生物分型鉴定中的应用[J].微生物学通报,2007,34(6):1188-1191.
[7] 刘佳妍,金莉莉,王秋雨.细菌基因组重复序列PCR技术及其应用[J].微生物学杂志,2006,26(3):90-93.