1株产几丁质酶海洋细菌Z-1的分离与鉴定
2013-09-12薛永常
薛永常,张 灿
(大连工业大学生物工程学院,辽宁大连 116034)
几丁质是由N-乙酰-D-氨基葡萄糖以β-1,4糖苷键连接成的高分子多糖,广泛存在于甲壳动物和昆虫的外壳及藻类、真菌类的细胞壁及高等植物中[1]。几丁质降解获得的生理活性的几丁寡糖水溶性好,易于吸收,具有较好的抗真菌、抗癌良好的生物降解性及无毒性等特点,已广泛应用于医药、食品、农业、环保和保健等领域[2-7]。目前制备几丁寡糖的方法有物理降解法、化学降解法、酶解法和合成法[8]。酶解法反应条件较温和,具有不需要加入其他反应试剂,不发生其他副反应,产物聚合度适中、高效、节能、无污染等优点,是公认的最佳生产工艺。目前制备的几丁质酶活性较低,难以获得大量的专一性的几丁质酶,使几丁质酶的生产成本过高,不能满足生产的需要,因此研究高活性几丁质酶是解决几丁寡糖生产制备的关键[9]。几丁质酶(chitinase)是能催化降解几丁质β-1,4糖苷键的一类水解酶,许多微生物都能产生几丁质酶[9-12]。在海洋环境中有着大量几丁质,其降解主要通过微生物完成,海洋菌是几丁质酶的重要来源。本文从大连海域的泥样中筛选出1株能将几丁质转化成多种低聚糖的海洋菌,通过对该菌株进行生物学鉴定为将来更好地认识和进一步利用它提供理论依据。
1 材料与方法
1.1 材料
1.1.1 试剂 几丁质购于合肥博美生物技术有限公司;乙酰氨基葡萄糖(NAG)购于阿尔法公司;胶体几丁质自制[13-14];薄层层析用硅胶G购于青岛海洋化工有限公司;细菌基因组DNA提取试剂盒(溶液型)购自北京百泰克生物技术有限公司;琼脂糖回收试剂盒购自天根生化科技(北京)有限公司。
1.1.2 主要培养基(g/L) ①分离培养基:胶体几丁质 1,K2HPO40.7,KH2PO40.3,蛋白胨 10,MgSO4·7H2O 0.5,FeSO4·7H2O 0.01,ZnSO4·7H2O 0.01,琼脂 18,陈海水定容至 1 L,调整至pH 7.0,121 ℃灭菌 20 min;②发酵培养基:胶体几丁质 1,K2HPO40.7,KH2PO40.3,蛋白胨 10,MgSO4·7H2O 0.5,FeSO4·7H2O 0.01,ZnSO4·7H2O 0.01,蒸馏水定容至 1 L,调整至 pH 7.0,121℃灭菌20 min;③肉汤培养基:牛肉膏3,蛋白胨10,NaCl 5,pH 7.0,121 ℃灭菌20 min;④LB 培养基:蛋白胨 10,酵母提取物 5,NaCl 10,pH 7.0,121℃灭菌20 min。
1.2 方法
1.2.1 筛选产几丁质酶菌株 采用平板稀释法和透明圈法筛选出产几丁质酶菌株。取大连海域的海泥样品,加入适量无菌陈海水悬起,上清液涂布于胶体几丁质筛选平板上,28℃培养3~5 d,观察在菌落周围是否产生透明圈,挑选透明圈直径与菌体直径比较大的菌株作为初筛的产酶菌。
1.2.2 酶催化几丁质降解产物分析 酶反应体系:各取发酵液1 mL,4℃、1 000 r/min离心10 min,取上清 0.5 mL,加入 0.5 mL 1%胶体几丁质(质量体积比),pH 值为7.0的0.2 mmol/L磷酸缓冲液1 mL,50℃下保温30 min,煮沸10 min,冷却。产物分析:将酶促反应液与含有2~6聚合度的混合几丁寡糖标准品同时进行薄层层析。在薄层层析硅胶板上点样,展开剂:异丙醇∶V水∶25%氨水 =280∶119∶5.3(体积比),室温,上行展开2~3次;显色剂:二苯胺2 g,苯胺2 mL,质量分数为85%磷酸10 mL溶于100 mL丙酮中,混匀,快速浸泡后85℃烘箱烘烤10 min。
1.2.3 菌株的形态观察及生理生化鉴定 用扫描电镜观察Z-1菌的形态结构,并对菌株进行形态观察与生理生化鉴定[15]。
1.2.4 细菌基因组 DNA的提取与16S rDNA PCR扩增 参照细菌基因组DNA提取试剂盒(溶液型)提取Z-1菌基因组DNA为模板,采用16S rDNA通用引物对其进行PCR扩增。上游引物为5'-AGAGTTTGATCATGGCTAG-3';下游引物为5'-GTTACCTTGTTACGACTT-3'。PCR产物经1%琼脂糖凝胶电泳检测后由上海生工生物工程技术有限公司测序。
1.2.5 序列分析及系统发育树的构建 将测序结果通过BLAST工具、Clustal X(1.8)软件进行亲缘关系和系统进化分析,利用MEGA4.0软件进行分析,并以自展法(bootstrap)进行检测,共循环1 000次,采用最大似然法构建系统发育树最大树(Maximum likelihood tree)。
2 结果与分析
2.1 产几丁质酶菌株的筛选与鉴定
利用几丁质分离培养基对初筛获得菌株进行复筛。接种后于28℃培养,每隔24 h测量1次在筛选平板菌落外围形成的透明圈直径(D)及菌落的直径(d),根据透明圈与菌落的直径比(D/d),挑选纯化3个菌株进行酶活测定。菌株的生长形态如图1。

图1 菌体透明圈Fig.1 Transparent rings of strains
将Z-1、Z-2和Z-4等3个菌株进行发酵培养,初始酶液用DNS法测其酶活,其结果如表1。从表1可以看出菌株Z-1的初筛与复筛中透明圈与菌落的大小比最大,酶活较高,故选择Z-1作为后续工作的菌种。
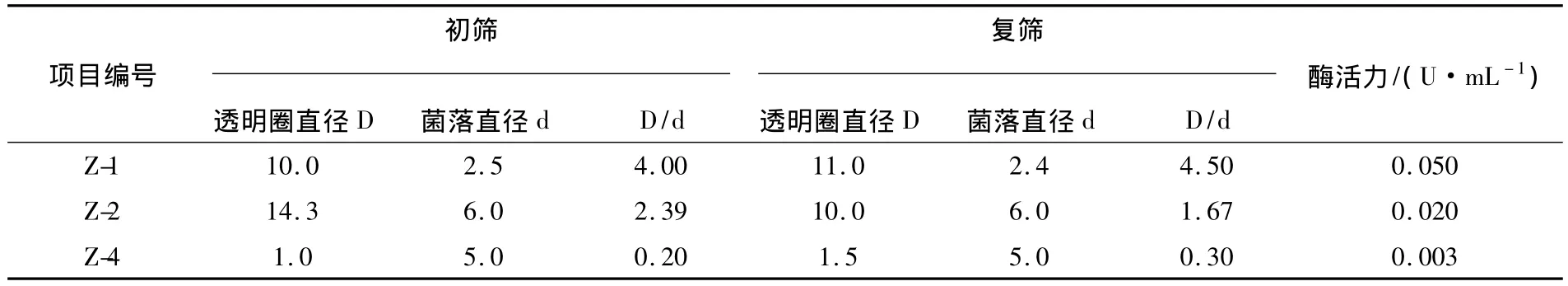
表1 菌落筛选及酶活测定情况Table 1 Colony screening and activity determination
通过对Z-1催化胶体几丁质降解的产物进行薄层层析分析,其主要产物为聚合度4~5的几丁寡糖(图2),为功能性低聚糖,医用保健具较高的应用价值,在农业、医药和食品领域等也具有潜在的开发和应用价值。
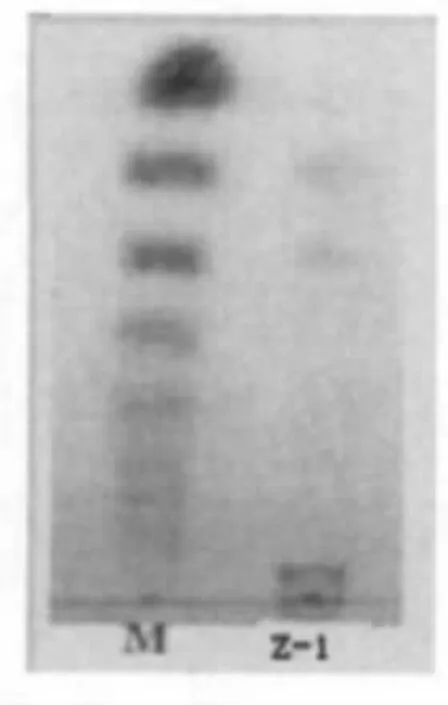
图2 Z-1降解胶体几丁质的薄层色谱分析Fig.2 TLC Analysis of the Degradation of colloidal chitin of Z-1
2.2 Z-1的形态学观察

图3 电镜下Z-1菌株的形态(1 000×)Fig.3 The micrograph of strain Z-1 under scanning electron microscope(1 000×)
通过扫描电镜观察,Z-1为革兰阳性的杆菌形态(图3);该菌株在28℃的肉汤培养基上培养24 h后,菌株呈淡黄色凸起的圆形菌落;光滑、湿润;菌落由白变黄;菌落直径为2.0~4.0 mm。革兰阳性菌,产芽胞。Z-1菌株细胞呈规则杆状,(0.6~1.2)μm ×(1.5 ~6.0)μm,不形成菌丝体,无分支,细胞表面光滑,无鞭毛,不运动。细胞单个,成链或不规则群状出现。老培养物有时细胞变短,但没有明显的杆-球周期变化。Z-1生理生化特征见表2。根据常见细菌杆菌属检索表初步鉴定认为该细菌为芽胞杆菌属。

表2 Z-1的生化特征Table 2 The biochemical characteristics of strain Z-1
2.3 Z-1的16S rDNA扩增与序列分析
提取Z-1菌株的基因组DNA经1%琼脂糖凝胶电泳检测后,作为模板对其16S rDNA进行扩增,其扩增结果如图4A所示,得到1条大约1.5 kb的清晰单一条带,条带整齐无降解。对产物进行回收纯化如图4B所示,送上海生工生物工程技术有限公司测序。
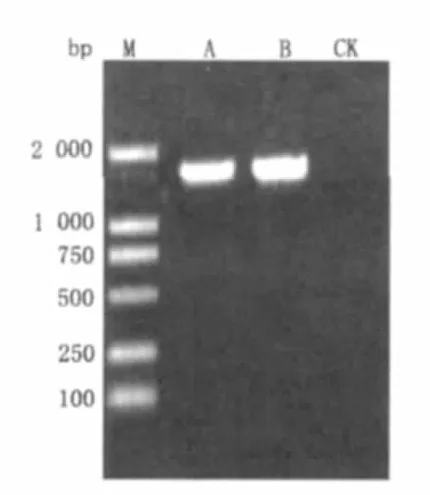
图4 Z-1菌株扩增的16S rDNA凝胶电泳图Fig.4 Gel electrophoresis of 16S rDNA of Z-1
2.4 Z-1的16S rDNA序列比对及进化树的建立
Z-1菌株的16S rDNA PCR扩增片段长为1 456 bp。Z-1的16S rDNA序列的BLAST比对结果显示,与杆菌属(Bacillus)的某些种如Bacillus thuringiensis、Bacillus cereus、Bacillus anthracis 的16S rDNA序列同源性最高,可达到99%。选取10个包括Z-1菌株以及GenBank数据库中与Z-1菌株同源性较高的细菌构建进化树,如图5所示。
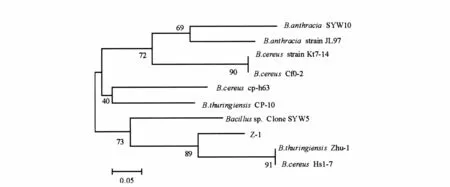
图5 Z-1菌株的系统发育树Fig.5 The phylogenetic tree of Z-1
由系统发育分析,在与Z-1菌株具有较高同源性的杆菌属细菌中,B.thuring iensis zhu-1(苏云金芽胞杆菌)和B.cereus Hs1-7(蜡样芽胞杆菌)与Z-1处于同一个分支,该结果与序列同源性比较结果一致,进一步表明Z-1菌株可能同属于芽胞杆菌属,暂定名为Bacillus sp.Z-1。该菌有可能是海洋环境的1个新菌株,有待进一步验证。
3 讨论
海洋环境中含有丰富的几丁质[16],如虾壳、蟹壳等,这些物质如果不经过处理,就会造成严重的环境污染,因此,从海洋环境中筛选能够产生几丁质酶的微生物具有重要的现实意义。本文以胶体几丁质为唯一底物,从大连海域海洋样品中分离的菌株Z-1,不但能分泌几丁质降解酶,而且能进一步酶解将几丁质转化为聚合度4~5的几丁寡糖的多种多功能性低聚糖,这将极大提高此类低聚糖产品的应用价值。对菌株Z-1进行了生理生化鉴定及进化树构建,表明Z-1为Bacillus属中的进化种群,为进一步认识和利用Z-1以获得大量的新型几丁质降解酶制备几丁寡糖奠定了基础。
[1] 蒋挺大.甲壳素[M].北京:化学工业出版社,2003.
[2] 李丽,杨雪松,刘红全.微生物几丁质酶的特性及其应用的研究进展[J].广西民族大学学报(自然科学版),2011,17(1):92-96.
[3] 薛惠琴,孙国荣,杭怡琼.浅谈虾仁生产废弃物的开发利用[J].上海畜牧兽医通讯,2009,(2):105.
[4] Jayakumar R,Prabaharan M,Sudheesh Kumar P.T.,etal.Biomaterials based on chitin and chitosan in wound dressing applications[J].Biotechnology Advance,2011,29(3):322-337.
[5] Rinaudo M.Chitin and chitosan:Properties and applications[J].Progress in polymer science,2006,31(7):603-632.
[6] 刘和众,刘东辉.几丁质在农业上的应用[J].应用技术,2001,(3):11-13.
[7] Gupta R,Saxena R K,Chaturvedi P.,et al.Chitinase Production by Streptomyces viridificans:its potential in fungal cell wall lysis[J].J.Appl Bacteriol,1995,78(4):378-383.
[8] 李艾华,杜予民,李瑾,等.聚合度3~6甲壳寡糖的制备与TOF-MS分析[J].分析科学学报,2004,20(3):233-236.
[9] Osawa R,Koga T.An investigation of aquatic bacteria capable of utilizing chitin as the sole source of nutrients[J].Lett Appl Microbiol,1995,21(5):288-291.
[10]Robbins P W,Albright C,Benfield B,et al.Cloning and expression of a Streptomyces plicatuschitinase(chitinase-63)in Escherichia coli[J].J Bio Chemi,1988,263(1):443-447.
[11]Yuen G Y,Sarath G.Chitinase from the Plant Disease Biocontrol Agent Stenotrophomonas maltopilia Strain C3[J].Phytopathology,2001,91(2):1276-1288.
[12]肖湘,周樱,王风平.高效几丁质降解菌CB101的分离、鉴定及其几丁质酶系的研究[J].海洋学报,2003,25(1):138-142.
[13]张灿,黄德智,李丰硕,等.海洋产几丁质酶菌株的筛选及发酵条件优化[J].吉林农业大学学报,2012,34(2):141-146.
[14]陈红.广谱抗病虫几丁质酶产生菌的筛选与几丁质酶分子生物学研究[D].雅安:四川农业大学,2002:4-5.
[15]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[16]丁存宝,刘海燕,贾长虹,等.海洋微生物几丁质酶分离纯化及其抗真菌活性[J].微生物学杂志,2009,29(4):73-76.