间歇低氧对大鼠肝脏氧化应激损伤的研究
2013-09-11张祯董丽霞李硕周伟万南生王志强
张祯 董丽霞 李硕 周伟 万南生 王志强
间歇低氧对大鼠肝脏氧化应激损伤的研究
张祯 董丽霞 李硕 周伟 万南生 王志强
目的 通过建立大鼠模型并测定间歇低氧及持续低氧大鼠肝脏中过氧化产物丙二醛(MDA)水平,探讨睡眠呼吸暂停模式间歇低氧对大鼠肝脏氧化应激损伤的机制。方法 雄性Wistar大鼠96只,随机分为3组:间歇低氧组(IH),持续低氧组(CH)和常氧对照组(SC)。分别于暴露第2、4、6、8周随机抽取8只大鼠麻醉处死,留取肝脏组织,应用化学比色方法检测大鼠肝脏MDA水平。结果 大鼠肝脏MDA含量IH组明显高于CH组和SC组(均P<0.01),IH及CH组MDA水平随暴露时间延长逐渐增加。结论 睡眠呼吸暂停模式间歇低氧能引起大鼠肝脏发生氧化应激反应而导致肝损伤,其损伤程度比持续低氧更为严重,且随时间延长而增加。
间歇低氧;氧化应激;肝损伤
阻塞性睡眠呼吸暂停低通气综合征(obstructive sleep apnea hypopnea syndrome,OSAHS)可引发冠心病、高血压、高脂血症和肝肾功能障碍等多器官的损害,其病理生理学基础是慢性间歇低氧(chronic intermittent hypoxia,CIH)[1]。目前有研究认为间歇低氧可引起肝脏细胞呈现氧化应激状态而导致肝损伤[2]。本研究模拟人OSAHS建立慢性间歇低氧大鼠动物模型,动态比较间歇低氧和持续低氧干预对大鼠肝脏中脂质过氧化产物丙二醛(MDA)变化的影响,探讨其肝脏损伤的机制。
1 材料和方法
1.1 实验分组及暴露处理 雄性Wister大鼠96只,随机分为3组,每组32只,分别置于相同的自制动物饲养舱中。实验对照组(SC) 以空气(21% O2)5L/min持续充入饲养舱;持续低氧组(CH) 以低氧混合气(10% O2)5L/min持续充入饲养舱;间歇低氧组(IH)给予低氧(10% O2)/复氧(21% O2)循环处理,每120s循环充入压缩空气和纯氮,使舱中氧浓度30s内从21%降至10%,40s内再次恢复至21%,后维持常氧直至下个循环。各组大鼠每天暴露8 h(9:00am~5:00pm),8 h以外室内常规饲养。分别于实验暴露2周、4周、6周、8周末,从各组随机抽取8只大鼠,清晨空腹,麻醉后股动脉放血处死,迅速解剖分离肝脏组织,制成肝组织匀浆并离心取上清液,测定各样本蛋白浓度并标定稀释至同一总蛋白浓度,液氮速冻后转入-80℃冰箱保存待测。
1.2 大鼠肝脏MDA测定 采用化学比色法测定各标定后的组织匀浆液待测标本中MDA含量,测定试剂盒购自于南京建成生物工程研究所,操作方法严格按试剂盒说明书操作。

2 结果
实验结束时,3组大鼠全部存活。间歇低氧组(IH)及持续低氧组(CH)与常氧对照组(SC)大鼠肝脏MDA含量比较,各组之间及各检测时间点(2W,4W,6W,8W)肝组织匀浆中MDA含量的差异有统计学意义,P<0.01,IH组MDA含量显著高于CH组及SC 组,IH组及CH组MDA含量随暴露时间延长而呈上升趋势。见图1,表1。
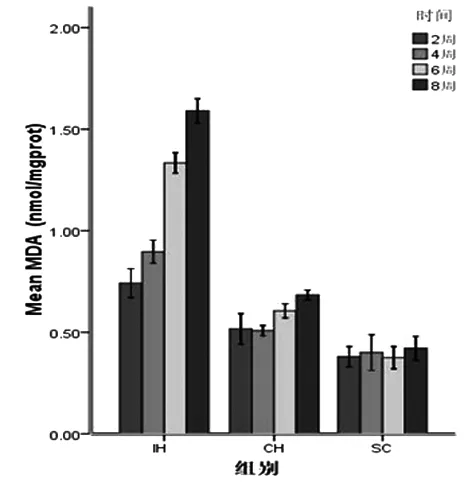
图1 不同低氧程度和时间大鼠肝脏MDA含量变化

表1 不同组别大鼠肝脏MDA含量变化
注:纵向比较各组与CH组比较aP<0.05,bP<0.01,各组与SC组比较cP<0.01;横向比较,各组与2W组比较dP<0.01
3 讨论
近年研究认为,间歇低氧模式是睡眠呼吸暂停综合征造成多器官损害的主要病理生理机制。OSAHS发作时的间歇低氧表现为周期性的反复缺氧/再氧合循环,可导致活性氧簇(reactive oxygen apeeies,ROS)的产生,而后ROS介导的全身和细胞的氧化应激反应,引起一系列的级联炎症反应,临床上最终发生OSAHS的多器官损伤[3,4]。法国学者Tanne等曾首先报道OSAHS是脂肪型肝炎的危险因素[5],Savransky等美国学者在一系列动物实验中也证实了在脂代谢紊乱的基础上慢性间歇低氧可促使模型鼠从单纯性脂肪肝向脂肪型肝炎进展[6]。CIH对肝脏的损伤是一个缺氧/复氧的过程,其类似于肝脏的缺血再灌注损伤,涉及到许多调节机制和多种细胞因子的参与,使整个炎症反应过程呈现级联放大效应[7]。有研究认为肝脏氧化应激产生的ROS和过氧化物激活NF-κB和NF-κB介导的炎症通路[8],从而导致严重的肝脏损伤。本实验研究结果表明间歇低氧及持续低氧均可引起脂质过氧化产物丙二醛的明显增加,从而导致肝损伤,而严重的间歇低氧比持续低氧会对肝组织造成更加严重的损害,分析其原因可能是因为与持续低氧比较,间歇低氧以周期性的再氧合为特征,大量活性氧自由基的产生引起氧化应激反应,ROS和过氧化物作为第二信使,启动和调节氧化还原敏感信号通道和转录因子,导致一系列严重的级联炎症反应,而间歇低氧条件下肝脏氧化应激与炎症反应相互影响的机制尚需进一步研究探讨。
[1] Patil S P, Schneider H, Schwartz AR, et al. Adult obstructive sleep apnea Pathophysiology and diagnosis. Chest Journal, 2007, 132(1): 325-337.
[2] Savransky V, Nanayakkara A, Vivero A, et al. Chronic intermittent hypoxia predisposes to liver injury. Hepatology, 2007, 45(4): 1007-1013.
[3] Svatikova A, Wolk R, Lerman LO, et al. Oxidative stress in obstructive sleep apnoea. European Heart Journal, 2005, 26(22): 2435-2439.
[4] Lavie L. Obstructive sleep apnoea syndrome-an oxidative stress disorder. Sleep Medicine Reviews, 2003, 7(1): 35-51.
[5] Tanné F, Gagnadoux F, Chazouilleres O, et al. Chronic liver injury during obstructive sleep apnea. Hepatology, 2005, 41(6): 1290-1296.
[6] Savransky V, Bevans S, Nanayakkara A, et al. Chronic intermittent hypoxia causes hepatitis in a mouse model of diet-induced fatty liver. American Journal of Physiology-Gastrointestinal and Liver Physiology, 2007, 293(4): G871-G877.
[7] Tatsumi K, Saibara T. Effects of obstructive sleep apnea syndrome on hepatic steatosis and nonalcoholic steatohepatitis. Hepatology research, 2005, 33(2): 100-104.
[8] Takahashi Y, Ganster R W, Gambotto A, et al. Role of NF-κB on liver cold ischemia-reperfusion injury. American Journal of Physiology-Gastrointestinal and Liver Physiology, 2002,283(5):G1175-G1184.
300052天津医科大学总医院重症医学科
