三叶木通叶斑病病原菌鉴定
2013-09-11刘昱锋马银峰
刘昱锋, 张 铮,2,3*, 马银峰
(1.陕西师范大学生命科学学院,西安 710062;2.陕西师范大学 药用资源与天然药物化学教育部重点实验室,西安 710062;3.西北濒危药材资源开发国家工程实验室,西安 710062)
三叶木通[Akebia trifoliata (Thunb.)Koidz.]为木通科木通属木质藤本植物,原产于中国和日本,在中国分布于山东、河北、山西、陕西、甘肃及长江流域各省[1]。三叶木通全株均可入药,2010年版《中华人民共和国药典》收录其藤茎作为药用部分,其具有利尿通淋,清心除烦,通经下乳的功效[2],现代药理学证明其所含齐墩果酸具有抗肿瘤活性[3]。
为了适应中药现代化的要求,我国一些地方已开展了三叶木通的标准化种植。但在陕西的种植地,连续三年发现部分区域三叶木通叶斑病严重,叶片大量脱落,严重影响药材的生长。为了明确叶斑病的病原和有效控制叶斑病的发生和蔓延,提高三叶木通药材质量和产量,本研究对三叶木通人工栽培基地三叶木通叶斑病病原菌进行研究,旨在为三叶木通叶斑病的防治和GAP种植实施提供依据。
目前国内外对于三叶木通病害方面的研究较少。Yoshinori Kobayashi等,根据三叶木通炭疽病病原菌形态特征,将其鉴定为尖孢炭疽菌(Colletotrichum acutatumSimmonds ex Simmonds)[4]。梁志怀等人对湖南省长沙的三叶木通褐斑病进行了研究,根据病原菌孢子形态将其鉴定为链格孢属真菌(Alternariasp.),并进行了室内防治药剂筛选[5]。而作者的田间调查表明,叶斑病症状与以前报道的炭疽病症状不同,与褐斑病症状与发展进程存在差异。
曾有学者采用传统的真菌分类方法,从培养特征与孢子形态方面对三叶木通病原菌进行了鉴定。由于真菌形态特征的复杂性与随环境变化的不稳定性,因此,采用传统分类法的分析结果易产生意见分歧。rDNA-ITS区受到较低的选择压力,物种间ITS区序列表现出较高的差异,其被广泛应用于物种的鉴定[6]。为了弥补传统分类方法的不足,本研究采用rDNA-ITS区序列分析结合病原菌的形态特征对陕西三叶木通人工栽培地的三叶木通叶斑病进行较为科学的鉴定。
1 材料和方法
1.1 供试试剂
d NTP Mix和Taq DNA 聚合酶购自 TaKaRa公司,DL2000Marker购自西安润德生物科技有限公司,通用引物ITS1:5′-TCCGATGGTGAACCTGCGG-3′和ITS4:5′-TCCTCCGCTTATTGATATGC-3′由上海生物工程有限公司合成,其他试剂均为国产分析纯。
1.2 病害调查与症状观察
根据本实验室前期研究,三叶木通叶斑病发生期为4-9月。从4月末开始,每30d调查一次,直到9月末停止调查。随机调查50株,每株分上、中、下共调查30片叶。统计病叶率并按下式计算病情指数,病情指数采用国际通用的9级分级标准[7]。观察病斑的变化,并记录各时期的症状特点。

1.3 病害样本采集
从栽培地采集具有典型病斑的三叶木通叶片,装入灭过菌的牛皮纸袋中,带回实验室立即进行病原菌的分离。
1.4 病原菌的分离纯化
将采集的具有典型症状的三叶木通叶斑病叶片,先在70%的乙醇中消毒10~15s,再置于有效氯含量1%的次氯酸钠中消毒2min左右,无菌水漂洗3次后,切取病健交界处5mm×5mm的组织块,置于PDA培养基上,于25℃恒温培养箱中培养(12h光照/12h黑暗),待菌丝长出后,开始挑取组织块周围不同菌丝转接到新的PDA培养基上培养,通过2~3次连续的转接纯化菌落。对于产孢真菌,采用单孢分离的方法纯化;不产孢的真菌,挑取单菌丝片段纯化,获得纯的培养物[8]。将纯化的真菌4℃下保存,作为待试菌。
1.5 病原菌的致病性测定
按照柯赫氏法则,采用离体叶片无伤接种法,对分离的菌物进行接种测定试验,确定叶斑病的致病菌。接种所用的叶片为健康、无任何斑点的幼叶,流水和无菌水将叶片冲洗干净,灭菌滤纸吸干叶片上残留的水分,70%酒精棉擦拭叶片表面。将活化培养5d的纯分离物菌丝块置于叶片上,放入无菌培养皿内,接种叶片下垫无菌水湿润的无菌滤纸,25℃保湿培养,以放置培养基块的叶片为对照,每组接种30片叶片,重复3次。
叶片接种菌物后,观察叶片发病情况,比较接种叶片症状与叶斑病原始症状,按照上述1.3中方法对发病叶片的致病菌再分离与纯化。将分离的病原物的菌落形态、菌落颜色、孢子形态等培养性状与最初接种分离物进行比较,确认病害的致病菌。
将致病菌活化培养10d,收集孢子,配成106个/mL的孢子悬浮液。分别采用直接悬滴法和针刺悬滴法接种,每叶定点接种5μL孢子悬浮液,放入无菌培养皿内,接种叶片下垫无菌水湿润的无菌滤纸,25℃保湿培养,以滴加5μL无菌水的叶片为对照,每组接种30片叶,重复3次[9]。
接种后,观察叶片发病情况,比较接种叶片症状与叶斑病原始症状,按上述1.3中方法对发病叶片致病菌再分离纯化。将分离纯化的分离物与接种物进行比较,确认病害的病原菌。
1.6 病原菌的形态观察
活化病原菌,从菌落边缘取直径5mm病原菌丝块置于PDA培养基上,25℃培养,观察病原菌在PDA培养基上的菌落形态、大小、产孢情况、色素分泌等性状。参照张天宇[10]的方法,挑取少许菌体涂布于PCA+滤纸上,5d后在显微镜下观察分生孢子梗与分生孢子形态,并测量其大小,观察病原菌的产孢表型,将获得的数据与《中国真菌志》(第十六卷)中相关种的数据比对。
1.7 病原菌的分子鉴定
1.7.1 病原菌DNA提取
将病原菌转接到PDA平板上活化培养5d,从菌落边缘取直径5mm菌丝块,接种至PD液体培养基,28℃、150r/min摇床培养3d,收集菌丝,参考杨建雄[11]和张铮[12]提取DNA的方法,在加入 CTAB 提取缓冲液之前,加入洗涤缓冲液(140mmol/L NaCl,200mmol/L Tris-HCl,50mmol/L EDTA,4%β-巯基乙醇),洗去材料中的多糖。其余步骤同CTAB法中的步骤。
1.7.2 病原菌rDNA-ITS区扩增和序列分析
基于前期对病原菌形态的初步研究,初步认为其为链格孢属真菌。根据孙霞[12]等人对链格孢属rDNA-ITS区序列的研究,选取PCR扩增引物:ITS1:5′-TCCGTAGGTGAACCTGCGG-3′,ITS4:5′-CCTCCGCTTATTGATATGC-3′[14]。PCR反应体系:10×Taq buffer 2.5μL、25mmol/L MgCl21.5μL、2.5mmol/L dNTP 2.0μL、10μmol/L正反向引物各2.0μL、20ng/μL DNA模板1μL、5U/μL TaKaRa Taq 0.2μL,补水至总体积25μL。PCR反应条件:94℃3min;94℃30s,52℃30s,72℃45s,40个循环;72℃10min。4℃保存。PCR反应产物用1%的琼脂糖凝胶电泳检测。PCR产物纯化及测序由上海生物工程有限公司完成。
将病原菌rDNA-ITS区序列与GenBank核酸数据库中已登录注册的rDNA-ITS区序列进行比对,下载同属及不同属形态上相似的菌株rDNAITS序列[15]。用ClustalX程序将该菌株与同源性较近的菌株的ITS序列在相应位置对齐,采用Maximum Likelihood法建立系统进化树。
2 结果
2.1 叶斑病田间发生情况
通过田间调查发现,该病在4月开始出现,但发病率低,病情轻;7月后田间叶片的发病率为100%,6月和7月是该病的快速发展期;8月至9月病情发展变慢(见表1)。

表1 三叶木通叶斑病的发病率与病情指数Table 1 The incidence and disease index of leaf spot of A.trifoliata
2.2 叶斑病病害症状
4月三叶木通叶斑病开始发生,4月至5月为初期,叶片病部出现红褐色针尖状圆点,随后圆点逐渐扩大,红褐色圆点扩大为1~2mm的斑点。6月至7月末为其叶斑病中期,红褐色圆点逐渐扩展成近圆形或多个病斑相接成不规则形病斑,病斑呈红褐色或深红褐色,病健部交界明显。8月至9月为叶斑病后期,是三叶木通叶斑病严重发生的时期,病斑进一步扩大并连成大病斑,病斑呈黑褐色,叶片背面出现霉层(图1)。发病严重的植株,整株叶片布满病斑,且叶片大量脱落,严重影响其光合作用及生长。

图1 田间病叶不同时期症状Fig.1 Symptoms of the diseased leaves at different stages in the field
2.3 病原菌致病性测定
菌丝块无伤接种幼叶,与对照相比,接种真菌的叶片可以发病。接种36h后,叶片均表现出感病变化。患病叶片表现出的症状与田间自然发病症状相似。从接种后发病的组织再次分离出该致种真菌,菌落形态、孢子形态与接种真菌一致。
然后,用该真菌孢子悬浮液接种刺伤的幼叶,48h后叶片开始发病,发病率为100%;用该真菌孢子悬浮液接种无伤的幼叶,72h后叶片开始表现出感病变化,发病率为53.3%(图2)。患病叶片表现出的症状与田间自然发病症状相似,而对照未发病。从接种后发病的组织再次分离到该致病菌,结果证明该致病菌为叶斑病的病原菌。

图2 接种后叶片症状Fig.2 The symptoms of the leaves after being inoculated
2.4 病原菌的形态特征
该病原菌在PDA培养基上菌落平展,绒状,近圆形。菌落灰白色,边缘白色,背面褐色(图3a)。菌丝灰白色,具隔分支。分生孢子梗分化明显,单生或簇生,直或略弯,分隔,偶分支,淡褐色;分生孢子串生,形状有近椭圆形、卵形、倒棒状形,淡褐色到黄褐色,分生孢子光滑或极少数具瘤。在PCA+滤纸上,成熟的分生孢子具有4~7个横隔膜,纵或斜隔膜0~4个,常有1~4个主横隔膜因较粗而色深,分生孢子大小为(21.93~44.63)μm×(7.80~11.62)μm。喙以及柱状假喙,颜色比孢身浅,无隔膜或有1个隔膜,喙大小为(3.2~12.15μm)×(2.0~4.00)μm(图3b)。在PCA+滤纸培养中,5d内可形成超过10个孢子连接而成的链状,多数孢子只在假喙顶端次生产孢,个别分生孢子侧向次生产孢,多数分生孢子长链不分支,个别孢子链有侧链,侧链上1~5个孢子串生(图3c)。分生孢子梗从主菌丝上直接产生,直立,偶分支、分隔、淡褐色。
根据孢子形态特征,结合《中国真菌志》,可将病原菌初步鉴定为半知菌亚门(Deuteromycotina),丝孢纲(Hyphomycetes),丝孢目(Hyphomycetales),暗色菌科(Dematiaceae),链格孢属(Alternaria),结合其产孢表型进一步将其鉴定为细极链格孢[Alternaria tenuissima(Fr.)Wiltshire]。

图3 病原菌形态特征Fig.3 Morphology of the pathogen
2.5 三叶木通病原菌rDNA-ITS区扩增和序列分析
以病原菌DNA为模板,用真菌通用引物ITS1/ITS4对其rDNA-ITS区进行PCR扩增,得到一个长度为541bp的扩增片段(图4)。将扩增的PCR产物进行测序,得到rDNA-ITS区序列。用BLAST在GenBank中搜索同源序列,进行比对和分析。该菌株与细极链格孢[Alternaria tenuissima(Fr.)Wiltshire](JN986764.1)相似性为99%,所得分值为977;与链 格 孢 [Alternaria alternata(Fr:Fr.)Keissler](JN618076.1)和 芸 苔 链 格 孢 [Alternaria brassicae(Berk.)Sacc.](JN108903.1)的相似性为99%,所得分值为974;与葱链格孢[Alternaria porri(Ellis)Ciferri](JF422730.1)相似性均为99%,所得分值为966。该病原菌与已登录注册的细极链格孢(A.tenuissima)(GenBank登录号JN986764.1)比对所得分值最大,相似度最高。构建的系统进化树中,聚类结果显示,该病原菌(聚类图中以The pathogen代替)与A.tenuissima、A.alternata、A.brassicae、A.porri聚为一类(见图5),而与另外的链格孢属不同菌株及另外两个形态相似属菌株分开。
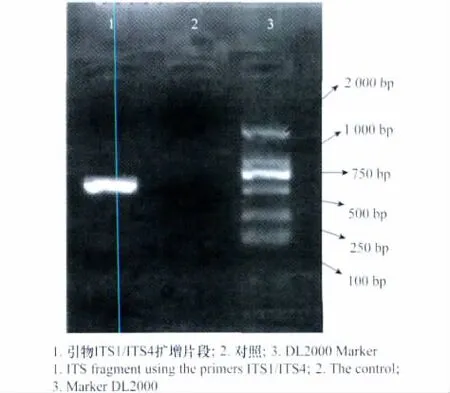
图4 rDNA-ITS区扩增片段电泳图Fig.4 Electrophoretogram of rDNA-ITS PCR products

图5 病原菌rDNA-ITS区系统进化分析Fig.5 Phylogenetic analysis of the pathogen based on rDNA-ITS sequences
3 讨论
目前报道的三叶木通病害为炭疽病和褐斑病。炭疽病开始症状为褐色坏死小斑,随后,病斑中央变为浅灰白色,潮湿条件下,病斑上出现包含橙色到橙红色孢子的子实体。褐斑病有时微显轮纹,随着病斑数量增多、面积增大,一些病斑可相互连成不规则的大病斑,叶片成为畸形。褐斑病的症状与叶斑病症状存在差异,叶斑病病斑无轮纹,发病叶片为正常形态,但这两种病害病症所表现的颜色很相近。通过对镇安人工栽培地三叶木通叶斑病病原菌的分离与初步形态鉴定,发现叶斑病病原菌为链格孢属中的一种。
在本研究菌株的分子鉴定中,该菌株序列与链格孢、芸苔链格孢、细极链格孢等的序列相似性均为99%,仅借助ITS序列无法将该菌株准确鉴定到种。准确鉴定该病原菌需结合菌株形态学特征,尤其是产孢表型。这与孙霞[13]等人的研究结果相似,rD-NA-ITS区段DNA序列差异对链格孢(特别小孢子种)提供的遗传信息少,其进化未达到判定种间差异的程度,不能单独作为链格孢种级分类的有效手段,必须结合其显微形态特征。
根据张天宇主编的《中国真菌志》(第十六卷)[10],链格孢(A.alternata)具特征性的短分支的孢子链,一般做合轴式延伸,孢子链类似小树丛状;芸苔链格孢(A.brassicae)具有横隔6~11个,孢子单生;葱链格孢(A.porri)具有横隔5~11个,孢子单生,罕见链生;而我们分离到的该菌株孢子横隔数为4~7个,5d内可形成超过10个孢子连成的孢子链,主链上罕见分支,这与Alternaria tenuissima(Fr.)Wiltshire的孢子形态及产孢表型相同。在blast序列比对结果中,该病原菌与登录号为JN986764.1的一株A.tenuissima最为相似;虽然聚类分析显示该病原菌与A.tenuissima、A.alternata、A.brassicae、A.porri聚为一类,但结合4株链格孢属真菌的孢子形态特征及产孢表型可将它们准确区分开。所以综上所述,将该病原菌鉴定为半知菌亚门,丝孢纲,丝孢目,暗色孢科,链格孢属的细极链格孢(A.tenuissima)。
本研究通过病原菌的产孢表型与rDNA-ITS区序列对其准确鉴定,为其有效的防治与深入研究提供了重要基础。
[1] 中国科学院中国植物志编辑委员会.中国植物志(第二十九卷)[M].北京:科学出版社,2001:4-9.
[2] 国家药典委员会.中华人民共和国药典(2010年版一部)[M].上海:中国医药科技出版社,2010:59.
[3] 高慧敏,王智民.木通属药用植物研究进展[J].中国中药杂志,2006,31(1):10-14.
[4] Yoshinori Kobayashi,Takanori Tsukamoto,Naohiko Miyai,et al.Anthracnose of three-leaf akebia (Akebia trifoliata Koidzumi)caused by Colletotrichum acutatum[J].Journal of General Plant Pathology,2004,70(5):295-296.
[5] 梁志怀,魏林,彭俊彩,等.人工栽培三叶木通褐斑病病原菌鉴定及防治药剂室内筛选[J].植物保护,2009,35(4):158-161.
[6] 陈剑山,郑服丛.ITS序列分析在真菌分类鉴定中的应用[J].安徽农业科学,2007,35(13):3785-3786.
[7] 徐文耀.普通植物病理学实验指导[M].北京:科学出版社,2006:122-123.
[8] 方中达.植病研究方法[M].北京:中国农业出版社,2007:122-145.
[9] 刘芳,高原,张竞颐,等.北京地区非洲菊叶斑病病原菌鉴定[J].菌物学报,2010,29(1):22-26.
[10]张天宇.中国真菌志(第十六卷)[M].北京:科学出版社,2003:1-200.
[11]杨建雄.生物化学与分子生物学实验技术教程(第二版)[M].北京:科学出版社,2009:92-93.
[12]张铮,王强.三叶木通总DNA提取方法的比较[J].西北农业学报,2005,14(3):141-144.
[13]孙霞.链格孢属真菌现代分类方法研究[D].泰安:山东农业大学,2006:98-117.
[14]White T J,Bruns T,Lee S.Analysis of phytogenetic relationships by amplification and direct sequencing of ribosomal RNA genes[M]∥Innis M A,Gelfand D H,Sninsky J J,et al.PCR protocols:A guide to methods and applications.San Diego:Academic Press,1990:315-322.
[15]沈瑞清,康萍芝,张丽荣.链格孢属Alternaria nees与形态相似属区别的研究进展[J].宁夏农业科技,2003(6):60-62.
