表达α-烯醇化酶重组腺病毒的构建及其在籽鹅卵泡颗粒细胞中的过表达
2013-09-11王江璐张伟宏郭景茹杨焕民柳巨雄李士泽孔凡志
计 红,王江璐,张伟宏,郭景茹,杨焕民*,柳巨雄,李士泽,孔凡志
(1.黑龙江八一农垦大学动物科技学院,黑龙江大庆163319;2.吉林大学畜牧兽医学院,吉林长春130062)
禽类的产蛋性能主要取决于卵巢中卵泡的生长发育水平,并受品种、环境和饲养管理等因素的影响。籽鹅是世界上产蛋性能最好的鹅品种之一,研究籽鹅卵泡发育的调控机制具有重要的意义。本实验室利用产蛋前期(5月龄)和产蛋期(8月龄)籽鹅卵巢组织,获得产蛋期籽鹅卵巢组织高表达的26个差异表达序列标签(Expressed sequence tags,ESTs)[1],并对其进行实时荧光定量PCR检测,表明籽鹅快速生长的卵泡中 α-烯醇化酶(α-Enolase,ENO1)相对表达量显著高于原始卵泡,通过生物信息学分析,推测ENO1可能对鹅卵泡发育具有重要调控作用[2-3]。
ENO1是一种在细胞质和细胞核中表达的糖酵解关键酶,主要催化2-磷酸甘油脱水,生成含高能磷酸键的磷酸烯醇式丙酮酸[4]。此外,研究显示ENO1可以作为纤维蛋白溶酶原受体参与纤溶过程,从而调节细胞的融合和分化进程[5];作为c-myc启动子结合蛋白,能够与c-myc P2启动子结合,负向调控细胞生长、分化[6];同时还显示自身免疫病性视网膜病变患者体内存在抗ENO1抗体,并特异性定位于神经节细胞层及内核层,诱导该区域细胞发生凋亡,导致失明[7]。
颗粒细胞从卵泡生长启动、增殖、分化、闭锁/排卵到卵泡退化,颗粒细胞在数量、形态和功能等方面均发生着各种变化,对促进卵泡发育具有重要作用。为了研究ENO1对禽类颗粒细胞功能的影响,我们采用在籽鹅卵泡颗粒细胞中过表达ENO1的方法,构建籽鹅ENO1重组腺病毒,并在籽鹅卵泡颗粒细胞中进行过表达,为开展ENO1对禽类颗粒细胞的功能研究奠定基础。
1 材料和方法
1.1 实验动物及采样 实验动物来自黑龙江省大庆市大同区北方种鹅场,随机选取5只5月龄品种特征明显、系谱明确的健康雌性籽鹅,迫杀后迅速采取卵巢组织,用DEPC水洗净组织样品,液氮罐中冻存过夜,-80℃冰箱保存。
1.2 菌种、表达载体与主要试剂 DH5a感受态菌为本实验室保存;重组穿梭载体pShuttle-CMV-GFP和pAdxsi重组腺病毒骨架载体购自北京诺赛基因组研究中心;限制性内切酶购自New England Biolabs公司;T4DNA ligase购自Fermentas公司;pfx DNA ploymerase与TRIzol购自Invitrogen公司;质粒小/中量提取纯化试剂盒、DNA纯化试剂盒与DNA凝胶回收与纯化试剂盒均购自威格拉斯生物技术(北京)有限公司;反转录试剂盒购自TaKaRa公司;鼠抗ENO1单克隆抗体(MAb)购自Abcam公司;羊抗鼠Rockland荧光-IgG购自美国Rockland公司;血清(Solarbio)购自北京 Solarbio&Technology公司;培养液(Hyclone M 199)购自赛默飞世尔生物化学制品(北京)有限公司。
1.3 总RNA的提取 取籽鹅卵巢组织约30mg,按照TRIzol法进行其总RNA的提取。
1.4 引物设计及合成 根据GenBank中登录的北京鸭ENO1基因序列(M 20749.1),应用Oligo 7.0软件设计ENO1编码区扩增引物,序列为ENO1α-U:5'-GGTGCGGGGTGTTCAAGATGTC-3'; ENO1α-R:5'-TCCACCAGCAGCCATCAA-3',预期扩增片段为1327bp。
1.5 ENO1基因的克隆测序 采用反转录试剂盒合成cDNA,以其为模板,进行PCR扩增。反应体系为:10×PCR Buffer(Mg2+20mmol/L)5μL,dNTP M ixture(2.5mmol/L)8.0μL,模板cDNA 2μL,上、下游引物各1μL,Taq DNA聚合酶0.5μL,去离子水补充至50.0μL。反应条件为:94℃5m in;94℃30s、55℃ 1m in 30s、72℃ 30s,35个循环;72℃10m in。扩增产物经琼脂糖凝胶电泳鉴定,琼脂糖凝胶DNA纯化试剂盒纯化回收。将产物克隆至pMD18-T载体中构建重组质粒pMD-ENO1,由上海生工生物工程技术服务有限公司测序,结果应用DNAStar软件进行序列比对。
1.6 重组穿梭质粒的构建 将pMD-ENO1及穿梭载体pShuttle-CMV分别用Hin dⅢ和EcoRⅠ双酶切,切胶回收目的基因片段和载体片段,T4DNA连接酶连接,构建重组穿梭质粒pShuttle-CMV-ENO1。
1.7 重组腺病毒质粒的构建 将pShuttle-CMVENO1和pAdxsi重组腺病毒骨架载体质粒分别用I-CeuI、I-SceI酶切,回收目的片段和载体片段采用T4DNA连接酶连接,转化感受态菌DH5a,构建重组腺病毒质粒pAd-CMV-ENO1。提取重组腺病毒质粒,并采用XhoⅠ对其酶切鉴定。
1.8 重组腺病毒的制备及扩大培养 采用质粒抽提试剂盒大量抽提pAd-CMV-ENO1,利用PacⅠ酶切使其线性化。通过脂质体Lipofectamine 2000转染80%~90%融合的293(R)细胞,于37℃ 5%CO2条件下继续培养至产生细胞病变(CPE),收集细胞,反复冻融3次,取细胞培养液上清,在293(R)细胞中传代,以含20%胎牛血清的完全DMEM培养液于37℃,5%CO2条件下培养,逐日观察CPE。待细胞完全病变后收毒,-80℃保存。
将293(R)细胞按4×106个/瓶的密度接种于6个75cm2培养瓶中,再接种收集的病毒上清,待所有细胞脱落后收获病变细胞混悬液,于3000g离心5min,弃上清,加入6m LST buffer(培养液+10%血清+2.5%甘油),混匀后于-80℃和37℃反复冻融3次,4000g离心5m in,取上清,按同样密度接种于40个75cm2方瓶中进行扩增,待细胞完全病变,混悬液于4000g离心,弃上清,沉淀用腺病毒保存液重悬,经反复冻融后于-80℃保存待用。
1.9 重组腺病毒滴度的测定 测定并计算重组腺病毒OD260nm/OD280nm值,反应病毒的纯度;将重组腺病毒10倍稀释后,计算病毒的颗粒滴度;采用Reed-Muench法[8]测定重组腺病毒的TCID50值,并计算病毒的感染性滴度。
病毒颗粒滴度(VP/m L)=OD260nm×稀释倍数×1.1×1012
1.10 Ad-CMV-ENO1在籽鹅卵泡颗粒细胞中过表达的检测 培养制备原代籽鹅卵泡颗粒细胞,分为重组腺病毒感染组(Ad-CMV-ENO1)、非重组腺病毒组(Ad-CMV-null)与细胞对照组。将收集的病毒上清接种于颗粒细胞单层培养后,分别提取RNA和蛋白质进行基因和蛋白表达量的检测。
采用实时荧光定量RT-PCR(qRT-PCR)检测各组ENO1基因表达量。检测引物序列为:ENO1α-U: 5'-GCTGATGCTCCCATGTTCGTGAT-3';ENO1α-R:5'-GTGGTGCAAGAGGCATTGCTGAC-3',扩增片段183bp。反应体系:SYBR Prem ix Ex TaqTM12.5μL,模板 cDNA 2μL,上、下游引物各1μL,去离子水补充至25.0μL。反应条件:94℃10m in;94℃ 5s、56℃ 30s、72℃ 20s,45个循环。
采用western blot检测蛋白表达量,分别以鼠抗ENO1的 MAb(1∶1000)和 鼠 抗 β-actin 的 MAb(1∶1000)为一抗,以羊抗鼠 Rockland荧光 -IgG(1∶2000)为二抗,荧光显色,蛋白条带采用LICOR Odyssey双色红外激光成像系统进行分析,根据其灰度的深浅和面积大小计算每一条带的密度值,计算目的蛋白的相对表达量。
1.11 统计学分析 采用SPSS17.0软件对实验数据进行方差分析,以p<0.05为差异有统计学意义。
2 结 果
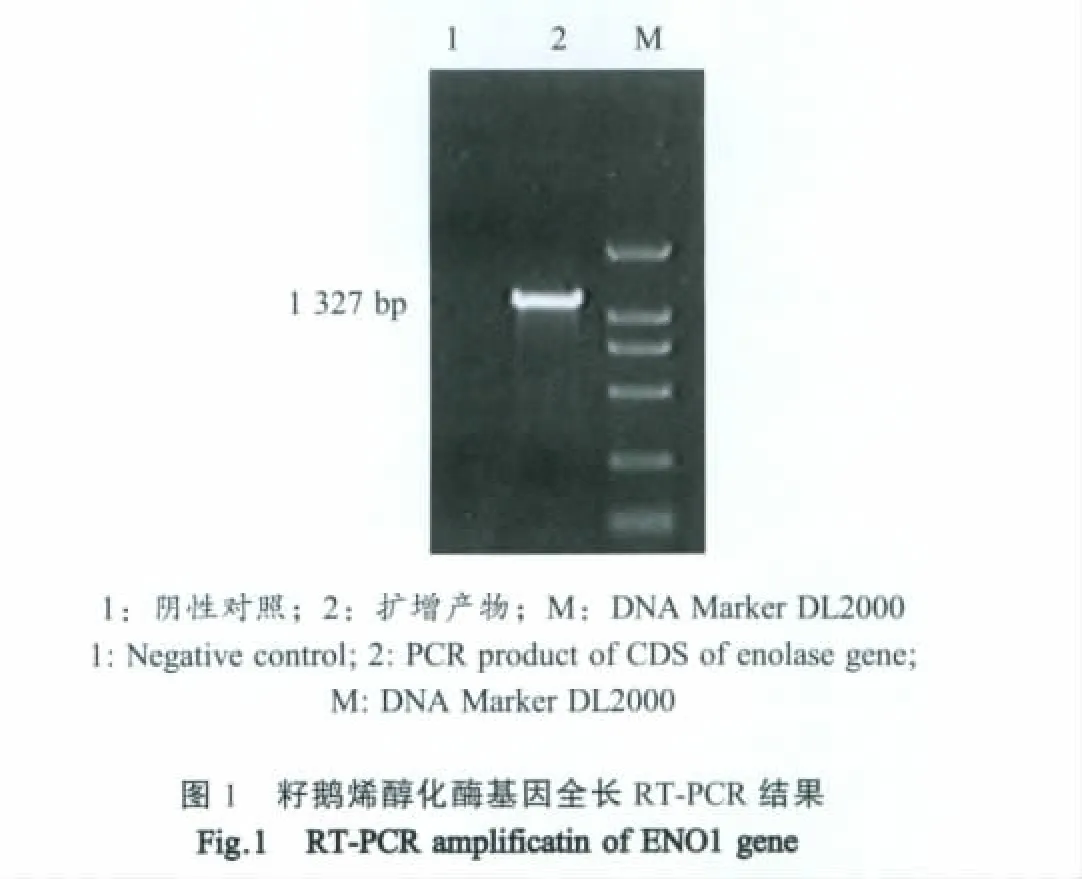
2.1 ENO 1基因扩增产物的鉴定 以提取的籽鹅卵巢组织总RNA反转录制备的cDNA为模板,采用PCR扩增ENO1基因。产物经1%琼脂糖凝胶电泳分析,在约1300bp处可见特异性片段,大小与预期相符(图1)。经过基因测序与核苷酸同源性比对,与北京鸭的同源性可达到97%。
2.2 重组腺病毒质粒的鉴定 将重组质粒pMD-ENO1与穿梭载体pShuttle-CMV酶切后连接,构建重组穿梭质粒pShuttle-CMV-ENO1。将pShuttle-CMV-ENO1和pAdxsi重组腺病毒骨架载体质粒酶切后连接,转化 DH5α,构建 pAd-CMV-ENO1。提取重组质粒,并采用XhoⅠ对其酶切鉴定。琼脂糖凝胶电泳分析显示,携带目的基因表达框的阳性克隆酶切后为7条带;而腺病毒空质粒由6条带组成。阳性克隆:14.5kb、11.7kb、3.9kb、2.66kb、2.47kb、 1.45kb、 0.6kb; 阴 性 克 隆 : 14.5kb、11.7kb、4.0kb、2.47kb、1.45kb、0.6kb(图 2)。
2.3 重组腺病毒的滴度 经检测,OD260nm值为0.483,重组腺病毒的纯度为1.29(正常范围为1.2~1.4);病毒的颗粒滴度为5.31×1012VP/m L,感染性滴度达 1.1×1011pfu/m L。
2.4 感染率及过表达的鉴定
2.4.1感染率的检测经过条件优化,显示细胞生长48h后,病毒集中于颗粒细胞上清(MOI=350)感染48h后重组腺病毒感染率最高,可达到97%~100%(图 3)。
2.4.2过表达量的测定
2.4.2.1mRNA表达量的检测:以持家基因β-actin为内参,SYBR GreenⅠ染料法对ENO1基因进行相对定量qRT-PCR检测。结果表明,重组腺病毒感染组ENO1mRNA表达量显著高于另外两组(p<0.05),正常细胞对照组与非重组腺病毒感染组ENO1mRNA表达量差异不显著(图4)。

2.4 .2.2蛋白表达量的检测:Western blot分析显示,重组腺病毒感染组ENO1相对表达量显著高于另两组(p<0.05),正常细胞对照组与非重组腺病毒感染组ENO1相对表达量差异不显著(图5、图6)。
3 讨论

通过过表达研究基因对不同效应器(细胞与组织)的影响是目前常用的技术方法,而基因转移技术中构建携带目的基因的表达载体往往是整个过程的关键[8]。目前,基因转移载体可分为两大类:非病毒载体和病毒载体。非病毒载体包括脂质体、分子偶联载体等,其基因转移效率低。常见的病毒载体主要包括逆转录病毒、腺病毒与慢病毒等。逆(反)转录病毒能够随机整合入宿主DNA,可以引起“插入诱变”,也有可能产生具有复制能力的病毒;慢病毒属于逆转录病毒科,能够稳定整合入宿主细胞持久表达目的基因,感染细胞范围广,基因容量较大,缺点是载体的整合是随机的,靶基因表达受插入位点两侧的宿主DNA序列影响,并可以导致插入突变。腺病毒为双链DNA病毒,具有感染效率和外源基因表达水平高、高滴度重组病毒的制备较简单、容量适合装载大多数外源基因的优点;而缺点是无靶向性、宿主范围广、可能造成非靶器官及非靶细胞的感染,治疗基因表达持续时间较短。
本实验采用的腺病毒载体系统(pAdxsi系统)包括穿梭质粒载体系统、病毒骨架载体以及包装细胞系293(R)细胞,其中所采用的腺病毒载体为复制缺陷型(去掉了E1区和E3区),293(R)细胞系是改造过的HEK293细胞。实验过程中采用直接连接的方案及通过I-CeuI、I-SceI双酶切位点定向克隆,这两个酶切位点的优点在于可以识别较长的序列,在人类的基因组中几乎没有这两个酶切位点。
腺病毒构建过表达载体技术比较成熟,但目前均以哺乳动物腺病毒作为载体构建骨架,无法确定是否感染禽类细胞。经过检测,结果表明应用哺乳动物腺病毒骨架构建ENO1重组腺病毒感染禽类细胞,较高的MOI值可以达到95%以上感染率,并且从基因与蛋白水平上同时检测了ENO1过表达,结果表明两个水平表达均有显著性变化,目前类似试验较少见。本实验构建了表达ENO1的重组腺病毒,并实现其在籽鹅卵泡颗粒细胞中的过表达,为进一步开发和研究ENO1的生物学功能奠定了基础,同时为动物和人类生殖相关研究提供了参考。
[1]Kang Bo,Guo Jing-ru,Yang Huan-m in,et al.Differential expression profiling of ovarian genes in prelaying and laying geese[J].Poult Sci,2009,88(9):1975-1983.
[2]王丹.籽鹅卵巢组织6个产蛋性能相关基因的研究[D].黑龙江八一农垦大学:硕士论文,2010.
[3]Kang H J,Jung S K,Kim S J,et al.Structure of human a-enolase(hENO1),a multifunctional glyclytic enzyme[J].Acta Cryst,2008,64:651-657.
[4]Subramanian A,M iller D M.Structural analysis of alpha-enolase-Mapping the functional domains involved in down-regulation of the c-myc protooncogene[J].J Biol Chem,2000,275(8):5958-5965.
[5]Roser Lopez-A lemany,Monica S,Angels Diaz-Ramos,et al.Alpha-enolase plasminogen receptor in myogenesis[J].Front Biosci,2005,10(1):30-36.
[6]Ejeskar K,Krona C,Caren H,et al.Introduction of in vitro transcribed ENO1mRNA into neuroblastoma cells induces cell death[J].BMC Cancer,2005,5(12):161-174.
[7]Ren G,Adamus G.Cellular targets of anti2alpha2enolase autoantibodies of patients with autoimmune retinopathy[J].J Autoimmun,2004,23(2):161-167.
[8]李方成,李军亮,梁伟强,等.大鼠GLUT1基因的扩增及其重组腺病毒载体的构建[J].中国病理生理杂志,2006,22(11):2284-2286.
