鸭坦布苏病毒鸭胚成纤维细胞适应病毒编码基因序列测定及分析
2013-09-11李云霞刘晓丽韩宗玺邵昱昊刘胜旺孔宪刚
李云霞,刘晓丽,张 玥,2,韩宗玺,邵昱昊,刘胜旺,2,孔宪刚*
(1.中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室/禽传染病研究室,黑龙江哈尔滨150001;2.东北农业大学生命科学学院,黑龙江哈尔滨150030)
鸭坦布苏病毒(Duck Tembusu virus,DTMUV)属于黄病毒科黄病毒属蚊媒病毒类恩塔亚病毒群的坦布苏病毒[1-3]。DTMUV为单股正链RNA,有囊膜,病毒粒子50nm,不具有凝集鸡、鸭、鹅、鸽等动物红细胞的特性[4]。DTMUV病发病率高,可达100%,死亡率约25%~15%,甚至高达50%以上[5]。病鸭临床主要表现为共济失调甚至双腿瘫痪等[6]。剖检病变为卵巢充血、出血,卵泡破裂、退化和变形,肝脏、脾脏肿大出血[7]。DTMUV病危害严重,给我国养鸭业造成了严重的经济损失。
本研究将Du/CH/LSD/110128株在鸭胚纤维细胞(DEF)中连续传12代,得到一株稳定的细胞适应毒,在此基础之上进行该细胞适应毒编码区基因序列的测定及序列比对,分析DTMUV在DEF中的适应性以及适应细胞后的变异情况。
1 材料和方法
1.1 病毒株及实验动物 Du/CH/LSD/110128由本实验室分离鉴定;10日龄SPF鸭胚由本研究所实验动物中心提供。
1.2 主要实验材料及试剂 E.coli感受态细胞TG1及DEF由本研究室制备;pMD18-T、PrimeScriptROne Step RT-PCR Kit试剂盒和总RNA提取试剂RNAiso Plus均购自TaKaRa公司;Gel Extraction Kit购自Omega公司。
1.3 病毒在DEF中的适应 将Du/CH/LSD/110128株鸭胚尿囊液,接种于新制备的DEF单层细胞中,于37℃5%CO2条件感作1h,加入细胞维持液于37℃ 5%CO2培养7d,每天观察CPE,连续传至12代,取每代病毒液,以常规方法检测其TCID50,并按Reed-Muench方法计算TCID50[1]。
1.4 病毒RNA提取 参照文献[8]方法,F10代病毒液反复冻融3次后,提取RNA,于-70℃备用。
1.5 全基因组扩增 参照已发表序列GenBank(KC136210)引物,RT-PCR扩增编码区基因,PCR产物回收、克隆至pMD18-T载体中,重组质粒由北京六合华大基因科技股份有限公司测序。
1.6 序列分析 测得序列剪辑、拼接完成后,将F10序列与参考序列进行序列比对分析,分析其遗传变异性。参考病毒株分别是分离于中国的DTMUV(JQ920420、JX273153、JF459991、JF270480、KC136210)、鸡源DTMUV(JQ627862)、鸽源DTMUV(JQ920425)、鹅源DTMUV(JQ920424)以及黄病毒属巴格扎病毒(BAGV)(NC_012534)、恩他耶病毒(NTYV)(NC_018705)、西尼罗病毒(WNV)(NC_009942)、日本脑炎病毒(JEV)(NC_001437)、登革热病毒(DENV1)(NC_001477)、 DENV2(NC_001474)、DENV3(NC_001475)、 DENV4(NC_002640)、 黄 热病毒(YFV)(NC_002031)。
2 结 果
2.1 病毒在细胞中的适应 将Du/CH/LSD/110128在DEF中连续传代培养,F2代病毒为101.6TCID50/0.1m L,F6代病毒为101.7TCID50/0.1m L,自F8代起,DTMUV在DEF中的病毒滴度达到一个稳定的水平,并且F10代病毒滴度为104.4TCID50/0.1m L左右(图1)。细胞接种F10病毒后72h出现明显病变,主要表现为细胞皱缩、变圆最终死亡脱落(图2)。

图1 DTMUV在DEF中TCID50的变化曲线Fig.1The TCID50 changing curve of DTMUV passed in DEF
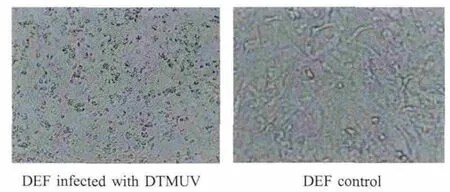
图2 细胞病变Fig.2Cytopathic effect infected w ith DTMUV in DEF
2.2 编码区基因扩增 病毒感染DEF后F10代细胞裂解液提取的RNA为模板,用10对引物进行一步法RT-PCR,分别扩增得到10个片段(图3)。
2.3 序列分析
2.3.1核苷酸序列分析将测得的10个片段进行序列剪辑、拼接,参照文献[9]对各个基因进行划分,本实验病毒株各个基因在基因组顺序为5'-UTRC-Pr/M-E-NS1-NS2A-NS2B-NS3-NS4A-2K-NS4B-NS5-3'-UTR,其中C、PrM和E蛋白为结构蛋白,其余为非结构蛋白。有学者称国际上对黄病毒属成员的分类标准为NS5基因3'端长约1kb的区域中同种病毒的核苷酸序列同源性大于84%[5]。本研究利用DNAStar软件包中的MegA lign软件的Clustal W Method进行F10代病毒的NS5基因与参考病毒株NS5基因的多序列比对,结果显示F10代病毒与DTMUV同源性为98.4%~98.7%,但与鸽源DTMUV同源性较低,为87.8%,与Nataya病毒和Bagaza病毒同源性分别为74.2%和75.3%,而与其他黄病毒属病毒同源性在65.7%以下(图4)。

图3 编码区基因扩增Fig.3Amplification of encoding gene by RT-PCR

图4 NS5基因系统发育进化树Fig.4Phylogenetic tree based on nucleic acid sequence of NS5gene
2.3.2推导氨基酸序列差异分析将Du/CH/LSD/110128细胞毒F10(KC800808)与亲本病毒F0(KC136210)、 BYD1(JQ920420)、 鸡 源 CK-SD-11(JQ627862)和鸽源DTMUV(JQ920425)进行推导氨基酸序列比较,显示F10与F0存在10个推导氨基酸差异位点,其中3个差异位点存在于NS1蛋白、2个存在NS3蛋白,Pr蛋白、M蛋白、E蛋白、NS2A蛋白和NS5蛋白各存在1个差异位点,F10与BYD1存在14个差异位点,主要在E蛋白和NS3蛋白,与CK-SD-11存在21个差异点,主要在E和NS5蛋白,与鸽源DTMUV存在16个差异位点,主要在E和NS5蛋白(表1)。

表1 F10与参考病毒株氨基酸突变位点的比较Table 1Comparison of amino acid mutations in F10w ith reference strain
3 讨 论
DTMUV在DEF中的病毒滴度随着传代次数的增加而升高,并在F8代达到稳定水平,并且F10代病毒NS5基因序列分析结果显示F10代病毒与DTMUV亲本病毒以及DTMUV其他参考病毒株无较大的差异,这些结果表明DTMUV已经适应DEF。
本实验测得DTMUV F10编码区基因长10278nt,编码一个大的多聚蛋白,由3425个氨基酸组成,这个大的多聚蛋白由3个结构蛋白(衣壳蛋白C、前膜蛋白加工后的M蛋白和囊膜蛋白E)、7个非结构蛋白(NS1、NS2A、NS2B、NS3、NS4A、NS4B、和NS5)。黄病毒属NS1蛋白可能参与了病毒RNA的复制过程并与病变形成有关[10],NS3蛋白参与蛋白质水解加工与病毒复制,与病毒致病性密切相关[11],NS5蛋白参与病毒基因组复制并在调控宿主抗病毒反应中发挥关键作用[12]。
F10的推导氨基酸序列与参考病毒株F0、BYD1、CK-SD-11和鸽源DTMUV的推导氨基酸序列进行比对,分析比对结果显示F10代病毒与F0代病毒的10个氨基酸差异位点中5个位点的氨基酸发生了极性的改变:I147T、 W956C、A1086S、T2045I、S3416P,147位为Pr蛋白,956位和1086位在NS1蛋白,2045位在NS3蛋白,3416位在NS5蛋白,氨基酸的改变可能会导致蛋白质三级结构甚至功能的改变,参考黄病毒属非结构蛋白NS1、NS3、和NS5的功能[10-12],这些变化一方面将为研究病毒在细胞的适应及增殖性能提供一定的分子学基础,另一方面可能也预示着Pr基因、NS1基因、NS3基因和NS5基因所编码的蛋白在病毒适应细胞的过程中发挥着一定的作用。
另外分析推导氨基酸的比对结果表明F10代病毒存在5个特殊的推导氨基酸位点:I147T,V285A,R679Q,R1926K,T2045I,F10为细胞适应毒,而其他4株病毒均为分离的野毒,这些氨基酸突变可能是病毒在适应细胞过程中发生的一些关键的变化。
[1]Su Jing-liang,Li Shuang,Hu Xu-dong,et al.Duck egg-drop syndrome caused by BYD virus,a new Tembusu-related flavivirus[J].PLoSOne,2011,6(3):e18106.
[2]李玉峰,马秀丽,于可响,等.一种从鸭新分离的黄病毒研究初报[J].畜牧兽医学报,2011,6:885-891.
[3]Yan Pi-xi,Zhao You-shu,Zhang Xu,et al.An infectious disease of ducks caused by a new ly emerged Tembusu virus strain in mainland China[J].Virology,2011,417(1):1-8.
[4]马秀丽,于可响,高凤,等.鸭黄病毒BZ株的生物学特性研究[J].中国家禽,2011,33(21):12-14.
[5]朱丽萍,颜世敢.鸭坦布苏病毒研究进展[J].中国预防兽医学报,2012,34(1):79-82.
[6]Cao Zhen-zhen,Zhang Cun,Liu Yue-huan,et al.Tembusu virus in ducks,China[J].Emerg Infect Dis,2011,17(10):1873-1875.
[7]曹贞贞,张存,黄瑜,等.鸭出血性卵巢炎的初步研究[J].中国兽医杂志,2010,46(12):3-6.
[8]Liu Sheng-wang,Han Zong-xi,Chen Jian-fei,et al.S1gene sequence heterogeneity of a pathogenic infectious bronchitis virus strain and its embryo-passaged,attenuated derivatives[J].Avian Pathol,2007,36(3):231-234.
[9]Yun Tao,Ye Wei-cheng,Ni Zheng,et al.Identification and molecular characterization of a novel flavivirus isolated from Pekin ducklings in China[J].VetM icrobiol,2012,157:311-319.
[10]周鹏程,陈建国,丁明孝.黄病毒科病毒编码基因的非结构蛋白及其功能[J].微生物学免疫学进展,1999,27(2):61-70.
[11]郑杰,赵启祖,赵耘,等.黄病毒NS2-3/NS3蛋白的结构域功能[J].病毒学报,2007,23(3):235-239.
[12]周希珍,赵慧,高岚,等.虫媒病毒NS5蛋白的生物学功能研究进展[J].军事医学,2012,36(1):70-72.
