腺病毒/日本脑炎病毒复制子嵌合载体的构建
2013-09-11李红梅亓文宝孟其麟田大勇仇华吉
李红梅,孙 元,亓文宝,孟其麟,田大勇,廖 明,仇华吉*
(1.中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室猪传染病研究室,黑龙江哈尔滨150001;2.华南农业大学兽医学院农业部兽用疫苗创制重点实验室,广东广州510642)
腺病毒载体因具有宿主范围广泛、对人的致病力低、病毒粒子稳定、基因组较少发生重排、易于DNA重组技术操作、具有高效递送和表达外源基因等优点,成为最常用的病毒载体之一。其中,人5型非复制性腺病毒载体因缺失病毒非必需基因区(E1/E3),使其能够携带大片段的外源基因,而又由于它是复制缺陷性的,仅发生一过性感染,安全性极高,所以被广泛用于新型疫苗的研制。
近年来,RNA复制子载体由于具有表达效率高、安全性好等优点得到高度关注。RNA复制子载体是在RNA病毒感染性克隆的基础上用其它外源基因替换病毒所有结构蛋白基因、保留其非结构蛋白基因和非编码区而构建的表达系统,它利用正链RNA病毒的自主复制特性,转染细胞后能够在表达病毒非结构蛋白的同时高效表达外源蛋白[1]。RNA复制子疫苗具有很强的优势,如:有自主复制能力,病毒自身调节功能蛋白的表达不受细胞影响,病毒蛋白表达量高等优点[2]。不足之处是RNA复制子载体由于基因组过大不能有效导入体内。另外,黄病毒复制子载体通常不稳定,导致携带的外源基因不能正确地表达,这主要由于黄病毒复制子载体蛋白对宿主菌具有一定的毒副作用[3],日本脑炎病毒(JEV)复制子载体也存在这种不稳定性[4-5]。为提高复制子载体的稳定性,González等通过插入内含子的方法获得稳定的传染性胃肠炎病毒感染性全长cDNA克隆[6];Yamshchikov等通过在病毒cDNA的易变区插入内含子的方法增强了正链RNA病毒感染性克隆在大肠杆菌中的稳定性[7]。
JEV编码3种结构蛋白(C、prM/M、E)和7种非结构蛋白(NS1、NS2A、NS2B、NS3、NS4A、NS4B、NS5)。其中非结构蛋白NS1为第一个被翻译并且是最重要的非结构蛋白。NS1蛋白虽然不能诱导机体产生中和抗体,但能够刺激机体产生免疫保护作用[8]。Xu等构建了表达JEV NS1蛋白的重组伪狂犬病病毒,并利用小鼠模型进行免疫效力评价,结果显示,该重组病毒诱导了针对JEV的特异性体液免疫和细胞免疫反应,并对JEV的攻击提供了保护[9]。这为利用JEV复制子载体构建二价疫苗提供了依据。
本实验室已经构建了腺病毒/甲病毒复制子嵌合载体猪瘟疫苗rAdV-SFV-E2,动物实验表明,rAdV-SFV-E2免疫猪可以产生猪瘟特异性抗体,并能够抵抗猪瘟强毒的攻击。这种新型嵌合载体猪瘟疫苗免疫效果接近于猪瘟兔化弱毒疫苗[10]。这种使用腺病毒递送复制子的策略解决了RNA复制子疫苗难以进入细胞内的难题,从而有效提高了复制子疫苗的免疫效力。因此,本研究采用人5型复制缺陷性腺病毒递送JEV复制子载体,构建JEV/腺病毒嵌合载体平台,用以开发基于JEV高效进入细胞的新型RNA复制子疫苗。
1 材料和方法
1.1 质粒载体、菌株及细胞 含有绿色荧光蛋白(EGFP)基因的JEV复制子pOK-JEV-EGFP由华南农业大学构建[11];腺病毒穿梭载体pShuttle-CMV及含有腺病毒骨架载体的AdEasy-1感受态菌购自Stratagene公司;HEK293细胞由本实验室保存。
1.2 主要试剂 Lipofectamine 2000转染试剂购自Invitrogen公司;各种限制性内切酶购自宝生物工程(大连)有限公司;DNA纯化试剂盒及病毒基因组提取试剂盒购自OMEGA公司;pCI质粒购自Promega公司。
1.3 转移载体pShuttle-CMV的改造 根据pShuttle-CMV载体序列设计合成一对5'端有9个碱基相同的引物P1、P2。
P1:5'-TCAGAATTCGGTACCCGGATCTGGGC GTGGTTAAG-3'(EcoRⅠ、KpnⅠ);P2:5'-TCAGA ATTCGCGGCCGCACAGTATTACGCGCTATGAGTA ACA-3'(EcoRⅠ、NotⅠ)。
以pShuttle-CMV为模板,以PrimeSTARRHS DNA聚合酶进行PCR扩增,获得6500bp的环状质粒(删去CMV-MCS-SV40polyA),经DNA试剂盒纯化后,加入DpnⅠ限制性内切酶消化质粒模板,再经DNA纯化试剂盒纯化,转化DH5α,提取质粒酶切鉴定,重组质粒命名为pShuttle。
根据pShuttle PmeⅠ位点附近序列,设计合成一对引物P3/P4,上下游引物引入相同的酶切位点SwaⅠ,以将PmeⅠ突变为SwaⅠ,引物序列如下。
P3:5'-AATTTAAATGAATTCAATAGCTTGT-3'(Swa Ⅰ);P4: 5'-TTCATTTAAATTCCCTCTCAAG TCT-3'(Swa Ⅰ)。
以质粒pShuttle为模板,用PrimeSTARRHS DNA聚合酶进行PCR扩增,扩增片段为不含PmeⅠ位点的质粒全长序列,纯化PCR产物,用SwaⅠ处理后自连,挑选能够被SwaⅠ酶切并且不能被PmeⅠ酶切的克隆,命名为pShuttle-SwaI。
1.4 pSh-JEV-EGFP穿梭载体的构建 将质粒pOK-JEV-EGFP用NotⅠ/KpnⅠ酶切,胶回收CMV至SV40polyA序列片段,插入pShuttle-SwaⅠ的NotⅠ和KpnⅠ之间,构建pSh-JEV-EGFP。
1.5 内含子序列的引入 为增加JEV复制子的稳定性,利用细菌内同源重组的方法引入质粒pCI的内含子序列(图1),引物序列如下(下划线为同源臂序列):
P5:5'-GGGCTATCAATATGCTGAAACGCGGCCTACCCCGCGTAAGTATCAAGGTTACAAG-3';P6:5'-AACAGCTCCTCGCCCTTGCTCACCATACTAGT C TGTGGAGAGAAAGGCAAAg-3'。
以pCI为模板扩增携带JEV载体同源序列的内含子序列,将PCR产物与经SpeⅠ线性化的质粒pSh-JEV-EGFP共转化DH5α感受态菌,利用细菌内的重组酶进行同源重组,提取质粒经PCR鉴定,阳性重组质粒命名为pSh-JEV-In-EGFP。
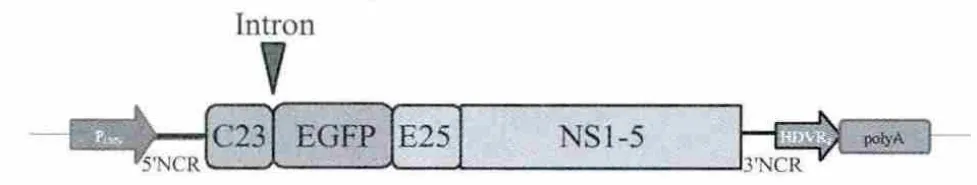
图1 引入内含子序列结构示意图Fig.1Schematic diagram of insertion of the intron
1.6 腺粒pAdV-JEV-In-EGFP的构建 将pSh-JEV-In-EGFP用SwaⅠ线性化,DNA纯化试剂盒纯化后电转化至BJ5183感受态菌中进行同源重组。经卡那霉素抗性筛选,提取重组腺粒用PacⅠ酶切鉴定,构建重组腺粒pAdV-JEV-In-EGFP。
1.7 重组病毒的包装 提取pAdV-JEV-In-EGFP经PacⅠ线性化后纯化,采用Lipofectam ine 2000转染试剂按说明书以6μg DNA/孔的浓度转染至六孔板中的HEK293单层细胞。
1.8 重组腺病毒的纯化与鉴定 转染后第8d收集培养物反复冻融3次,离心,收集第一代病毒培养液,-20℃保存。将第一代病毒接种至HEK293细胞单层中,连续传代,观察荧光表达及细胞病变(CPE)情况,当大量荧光表达并且细胞大量病变时,将2μL病毒液接毒至新鲜单层细胞中,观察荧光表达情况,48h收集细胞提取细胞总DNA,以腺粒pAdV-JEV-In-EGFP为阳性对照,以正常HEK293细胞DNA作为阴性对照,采用相同的引物PCR扩增,产物经琼脂糖电泳检测。
1.9 RT-PCR 为验证JEV复制子的自主复制能力,采用RT-PCR方法进行检测,引物序列:PEGFP-F:5'-ACCACATGAAGCAGCACGACT-3'; PEGFP-R:5'-GACCTTGTACAGCTCGTCCAT-3'。提取感染rAdVJEV-In-EGFP 48h的HEK293病变细胞总RNA,采用上述引物进行RT-PCR反应检测负链RNA,以验证该载体能否在细胞中自我复制。
2 结 果
2.1 pSh-JEV-In-EGFP的稳定性 为了增强JEV复制子载体的稳定性,本实验引入内含子序列,以阻止复制子蛋白在细菌中的表达。将pSh-JEV-In-EGFP在细菌中传20代,经BglⅡ、EcoRⅠ单酶切及BglⅡ与EcoRⅠ双酶切鉴定,获得与预期大小相符的片段(图2),表明其具有良好稳定性。
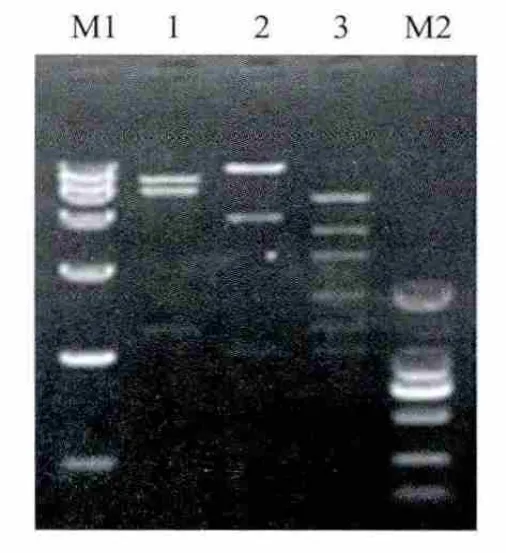
图2 pSh-JEV-In-EGFP细菌中传至20代酶切鉴定Fig.2Restriction enzyme analysis of pSh-JEV-In-EGFP after 20passages in bacterial cells
2.2 重组病毒rAdV-JEV-In-EGFP的鉴定及EGFP在细胞中的表达检测 将腺粒pAdV-JEV-In-EGFP转染HEK293细胞后,出现瞬时荧光表达,8d后未见CPE形成,盲传至4代~5代,可以观察细胞内大量的荧光表达,而且出现CPE(细胞变圆、发亮、向周边扩散)。
提取重组病毒感染HEK293细胞的总DNA,用PCR检测到JEV与EGFP交界处的部分片段以及内含子序列片段1.0kb和0.2kb(图3)。此外,荧光显微镜下可以观察到EGFP蛋白在rAdV-JEV-In-EGFP感染的HEK293细胞中大量表达(图4)。
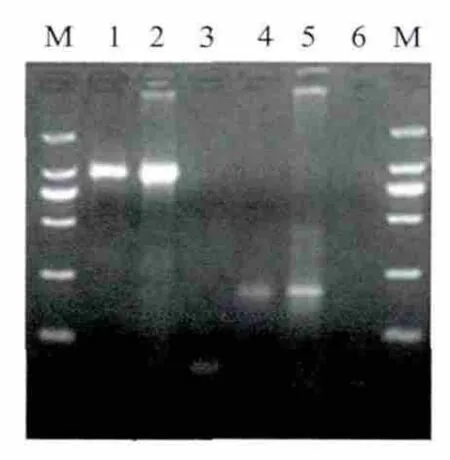
图3 重组腺病毒rAdV-JEV-In-EGFP的RCR鉴定Fig.3Identification of rAdV-JEV-In-EGFP by PCR
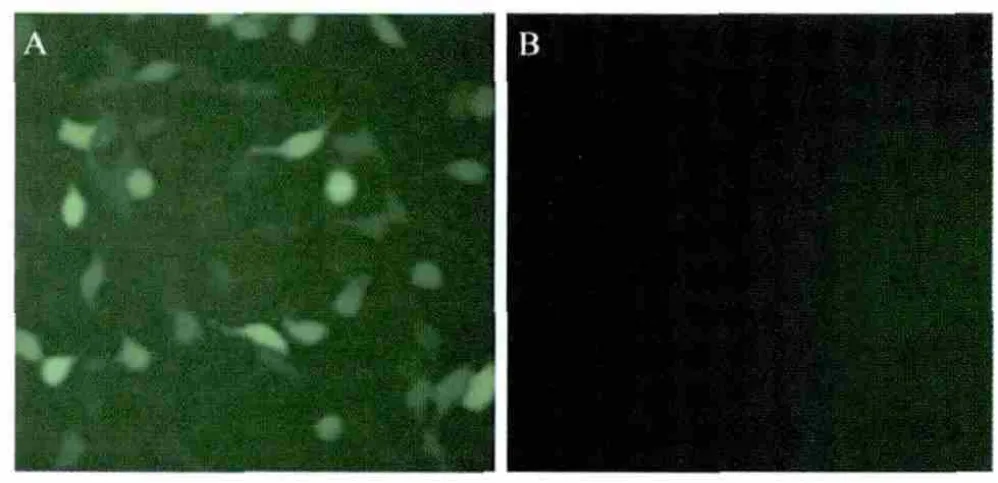
图4 EGFP在rAdV-JEV-In-EGFP感染HEK293细胞中的表达Fig.4Expression of the EGFP protein in HEK293cells infected with the recombinant adenovirus rAdV-JEV-In-EGFP
2.3 JEV复制子复制能力的鉴定 分别以上下游引物对重组病毒感染细胞的总RNA进行反转录。并以其为模板进行PCR扩增。电泳结果显示,以上游或下游引物反转录得到的cDNA均能够扩增出500bp DNA片段,显示重组病毒感染HEK293细胞的总RNA中同时存在JEV的正链(基因组RNA)和负链RNA。表明JEV复制子能够自我复制(图5)。
3 讨 论
JEV复制子具有表达自身非结构蛋白、同时表达外源蛋白的特点。JEV复制子编码非结构蛋白NS1的免疫保护作用与Fc片段依赖性有关,特异性抗体通过补体依赖的形式杀伤感染的靶细胞,在病毒感染过程中引起免疫应答,对接种动物提供保护性免疫[12]。Chen等用其构建的编码NS1的重组质粒免疫动物后不能产生中和性抗体,但产生的高滴度ELISA抗体可以识别JEV。可能这种抗体不能抑制病毒吸附敏感细胞,但当其与病毒结合后有利于清除体内的病毒[13]。JEV复制子载体插入外源基因并保留了JEV非结构蛋白,在诱导针对外源蛋白的抗体的同时,也产生针对JEV的免疫应答。
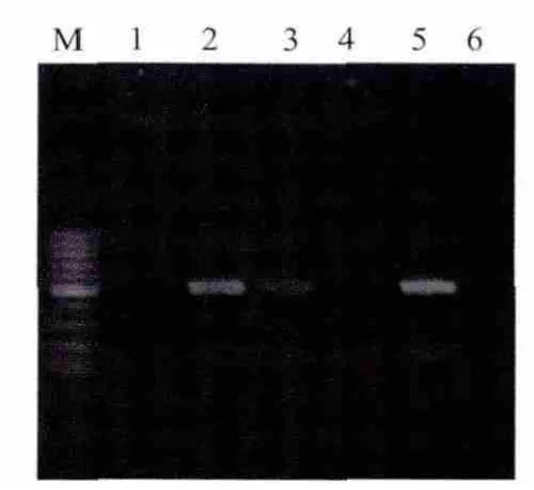
图5 rAdV-JEV-In-EGFP感染细胞中JEV复制子负链RNA的RT-PCR检测Fig.5Detection of JEV negative-strand replicon RNA in rAdV-JEV-In-EGFP-infected cells by RT-PCR
采用腺病毒递送JEV复制子表达系统,充分利用复制子高效表达外源基因的优点,又解决了核酸疫苗不容易导入动物体内的问题。本实验室前期构建的用腺病毒递送甲病毒复制子表达猪瘟病毒(CSFV)E2基因的新型猪瘟嵌合载体疫苗,获得很好的免疫保护效果[8],这为本研究提供了研究思路和依据。
在前期工作中,构建了表达EGFP蛋白的腺病毒/JEV复制子载体嵌合病毒,但用其它基因(如CSFV E2基因或猪流感病毒HA基因)替换EGFP基因后,尽管采用不同改进措施,比如转化过程中使用能容纳大片段并且生长较慢的DH10B菌株,使用低温、低转速、低浓度抗生素筛选[14-15],却始终无法得到正确表达外源基因的嵌合载体克隆。这可能是由于黄病毒cDNA在大肠杆菌中的不稳定性造成的。为此,本实验采用在JEV复制子中引入内含子的方法,避免表达对宿主菌有毒害作用的蛋白[16],能够使JEV复制子载体在大肠杆菌中稳定增殖。
本研究构建了含有可以自我复制的JEV复制子并且稳定表达EGFP的重组腺病毒。目前国内外关于以腺病毒递送JEV复制子表达载体的研究未见报道,本研究首次对腺病毒/JEV复制子嵌合载体表达系统进行初步探索,证明了由腺病毒递送JEV复制子表达系统的可行性,为进一步研发以腺病毒递送JEV复制子为基础的新型疫苗奠定了基础。
[1]余云舟,俞炜源.黄病毒属病毒复制子载体研究进展[J].生物技术通讯,2006,17(2):228-231.
[2]Polo JM,Dubensky T W.Virus-based vectors for human vaccine applications[J].Drug Discov Today,2002,7(13):719-727.
[3]Rice C M,Grakoui A,Galler R,et al.Transcription of infectious yellow fever RNA from full-length cDNA templates produced by in vitro ligation[J].New Biol,1989,1(3):285-296.
[4]Lai Ching-juh,Zhao Bang-ti,Hori H,et al.Infectious RNA transcribed from stably cloned full-length cDNA of dengue type 4virus[J].PNASUSA,1991,88(12):5139-5143.
[5]Sum iyoshi H,Hoke C H,Trent D W,et al.Infectious Japanese encephalitis virus RNA can be synthesized from in vitro-ligated cDNA templates[J].JVirol,1992,66(9):5423-5431.
[6]González JM,Pénzes Z,Almazán F,et al.Stabilization of a full-length infectious cDNA clone of transm issible gastroenteritis coronavirus by insertion of an intron[J].J Virol,2002,76:4655-4661.
[7]Yamshchikov V F,M ishin V,Cominelli F,et al.A new strategy in design of(+)RNA virus infectious clones enabling their stable propagation in E.coli[J].Virology,2001,281:272-280.
[8]王斌,华荣虹,赵付荣,等.抗乙型脑炎病毒非结构蛋白NS1单克隆抗体的制备与鉴定[J].中国预防兽医学报,2009,31(1):74-77.
[9]Xu Gao-yuan,Xu Xiao-juan,Li Zi-li,et al.Construction of recombinant pseudorabies virus expressing NS1protein of Japanese encephalitis(SA14-14-2)virus and its safety and immunogenicity[J].Vaccine,2004,22(15-16):1846-1853.
[10]Sun Yuan,Li Hong-yu,Tian Da-yong,et al.An adenovirusdelivered,alphavirus replicon-vectored vaccine induces sterile immunity against classical sw ine fever in pigs[J].Vaccine,2011,29(46):8364-8372.
[11]陈孝明.JEV复制子载体的建立及其表达PRRSV GP5和M蛋白的研究[D].广州:华南农业大学,2010.
[12]Schlesinger J J,Foltzer M,Chapman S.The Fc portion of antibody to yellow fever virus NS1is a determ inant of protection against YF encephalitis in mice[J].Virology,1993,192:132-141.
[13]Chen H W,Pan C H,Liau M Y,et al.Screening of protective antigens of Japanese encephalitis virus by DNA immunization:a comparative study w ith conventional virus vaccine[J].J Virol,1999,73(12):10137-10145.
[14]Sriburi R,Keelapang P,Duangchinda T,et al.Construction of infectious dengue 2virus cDNA clones using high copy number plasm id[J].JVirol Methods,2001,92(1):71-82.
[15]Forns X,Bukh J,Purcell R H,et al.How can bias the results of molecular cloning:preferential selection of defective genomes of hepatitis C virus during the cloning procedure[J].PNAS USA,1997,94(25):13909-13914.
[16]Pu Szu-yuan,Wu Ren-huang,Yang Chi-chen,et al.Successful propagation of flavivirus infectious cDNAs by a novelmethod to reduce the cryptic bacterial promoter activity of virus genomes[J].JVirol,2011,85(6):2927-2941.
