扩张型心肌病蛋白质组学研究
2013-09-11于丽平史琳影朱晓明蔡军杨新春孟宪敏
于丽平,史琳影,朱晓明,蔡军,杨新春,孟宪敏
扩张型心肌病蛋白质组学研究
于丽平,史琳影*,朱晓明,蔡军,杨新春,孟宪敏△
目的:通过蛋白质组学方法比较扩张型心肌病(DCM)患者和正常人心肌组织差异蛋白质谱,找出与DCM相关的差异蛋白,进一步探讨DCM发生的分子生物学机制。
方法:选择9例原发病为DCM、左心室射血分数<35%且接受心脏移植手术的患者作为DCM组:心肌组织取自患者自有心脏的左心室游离壁。对照组:心肌组织取自6例不能用作移植的供体心脏。采用双向凝胶电泳(2-DE)分析蛋白质谱差异,热考马斯亮蓝染色,串联质谱(MS-MS)鉴定差异蛋白。采用生物医学研发软件及资料库Ingenuity Pathways Analysis分析差异蛋白的定位、功能和相互作用。
结果:DCM组和对照组心肌组织2-DE图像中蛋白点的整体分布比较相似,可以检测到超过1 000个蛋白点。通过比较分析,共鉴定出25种差异蛋白,其中在DCM组15种上调,10种下调。使用LOCATE数据库分析差异蛋白的亚细胞定位,提示其中大分子蛋白占40%,细胞骨架蛋白为28%,线粒体蛋白为28%。蛋白的PANTHER分类显示大多数差异蛋白参与了细胞的结构、肌肉收缩、钙离子转运和水解酶的活性等功能。生物学途径分类揭示差异蛋白参与了组织的形成过程、生物调节、发育过程、代谢过程和对刺激的应答过程等。
结论:对DCM患者心肌组织蛋白质组学研究发现25种差异蛋白,其中上调表达的蛋白有15种,下调表达的有10种;这些蛋白参与了线粒体能量代谢、心肌收缩、凋亡等过程;提示这些过程可能在DCM发生发展中发挥重要作用。
扩张性心肌病;蛋白质组学;能量代谢
(Chinese Circulation Journal,2013,28:47.)
原因不明的扩张型心肌病(DCM)是一种以左心室、右心室或双侧心腔扩大、心脏收缩功能障碍为主要特征的心肌疾病,其临床表现以进行性心力衰竭、心律失常、血栓栓塞甚或猝死为基本特征。近年来,DCM发病呈上升趋势[1],我国 DCM 发病率为19/10万[2],预后极差。国外曾报道5年病死率约15.0%~50.0%[3],国内报道2年病死率为41.2%、5年病死率为80.0%。但DCM的发病机制至今尚未完全阐明。蛋白质组学是一门以全面的蛋白质性质(如表达水平、翻译后修饰、相互作用等)为基础,在蛋白质水平上对疾病机理、细胞模式、功能联系等方面进行研究和探索的科学。蛋白质组学在DCM研究领域中的应用也取得了一定进展,但上述研究主要针对DCM动物模型心肌组织蛋白质谱改变[4],而侧重于DCM患者心肌组织蛋白质谱的研究相对较少。双向凝胶电泳(2-DE)-质谱(MS)-生物信息学是蛋白质组学的经典技术路线[5],主要依据蛋白质两个相互独立的特性等电点和分子量对蛋白质组分进行分离。该技术具有直观、快捷、高通量等特点。能检测出更多真实的差异表达,鉴别出最小的差异[6]。因此,本研究拟采用2-DE技术比较DCM患者和供体心肌组织差异蛋白质谱,找出DCM相关的差异蛋白,进一步探讨DCM发生的分子生物学机制。
1 资料和方法
对象:标本从阜外医院外科心脏移植中筛选9例原发病为DCM且左心室射血分数(LVEF)<35%的患者心脏组织纳入DCM组;因不匹配而不能用作移植的6例供体心脏作为对照组。本试验从2010年开始至2011年结束。
标本收集和样品制备:心肌组织的收集,DCM心肌组织取自接受心脏移植手术患者心脏的左心室游离壁;对照组取自不能用于移植的供体心脏左心室游离壁。标本收集后均尽快放置于冰的含氧心肌麻痹液中,在液氮中冻存。将心肌组织从液氮中取出后尽快切成小块,放入Polytron PT-MR210匀浆器中,并加入500 μl的裂解液,将匀浆器置于冰上进行组织匀浆以防止蛋白降解。将匀浆液转移至干净离心管中,离心(14 000 rpm,4℃,30 min),离心完成后将上清液转移分装,-80℃冻存。考马斯亮蓝法(Bradford)测定蛋白质浓度。
双向凝胶电泳:按照 IPGphor等电聚焦系统(Amersham Biosciences公司)使用指南进行操作。上样500 μg,使用等电点为 pH3-10的非线性胶条(英国Amersham公司产品)进行第一向电泳。(30 V 6 h、500 V 1 h、1 000 V 3 h、3 000 V 2 h、5 000 V 2 h、10 000 V 2 h、8 000 V 10 h、500 V 6 h)。然后使用12.5%的垂直板聚丙烯酰胺凝胶(SDS—PAGE)进行第二向电泳(2W/胶30分钟、12W/胶约6 h),直至溴酚蓝达胶底线。凝胶电泳结束后,考马斯亮蓝染色及脱色。用ImageScanner扫描仪(Amersham Biosciences公司)获取染色后的2-DE凝胶图像,用 ImageMaster7.0软件(Amersham Biosciences公司)分析扫描后的图像。所有图像中斑点检测参数均设定为:①最小面积:10(像素单位);②平滑度:2;③显著值:2。两组间表达差异在1.5倍以上的蛋白点为差异蛋白点。
差异蛋白斑点的鉴定:沿边缘切取凝胶上的差异蛋白质点,置于1.5 ml离心管。经过水洗、脱色、还原与烷基化、胶内酶切、萃取,然后点样。制备好的点样板放入美国ABI公司的ABI 4700 TOFTOF质谱仪进行质谱分析。胰酶消化了的肌红蛋白作为内标校正质谱仪。所有实验样品的质谱图均以用默认模式获得。利用软件Mascot distiller过滤基线峰、识别信号峰。利用英国 Matrixscience公司的Mascot软件搜索NCBInr数据库(http://www.matrixscience.com),寻找匹配的相关蛋白质,同时查询其功能。
差异蛋白的生物信息学分析:经过质谱鉴定的蛋白质通过Ingenuity pathways analysis(IPA)软件进行生物信息学分析(Ingenuity Pathway® Analysis,IPA,Ingenuity systems,www.ingenuity.com)。以 IPA 核心分析(Core Analysis)模块对蛋白进行生物功能抽提、疾病相关归类等通路分析。
统计分析:所有分析使用SPSS16.0统计软件。数据采用均数加减标准差表示(±SD),生物信息学分析的数据采用两组独立样本t检验。以P<0.05为有统计学意义。
2 结果
DCM组患者和对照组供体的年龄和性别构成比具有可比性。DCM组9例患者左心室射血分数在14% ~35%之间,治疗药物主要包括地高辛、血管紧张素转换酶拮抗剂(ACEI)、β受体阻断剂、利尿剂等。
DCM组和对照组心肌组织2-DE图像:蛋白质组学分析中每个样品3次重复,总45块2-DE胶,这些胶中蛋白点的总体分布显示了高度的相似性。两组代表性的2-DE图像见图1。950个可重复性蛋白点被纳入分析,其中表达差异在1.5倍以上的蛋白点被认为是差异蛋白点,共确定了25种差异蛋白,其中在DCM组15种表达上调,10种表达下调。

图1 扩张型心肌病组患者和对照组供体心肌组织2-DE图像及差异蛋白点的分布(考马斯亮蓝染色)。差异蛋白点的质谱分析及数据库检索:使用德国Bruker Daltonics公司的TOF-TO串联质谱仪并搜索Mascot数据库PMF分析鉴定出25种差异蛋白。1A:扩张型心脏病组 1B:对照组
差异蛋白的生物信息学分析:采用综合性的生物化学大辞海和多层次数据整合模拟与网络分析的专业应用软件(IPA)对发现的差异蛋白分别进行了亚细胞定位、分子生物学功能和参与的生物学过程等分类。
差异蛋白的亚细胞定位:使用LOCATE数据库分析差异蛋白的亚细胞定位可知25种差异蛋白,大分子蛋白占10种,细胞骨架蛋白为7种,线粒体蛋白为7种,见图2。差异蛋白的分子功能:蛋白的PANTHER分类显示25种差异蛋白中,参与蛋白结合的18种,参与离子结合的6种,参与水解酶活性的5种,参与细胞结构的5种,见图3。差异蛋白参与的生物学途径:25种差异蛋白中,参与组织的形成过程13种,生物调节过程13种,发育过程12种,新陈代谢过程11种和对刺激的应答过程为11种。见图4。
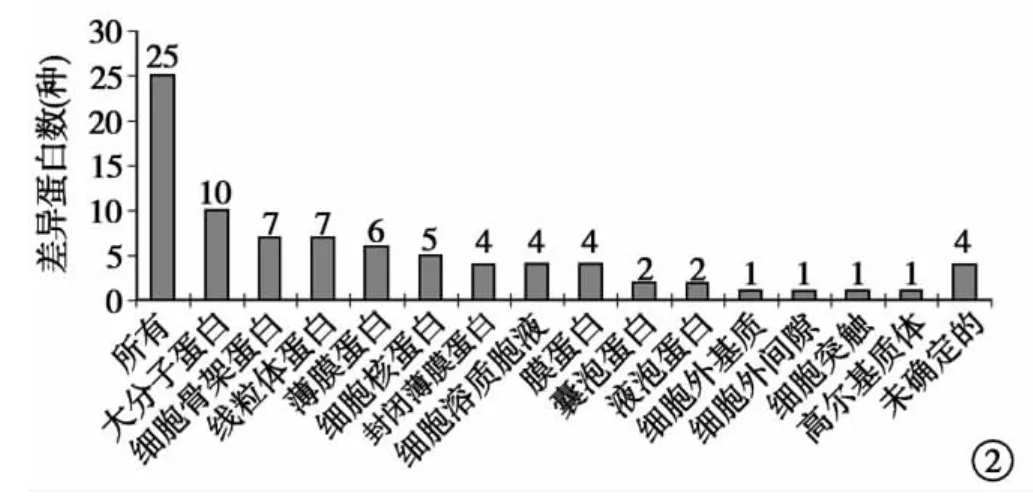
图2 差异蛋白的亚细胞定位
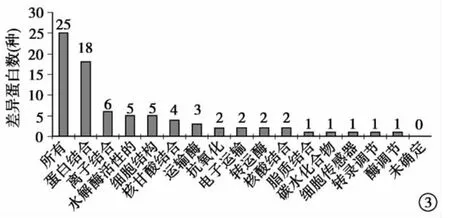
图3 差异蛋白的分子功能
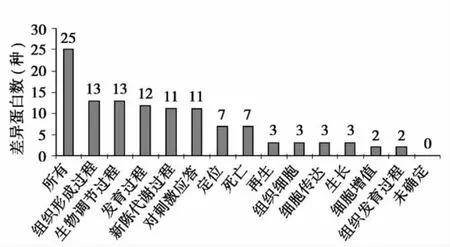
图4 差异蛋白参与的生物学途径
3 讨论
研究表明DCM中发生改变的蛋白主要包括心肌蛋白、信号转导蛋白、代谢相关蛋白、生长和增生蛋白、翻译蛋白和转录蛋白以及未知功能的蛋白等[7]。通过蛋白组学分析,我们对DCM患者心肌组织蛋白改变进行了全面筛选,共鉴定出25种差异蛋白,可分为几个功能蛋白组:参与线粒体和能量代谢的蛋白、参与心肌收缩的蛋白及其它。
线粒体蛋白以及参与能量代谢的蛋白:本研究发现,DCM患者和供体心肌组织之间25种差异蛋白中4种呼吸链相关蛋白复合物存在差异,包括NADH脱氢酶铁硫蛋白3、二氢脱氢酶、细胞色素C氧化酶亚基VB和λ2烯酰辅酶A异构酶。该结果提示线粒体膜可能是化学渗透和氧化还原反应的整合平台。因此,心肌细胞的非同步功能障碍及其对能量的需求增加可能是导致上述呼吸链中相关酶表达增加的原因。这与超负荷导致的非心衰心肌肥厚模型的研究结果一致[8]。
心肌细胞收缩:我们研究表明,在DCM患者心肌组织发生改变的25种差异蛋白中,7种细胞骨架蛋白表达显著增加,包括肌球蛋白轻链、肌钙蛋白Ⅰ型3和甲状腺素转运蛋白。
肌球蛋白轻链是心肌收缩力产生的关键成分,这些蛋白表达改变均可影响心肌收缩力[9]。肌球蛋白轻链2的表达改变与DCM[10]、缺血再灌注损伤、心力衰竭的收缩功能不良有关。这些蛋白在DCM患者心肌组织中上调可能是对心肌肌动蛋白减少的适应性代偿反应。此外,本研究还观察到肌球蛋白轻链2的表达改变可能是其磷酸化或脱氨基作用的变化并非总体表达增加。最近的研究显示50%肌球蛋白调节性轻链突变,可通过扰乱肌肉纤维钙离子浓度导致其机械功能障碍;同时,钙敏感性和其与心肌纤维收缩力生成之间的协同性,可能直接与家族型心肌肥大的机制相关[11]。
另外一种重要的心肌收缩蛋白是肌钙蛋白Ⅰ型3。该蛋白位于横纹肌的细肌丝上,是肌钙蛋白复合物的构成蛋白。肌钙蛋白Ⅰ型3为横纹肌收缩提供了钙敏感性开关,在缺血情况下能够调节系统性动脉血压;并参与了心肌收缩的调节和心室肌纤维的形成过程。在钙离子较低的情况下,肌钙蛋白Ⅰ型3可结合肌动蛋白,抑制肌动球蛋白ATP酶活性[12]。细胞内钙稳态改变导致心肌收缩相关蛋白改变可能是DCM心力衰竭发生发展的重要机制之一。
综上所述,我们对DCM患者心肌组织蛋白质组学研究发现,25种蛋白的表达发生了显著变化,这些蛋白包括参与线粒体和能量代谢的蛋白、参与心肌收缩的蛋白等。这些差异蛋白的发现为深入探索DCM的发病机制和探索DCM的新的治疗方法提供了有价值的信息;而且进一步可能会有利于防治DCM的发生、改善DCM患者心脏功能、提高生活质量和改善预后。
[1]杜宗雷,臧鑫,王玉其,等.左心室收缩不同步对扩张性心肌病患者预后的预测价值.中国循环杂志,2011,26:279-282.
[2]王志民,邹天宝,宋雷,等.超声心动图检查调查8080例成人扩张型心肌病患病率.中华心血管病杂志,2004,32:1090-1094.
[3]Komajda M,Jais JP.Factors predicting mortality in idiopathic dilated cardiomyopathy.Eur Heart J,1990,11:824-831.
[4]WeekesJ, Wheeler CH, Yan JX, et al. Bovine dilated cardiomyopathy:Proteomic analysis of an animal model of human dilated cardiomyopathy.Electrophoresis,1999,20:898-906.
[5]Blaekstoek W,Mann M.A boundless future for proteomies.Trends Bioteehnol,2001,19(Supp):51-52.
[6]魏英杰,胡盛寿,黄银霞,等.双向荧光差异凝胶电泳技术在心脏蛋白质组学研究中的应用.中国循环杂志,2008,23:297-301.
[7]Lindsey M,Goshorn D,Comte-Walters S,et al.A multidimensional proteomic approach to identify hypertrophy-associated proteins.Proteomics,2006,6:2225-2235.
[8]Jin X,Xia L,Wang L,et al.Differential protein expression in hypertrophic heart with and without hypertension in spontaneously hypertensive rats.Proteomics,2006,6:1948-1956.
[9]Seguchi O,Takashima S,Yamazaki S,et al.A cardiac myosin light chain kinase regulates sarcomere assembly in the vertebrate heart.Journal of Clinical Investigation,2007,117:2812-2824.
[10]Corbett J,Why H,Wheeler C,et al.Cardiac protein abnormalities in dilated cardiomyopathy detected by two-dimensional polyacrylamide gel electrophoresis.Electrophoresis,1998,19:2031-2042.
[11]Roopnarine O.Mechanical defects of muscle fibers with myosin light chain mutants that cause cardiomyopathy.Biophysical Journal,2003,84:2440-2449.
[12]Bhavsar P,Brand N,Yacoub M,et al.Isolation and characterization of the human cardiac troponin I gene(TNNI3).Genomics,1996,35:11-23.
Proteomic Study in Patients With Idiopathic Dilated Cardiomyopathy
YU Li-ping,SHI Lin-ying,ZHU Xiao-ming,CAI Jun,YANG Xin-chun,MENG Xian-min.
Department of Cardiology,Chaoyang Hospital,Capital University of Medical Science,Beijing(100020),China
YANG Xin-chun,Email:yangxc99@gmail.com
Objective:To compare the differences of protein expression in myocardium between normal subjects and the patients with idiopathic dilated cardiomyopathy(DCM)by proteomic study and to explore the molecular basis of DCM.
Methods:Our work included 2 groups.DCM group,n=9,the patients’left ventricular ejection fraction <35%and
heart transplantation,the cardiac tissue for proteomic study taken from the free wall of their own left ventricle.Normal control group,n=6,the cardiac tissue from unmatched normal donors.The protein spectrum was examine by 2-D electrophoresis,the differential protein was identified by MS-MS method,and the position,function and interaction of differential proteins were investigated with Ingenuity pathway analysis.
Results:2-D electrophoresis presented similar protein spectrums for a total of 1000 spots in both groups,and the comparative analysis found 25 differential proteins,and 15 of them up-regulated and 10 down-regulated in DCM group.LOCATE database classification for sub cellular localization showed that there were 40%of macromolecular protein,28%of cytoskeleton protein and 28%of mitochondrial protein.PANTHER protein itemization indicated that the majority of proteins involved in cell structure,muscle contraction,calcium transportation and hydrolase activity.The biological protein category explored that the differential pro-teins participated in tissue processes,biological regulation,developmental and metabolic processes and the response to stimulus in the body.
Conclusion:There were 25 differential proteins involved in mitochondrial metabolism,myocardial contraction and apoptosis,which may play the important role in DCM development and process.
Dilated cardiomyopathy;Proteomics;Energy metabolism
100020北京市,首都医科大学附属北京朝阳医院 心脏中心(于丽平、史琳影、朱晓明、蔡军、杨新春);阜外心血管病医院(孟宪敏)
于丽平 副主任医师 副教授 硕士生导师 硕士 主要从事高血压和心脏病分子机制的研究工作Email:YHP@medmail.com.cn通讯作者:杨新春 Email:yangxc99@gmail.com*史琳影对本文有同等贡献,并列为第一作者△为共同通讯作者 xmmengcn@163.com
R54
A
1000-3614(2013)01-0047-04
10.3969/j.issn.1000-3614.2013.01.014
2012-03-26)
(编辑:常文静)
