流感病毒感染对慢性阻塞性肺疾病患者氧化应激和全身炎性反应的影响
2013-09-10卢文宣张明泳唐华平青岛大学医学院附属青岛市市立医院东院呼吸科山东青岛266071
卢文宣 张明泳 韩 伟 唐华平 (青岛大学医学院附属青岛市市立医院东院呼吸科,山东 青岛 266071)
越来越多的证据显示慢性阻塞性肺病急性加重(Acute Exacerbation of Chronic Obstructive Pulmonary Disease,AECOPD)与病毒性呼吸道感染有关[1]。由于经常变异,即便常见的呼吸道病毒也可能引发严重的肺部病变,甚至死亡。阻断病毒损伤的关键步骤是目前治疗严重病毒感染的重要策略。本研究调查流感病毒感染AECOPD患者的气道氧化应激改变及其与病情的关系。
1 资料与方法
1.1 一般资料:选取2011年10月1日~2012年10月1日连续就诊青岛市市立医院东院呼吸科就诊的可疑病毒感染的中度AECOPD患者200例,其中男142例,女58例,年龄52~86岁,平均(73.90±9.83)岁,病程3~40年。COPD和AECOPD诊断标准参考2003版GOLD指南[2]。患者依次进行血常规、血内毒素(BET)、痰培养、胸部X线和肺功能检查。同时符合以下条件者可入选研究:①无脓性痰;②血液白细胞<10×109/L;③内毒素(BET)正常;④痰细菌培养阴性;⑤X线检查排除肺内其他病变;⑥肺功能检查(MedGraphic肺功能仪,美国):支气管舒张试验阴性,FEV1/FVC<70%,支气管舒张剂前60%<FEV1% <80%。另外选择20例中度COPD稳定期患者作为对照组。
1.2 呼吸道分泌物采集与处理:参考文献[3]。在就诊当日留取痰标本。加入等体积含0.1%DTT的PBS液中震荡2 min,37℃水浴15 min,1 500 r/min低速离心取上清液,置-20℃保存。
1.3 呼吸分泌物病毒测定:根据GeneBank数据库中流感病毒核苷酸序列,参照相关文献[4],用Primer express 5.0软件设计引物,流感病毒A引物序列如下:F:5'-GACCRATCCTGT-CACCTCTGAC-3';R:5'-GGGCATTYTGGACAAAKCGTCTACG-3'产物长度:108 bp。以RNase P作内参:F:5'-AGATTTGGACCTGCGAGCGR-3':5'-GAGCGGCTGTCTCCACAAGT-3'。反应体系总体积为 25 μl,具体如下:10×PCR Buffer 2.5 μl,dNTP Mix 2.5 μl,上游引物、下游引物各 1 μl,DNA Polymerase 0.2 μl,模板 DNA 1 μl,加 水补足至 25 μl。反应参数:95℃ 10 min ,95℃ 15 s,55℃ 31 s,72℃ 30 s,共35个循环,每次扩增均设立阳性对照和阴性对照。上述RTPCR产物2%琼脂糖凝胶电泳,紫外灯下观察。采用美国Gene Genius凝胶电泳成像系统测出目的基因和内参的表达强度,计算校正后目的基因表达强度(目的基因表达强度/内参表达强度)。
1.4 呼吸道氧化应激因子测定:取痰上清液,按参考文献[3],分别以WST-1法测定超氧化物岐化酶(SOD)和硫代巴比妥法测定脂质过氧化产物丙二醛(MDA)。SOD检测试剂盒和MDA检测试剂盒由南京建成生物有限公司提供。
1.5 血浆炎性因子测定:取患者空腹血3 ml放于抗凝管中,静置30 min后离心取血浆。以IL-6和IL-8 ELISA试剂盒(R&D)按说明书步骤测定IL-6和IL-8等炎性相关因子水平。
2 结果
2.1 患者分组和一般情况:共有25例患者痰液检出流感病毒,划入流感组。流感组和对照组在性别、年龄、吸烟史、COPD病史方面差异无统计学意义(P>0.05),见表1。
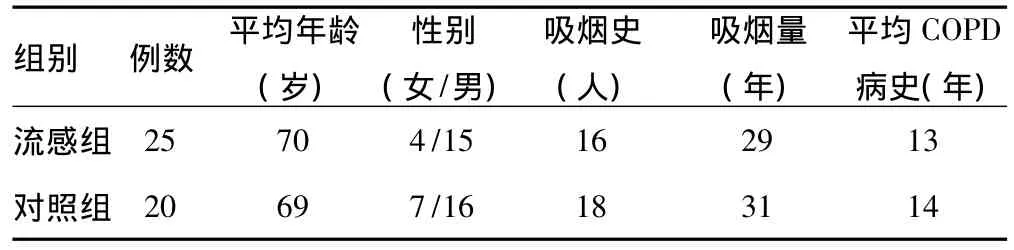
表1 两组患者一般情况对比
2.2 两组痰液中SOD和MDA水平比较:两组患者痰中SOD、MDA水平见表2。统计显示,流感组的MDA高于对照组,而流感组的SOD低于对照组,组间差别均有统计学意义(P﹤0.05)。
2.3 两组血浆炎性因子比较:两组患者血浆IL-6和IL-8水平见表3。统计显示,流感组的IL-6和IL-8水平高于对照组,组间差别均有统计学意义(P﹤0.05)。值得注意的是,流感组IL-8水平与MDA水平成正相关(r=0.463,P=0.020),见图1。
2.4 病毒表达强度与痰液氧化应激水平的关系:流感组流感病毒的校正后平均表达强度为0.66±0.07,统计发现,在流感组内,流感病毒表达强度与痰MDA成正相关(r=0.557,P﹤0.05,图2),提示流感病毒感染与气道氧化应激水平增强有关。
表2 两组患者痰MDA、SOD的水平(±s)
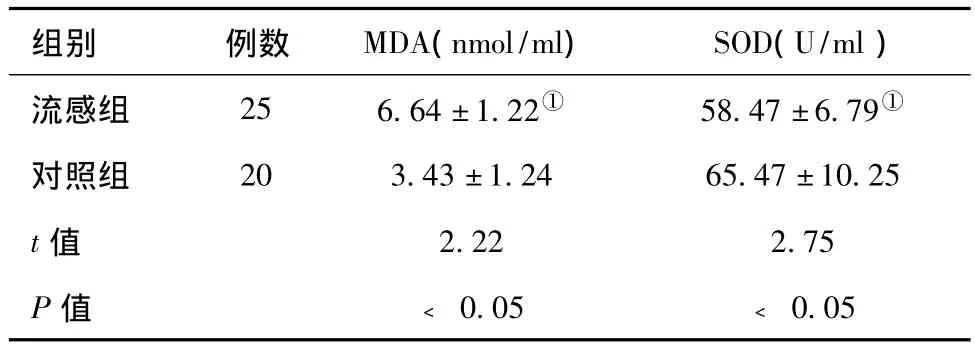
表2 两组患者痰MDA、SOD的水平(±s)
注:与对照组比较,①P<0.05
组别 例数 MDA(nmol/ml) SOD(U/ml)流感组 25 6.64±1.22① 58.47±6.79①对照组 20 3.43±1.24 65.47±10.25 t值 2.22 2.75 P值 ﹤0.05 ﹤0.05
表3 两组患者IL-6和IL-8的水平(±s)

表3 两组患者IL-6和IL-8的水平(±s)
注:与对照组比较,①P<0.05
组别 例数 IL-6(pg/ml) IL-8(ng/ml)流感组 25 67.89±15.8① 5.81±1.09①对照组 20 42.17±10.4 3.43±1.25 t值 6.27 3.95 P值 ﹤0.05 ﹤0.05

图1 流感组IL-8与MDA的相关性:r=0.463,P=0.020
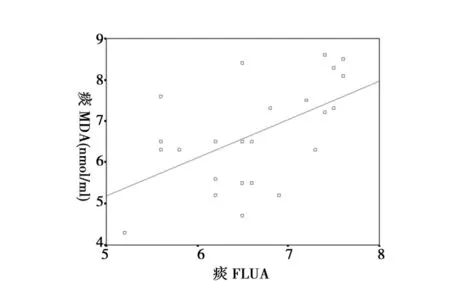
图2 流感病毒表达强度与痰MDA的相关性:r=0.557,P﹤0.05
3 讨论
越来越多的研究显示,呼吸道病毒感染是引起AECOPD的重要因素。与没有病毒参与的AECOPD相比,伴有病毒感染AECOPD患者的临床症状评分更高,痰和血液中的炎性因子水平更高,中位恢复时间更长,发作频率也更频繁[1,5]。本研究系统探讨了流感病毒对AECOPD患者氧化应激和气道炎症的影响。
作为COPD发病的重要病理生理机制,氧化/抗氧化失衡一直是COPD研究的重要方向[6]。MDA是氧化过程的终产物,具有强氧化性,可损害机体的组织和细胞,进而引起慢性疾病及衰老效应;而SOD能催化O-2发生歧化反应,以清除氧自由基,保护肺脏免受氧化损伤。二者可间接反应自由基代谢水平。本研究发现,和其他病因所致AECOPD一样,流感病毒致AECOPD患者气道内也存在氧化应激增强,表现为痰液MDA水平升高,而SOD明显降低(P<0.01)。而且流感病毒感染者MDA水平与流感病毒转录强度成正相关(r=0.557,P﹤0.05),提示流感病毒复制在COPD患者氧化应激中发挥重要作用[7]。纠正氧化/抗氧化失衡可能成为对抗流感病毒诱发AECOPD的重要方法。Yamada等早期研究发现应用抗氧化剂可保护小鼠抵抗致死剂量流感病毒A的危害[8]。但限于药物发展以及氧化/抗氧化平衡在机体的重要作用,尚无成熟的强效抗氧化剂应用于重症流感病毒的临床工作。进一步阐明流感病毒与氧化应激反应的内在联系,以及抗氧化治疗的机制是目前亟待解决的难题。最近研究发现抗氧化剂乙酰半胱胺酸能够抑制Ⅱ型上皮细胞的粘蛋白合成和促炎介质释放[9]。而Yageta等发现抗氧化因子Nrf2参与了吸烟小鼠对流感病毒感染的抵抗,再次证实氧化应激在流感病毒感染中发挥重要作用[10]。
IL-6和IL-8是两种重要的COPD促炎性反应因子,具有活化中性粒细胞和淋巴细胞,促进免疫蛋白分泌,推进炎性反应过程发展的作用,除有助于杀伤病原微生物及控制感染,二者的持续升高还参与了氧化应激过程。IL-6能够促进中性粒细胞的氧化反应,延缓中性粒细胞凋亡,释放更多超氧阴离子,加重氧化应激反应。IL-8能够吸引炎性细胞尤其是中性粒细胞到达炎性反应部位,并诱导其脱颗粒作用,释放大量氧自由基、组胺、花生四烯酸等系列炎性症介质,加重气道氧化应激炎性反应。和以往研究一致,本研究流感组COPD患者血清IL-8和IL-6水平均显著高于对照组(P<0.05),且本研究发现,流感组血清IL-8水平与气道MDA呈正相关(r=0.463,P=0.020)。这一结果进一步证明,在AECOPD气道氧化应激和炎性反应的同时存在全身炎性反应增强[11]。
综上所述,流感病毒感染与氧化应激间存在密切的联系,对于COPD患者在流感早期应用抗氧化应激的药物,可能缓解病情,改善患者预后,降低患者住院率和经济负担。有关阐明流感病毒参与氧化应激反应的机制,以及抗氧化治疗的作用,尚需进一步研究和评价。
[1] Varkey JB,Varkey B.Viral infections in patients with chronic obstructive pulmonary disease[J].Cur Opinion Pulm Med,2008,14(2):89.
[2] Global Strategy for the Diagnosis,Management and Prevention of Chronic Obstructive Lung Disease(update2010).Available from:http://www.goldcopd.org/Guidelines/guideline-2010-gold-report.html.
[3] 刘凌云,曾 勉,谢灿茂,等.慢性阻塞性肺病患者氧化应激状态及其与糖皮质激素受体水平的相关性[J].南方医科大学学报,2008,28(6):992.
[4] Rohde G,Wiethege A,Borg I,et al.Respiratory viruses in exacerbations of chronic obstructive pulmonary disease requiring hospitalization:a case-control study[J].Thorax,2003,58(1):37.
[5] Gorse GJ,O'connor TZ,Young SL,et al.Impact of a winter respiratory virus season on patients with COPD and association with influenza vaccination[J].Chest,2006,130(4):1109.
[6] Inonu H,Doruk S,Sahin S,et al.Oxidative stress levels in exhaled breath condensate associated with COPD and smoking[J].Respir Care,2012,57(3):413.
[7] Yamada Y,Limmon GV,Zheng D,et al.Major shifts in the spatio-temporal distribution of lung antioxidant enzymes during influenza pneumonia[J].Plos One,2012,7(2):e31494.
[8] Yatmaz S,Seow HJ,Gualano RC,et al.Glutathione Peroxidase-1(GPx-1)reduces influenza A virus-induced lung inflammation,2012.
[9] Mata M,Morcillo E,Gimeno C,et al.N-acetyl-L-cysteine(NAC)inhibit mucin synthesis and pro-inflammatory mediators in alveolar type II epithelial cells infected with influenza virus A and B and with respiratory syncytial virus(RSV)[J].Biochem Pharmacol,2011,82(5):548.
[10] Yageta Y,Ishii Y,Morishima Y,et al.Role of Nrf2 in host defense against influenza virus in cigarette smoke-exposed mice[J].J Virol,2011,85(10):4679.
[11] 国 家,丁 会,华树成.慢性阻塞性肺疾病的治疗进展[J]. 吉林医学,2010,31(4):539.
