SFRP5逆转白血病多药耐药性的研究*
2013-09-10王慧涵刘卓刚廖爱军赵成海
王慧涵 吴 斌 张 嵘 刘卓刚 杨 威 廖爱军 赵成海
SFRP5逆转白血病多药耐药性的研究*
王慧涵①吴 斌①张 嵘①刘卓刚①杨 威①廖爱军①赵成海②
目的:研究分泌型卷曲相关蛋白5(secreted frizzled related protein 5,SFRP5)对P-糖蛋白(P-glycoprotein,P-gp)介导的白血病多药耐药性的作用。方法:采用转基因方法构建过表达SFRP5的KG1a/SFRP5细胞,real-time PCR检测MDR1 mRNA表达,Western blot检测细胞P-gp表达。免疫荧光显微镜观察细胞膜表面P-gp表达。流式细胞仪检测细胞内药物浓度。MTT方法检测细胞耐药性。结果:与KG1a细胞及表达绿色荧光蛋白的KG1a/eGFP细胞相比,KG1a/SFRP5细胞中MDR1 mRNA水平显著下降(P<0.01),总P-gp表达水平亦被下调,细胞膜表面P-gp荧光强度减弱,细胞内的罗丹明浓度显著升高(P<0.01),对ADR的IC50显著降低(P<0.01),细胞耐药性下降。结论:SFRP5蛋白表达可以下调MDR1转录及P-gp表达,增加细胞内药物浓度,逆转白血病多药耐药。
分泌型卷曲相关蛋白5 白血病 多药耐药性 P-糖蛋白
白血病多药耐药(multidrug resistance,MDR)是化疗失败,造成白血病复发和难治的主要原因。由多药耐药基因(multidrug resistance gene,MDR1)编码的P-gp过表达造成抗癌药物外排增加、药效降低,是MDR形成的重要原因之一[1]。通过调节P-gp逆转MDR是临床治疗的难点及科学研究的重点。SFRP5是分泌型糖蛋白家族成员之一,通过竞争性抑制Wnt信号通路特异性受体卷曲蛋白(Fz)受体从而抑制Wnt的活化[2]。有研究显示在白血病细胞中存在SFRP5基因启动子区域甲基化,导致SFRP5蛋白表达缺失或下调[3],但这种SFRP5蛋白表达下调在肿瘤发生发展中的作用,特别是对于P-gp介导的多药耐药的作用尚不明确。在本研究中,选择SFRP5高度甲基化的多药耐药白血病细胞系KG1a作为研究对象,验证SFRP5对白血病多药耐药的作用。
1 材料与方法
1.1 实验材料
人白血病KG1a细胞株来自中国医学科学院血液病研究所。表达SFRP5的质粒EX-O0006-M02、表达绿色荧光蛋白的EX-EGFP-M02质粒购自美国GeneCopoeia公司。Plasmid mini purification kit试剂盒购自德国QIAGEN公司。Lipofectamine 2000®Transfection Reagent购自美国Invitrogen公司。PE标记的P-gp抗体购自美国BD公司。SYBR Premix Ex TaqTM试剂盒购自日本TaKaRa公司。
1.2 方法
1.2.1 细胞培养和转染 KG1a细胞用含10%胎牛血清1640培养基在37℃,5%CO2细胞培养箱中培养。适量细胞接种在6孔板中,过夜后用脂质体Lipofectamine®2000 Transfection Reagent分别将表达SFRP5的质粒EX-O0006-M02,表达绿色荧光蛋白的EX-EGFP-M02质粒进行细胞转染。6 h后换液,更换20%血清1640培养液继续培养72 h进行后续实验。
1.2.2 Western blot检测SFRP5及P-gp蛋白表达情况收集细胞,PBS洗2次,每107个细胞加1 mL预冷的RIPA裂解液,混匀,冰上震荡30 min,4℃,12 000 rpm离心30 min,收上清,BCA方法测蛋白浓度。取50 μg蛋白样品加入上样缓冲液,100℃煮沸5 min,用SDS-PAGE分离,将蛋白转移到硝酸纤维素滤膜上。将硝酸纤维素滤膜加入含有5%脱脂奶粉的封闭液中,4℃摇床孵育过夜,加入兔抗人SFRP5及兔抗人P-gp一抗,4℃摇床孵育过夜。除去一抗,加入鼠抗兔二抗,室温下摇床孵育2 h,除去二抗。加显色剂,在X射线胶片曝光成像并分析。
1.2.3 real-time PCR检测MDR1表达 应用real-time PCR检测KG1a,KG1a/eGFP及KG1a/SFRP5细胞内MDR1 mRNA水平。引物序列:MDR1:上游5'-ATAATGCGACAGGAGATAGG-3',下游 5'-TTGC CATTGACTGAAAGAAC-3';GAPDH:上游 5'-AGTC AACGGATTTGGTCGTA-3',下 游 5'-GGAACATGTA AACCATGTAG-3';PCR扩增程序:95℃ 30 s,95℃ 5 s,60℃ 35 s,共40个循环。
1.2.4 荧光显微镜观察细胞膜表面P-gp水平 收集KG1a,KG1a/eGFP及KG1a/SFRP5 3组细胞,调整细胞数为5×105。加入4 μL鼠抗人PE-P-gp直标抗体,4℃孵育30 min。PBS洗涤细胞2次,将细胞滴于载玻片上,用盖玻片盖上细胞,荧光显微镜下观察呈现红色荧光的细胞情况。
1.2.5 流式细胞仪检测细胞内药物浓度 收集KG1a,KG1a/eGFP及KG1a/SFRP5 3组细胞,调整细胞数1×106。将罗丹明(终浓度0.3 μM)溶于无血清1640培养液中。将细胞沉淀重悬于2 mL所配置的培养液中。应用维拉帕米(10 μM)作为阳性对照。37℃水浴震荡培养2 h。PBS洗1次,流式细胞仪检测细胞内荧光强度。
1.2.6 MTT方法检测细胞耐药性 收集KG1a,KG1a/eGFP及KG1a/SFRP5细胞,接种于96孔板,实验设3个复孔,并设空白对照。接种8 h后,加入ADR,使终浓度依次为(0、0.1、0.25、0.5、1、5、10、20、50 μM)。MTT方法测各孔OD值,计算IC50。实验重复3次。
1.3 统计学分析
2 结果
2.1 KG1a细胞转染SFRP5后表达鉴定
荧光显微镜下观察转染效率可达到90%。应用流式细胞仪检测eGFP阳性细胞为92.1%。应用Western blot检测SFRP5表达情况。结果显示,转染后KG1a/SFRP5细胞恢复SFRP5表达,而KG1a,KG1a/eGFP细胞内SFRP5表达仍缺失(图1)。

图1 Western blot检测细胞转染72 h后SFRP5在KG1a、KG1a/eGFP及KG1a/SFRP5细胞中的表达Figure 1 SFRP5 expression in KG1a,KG1a/eGFP and KG1a/SFRP5 were detected by Western blot 72 hours after transfection
2.2 Real-time PCR检测MDR1表达
应用real-time PCR检测KG1a,KG1a/eGFP及KG1a/SFRP5细胞内MDR1 mRNA水平。结果显示KG1a/SFRP5细胞中MDR1 mRNA水平显著下降(P<0.01,图2)。

图2 Real-time PCR检测SFRP5转染KG1a细胞后MDR1 mRNA水平的变化Figure 2 Real-time PCR detection of the expression of mdr1 mRNA in KG1a,KG1a/eGFP and KG1a/SFRP5 groups.*P<0.01,vs.SFRP5(-)
2.3 Western blot检测P-gp蛋白表达
采用Western blot检测KG1a,KG1a/eGFP及KG1a/SFRP5细胞中总体P-gp表达水平,结果显示KG1a/SFRP5细胞中P-gp表达被下调(图3)。
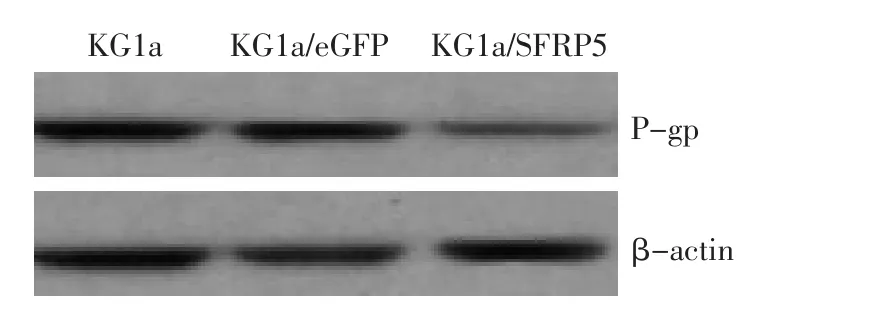
图3 Western blot检测SFRP5转染KG1a细胞后P-gp表达的影响Figure 3 SFRP5 expression in KG1a,KG1a/eGFP,and KG1a/SFRP5 detected by Western blot analysis
2.4 荧光显微镜观察细胞膜表面P-gp表达
应用PE标记的P-gp直标抗体检测KG1a,KG1a/eGFP及KG1a/SFRP5细胞膜表面P-gp的表达,在荧光显微镜下观察红色荧光强度。结果显示,KG1a/SFRP5细胞红色荧光强度明显弱于KG1a及KG1a/eGFP细胞(图4)。

图4 荧光显微镜下观察转染72 h后细胞表面P-gp表达情况Figure 4 P-gp expression on the cell surface observed by immunofluorescence.4A,KG1a cell;4B,KG1a/eGFP cell;4C,KG1a/SFRP5 cell
2.5 流式细胞仪检测细胞内药物浓度
应用流式细胞仪检测细胞内罗丹明的荧光强度,代表细胞内药物浓度变化。应用维拉帕米(Verapamil)作为阳性对照,实验重复3次。结果显示KG1a/SFRP5细胞内罗丹明荧光强度较KG1a及KG1a/eGFP细胞明显增多(P<0.01,图5)。

图5 流式细胞仪检测细胞内罗丹明荧光强度(*P<0.01,vs.KG1a)Figure 5 Intracellular drug concentration detected by flow cytometry*P<0.01,vs.KG1a
2.6 MTT方法检测细胞耐药性变化
KG1a中ADR的IC50为(0.963±0.115)μM;KG1a/eGFP中ADR的IC50为(0.917±0.138)μM;KG1a/SFRP5中ADR的IC50为(0.573±0.131)μM。KG1a/SFRP5对ADR的IC50较KG1a及KG1a/eGFP相比明显下降(P<0.01)。
3 讨论
SFRP5是SFRPs家族的一个分泌型蛋白,大量的研究显示在多种肿瘤细胞中存在SFRP5基因启动子区甲基化,并导致蛋白表达的下降[4-6]。Griffiths等[7]的研究提示SFRP5甲基化导致的SFRP5蛋白表达下降可能增加AML复发的风险。Su等[8]研究卵巢癌发现SFRP5甲基化状态与卵巢癌对顺铂的耐药性有关,通过基因转染恢复SFRP5表达后减弱Wnt信号活性,能够抑制小鼠卵巢癌细胞生长、浸润及肿瘤形成。同时SFRP5恢复表达还能够抑制上皮-间质转化,下调AKT2,增加卵巢癌细胞对化疗的敏感性。
由MDR1编码的P-gp过表达造成抗癌药物外排增加、药效降低,是多药耐药形成的主要原因[9]。Lim等[10]以大鼠脑内皮细胞及人大脑内皮细胞系hCMEC/D3作为研究对象,发现应用GSK-3抑制剂激活β-catenin通路能够促进MDR1基因转录及P-gp蛋白表达,并伴随药物外排的增加。Flahaut等[11]报道了21例神经母细胞瘤的患者化疗后存在FZD1及MDR1的过表达。应用specific micro-adapted short hairpin RNA(shRNAmir)介导FZD1基因沉默后,MDR1表达明显减少。
为了验证SFRP5在P-gp介导的白血病多药耐药中的作用,本研究选择了SFRP5高度甲基化的多药耐药白血病细胞系KG1a,应用转基因的方法恢复其SFRP5的表达,发现KG1a/SFRP5中MDR1 mRNA水平显著下降,P-gp表达水平在SFRP5表达恢复后亦被下调。P-gp是膜蛋白,其表达的多少直接影响药物外排。本研究应用荧光显微镜观察细胞膜表面的P-gp,发现其表达明显减少。进一步应用流式细胞仪检测细胞内药物浓度来评价P-gp的功能,发现KG1a/SFRP5细胞中药物浓度增加。应用MTT方法计算细胞耐药性的变化,发现SFRP5表达恢复的KG1a细胞耐药性下降。这些结果证明了SFRP5能够逆转P-gp介导的白血病多药耐药。
本研究证实SFRP5蛋白表达缺失参与肿瘤多药耐药的形成,故SFRP5蛋白及其信号通路可能作为评估白血病预后的新指标及治疗多药耐药白血病的新靶点,从而提高白血病的治疗缓解率,改善预后。
1 Baguley BC.Multiple Drug Resistance Mechanisms in Cancer[J].Mol Biotechnol,2010,46(3):308-316.
2 Mii Y,Taira M.Secreted Wnt"inhibitors"are not just inhibitors:regulation of extracellular Wnt by secreted Frizzled-related proteins[J].Dev Growth Differ,2011,53(8):911-923.
3 Kinoshita T,Nomoto S,Kodera Y,et al.Decreased expression and aberrant hypermethylation of the SFRP genes in human gastric can-cer[J].Hepatogastroenterology,2011,58(107-108):1051-1056.
4 Shin H,Kim JH,Lee YS,et al.Change in gene expression profiles of secreted frizzled-related proteins(SFRPs)by sodium butyrate in gastric cancers:Induction of promoter demethylation and histone modification causing inhibition of Wnt signaling[J].Int J Oncol,2012,40(5):1533-1542.
5 Liu JB,Qiang FL,Dong J,et al.Plasma DNA methylation of Wnt antagonists predicts recurrence of esophageal squamous cell carcinoma[J].World J Gastroenterol,2011,17(44):4917-4921.
6 Liu JB,Zhang YX,Zhou SH,et al.CpG island methylator phenotype in plasma is associated with hepatocellular carcinoma prognosis[J].World J Gastroenterol,2011,17(42):4718-4724.
7 Griffiths EA,Gore SD,Hooker C,et al.Acute myeloid leukemia is characterized by Wnt pathway inhibitor promoter hypermethylation[J].Leuk Lymphoma,2010,51(9):1711-1719.
8 Su HY,Lai HC,Lin YW,et al.Epigenetic silencing of SFRP5 is related to malignant phenotype and chemoresistance of ovarian cancer through Wnt signaling pathway[J].Int J Cancer,2010,127(3):555-567.
9 Y Li,H Yuan,K Yang,et al.The Structure and Functions of P-Glycoprotein[J].Current Medicinal Chemistry,2010,17(8):786-800.
10 Lim JC,Kania KD,Wijesuriya H,et al.Activation of beta-catenin signalling by GSK-3 inhibition increases p-glycoprotein expression in brain endothelial cells[J].J Neurochem,2008,106(4):1855-1865.
11 Flahaut M,Meier R,Coulon A,et al.The Wnt receptor FZD1 mediates chemoresistance in neuroblastoma through activation of the Wnt/beta-catenin pathway[J].Oncogene,2009,28(23):2245-2256.
(2012-07-16收稿)
(2012-10-25修回)
SFRP5 reversal multidrug resistance in leukemia KG1a cells
Huihan WANG1,Bin WU1,Rong ZHANG1,Zhuogang LIU1,Wei YANG1,Aijun LIAO1,Chenghai ZHAO2
Zhuogang LIU;E-mail:liuzg@sj-hospital.org
1Department of Hematology,Shengjing Hospital affiliated to China Medical University,Shenyang 110004,China2Department of Pathophysiology,China Medical University,Shenyang 110004,China
Objective:To investigate the effect of secreted frizzled-related protein 5(SFRP5)on leukemic multidrug resistance.Methods:Transgenic methods were used to culture KG1a cells expressing SFRP5 and enhanced green fluorescent protein(control).mdr1 mRNA expression in KG1a,KG1a/eGFP,and KG1a/SFRP5 groups were detected by real-time polymerase chain reaction.P-glycoprotein(P-gp)expression was detected by Western blot analysis.P-gp expression on the cell surface was observed by immunofluorescence.Intracellular drug concentration was detected by flow cytometry.Drug resistance was detected by MTT assay.Results:The KG1a/SFRP5 cell,a KG1a cell expressing SFRP5,and the KG1a/eGFP cell,a KG1a cell expressing eGFP,were successfully constructed.The multidrug resistance protein 1(mdr1)mRNAlevel in KG1a/SFRP5 cells was significantly decreased(P<0.01).P-gp expression in KG1a/SFRP5 cells was also downregulated.Fluorescence intensity of P-gp on the KG1a/SFRP5 cell surface was reduced.Rhodamine concentration in KG1a/SFRP5 cell was significantly increased(P<0.01).IC50of KG1a/SFRP5 cell toAdriamycin was decreased as determined by the MTT method.Conclusion:SFRP5 expression in KG1a cells can downregulate MDR1 transcription and P-gp expression,increase intracellular drug concentration,and reverse multidrug resistance.
secreted frizzled-related protein 5,leukemia,multidrug,P-glycoprotein
10.3969/j.issn.1000-8179.2013.06.002
①中国医科大学附属盛京医院血液科(沈阳市110004);②中国医科大学病理生理教研室
*本文课题受国家自然科学基金项目(编号:81100376)资助
刘卓刚 liuzg@sj-hospital.org
This work was supported by the National Natural Science Fundation of China(Grant No.81100376)
(本文编辑:杨红欣)
