青藏高原高寒草甸夏季植被特征及对模拟增温的短期响应
2013-09-07徐满厚
徐满厚,薛 娴
(中国科学院寒区旱区环境与工程研究所 沙漠与沙漠化重点实验室,兰州 730000)
现今,由温室气体增加而引起的全球气候变化已经成为不容置疑的事实[1]。根据政府间气候变化专门委员会第四次评估报告预测,到本世纪末全球平均气温将升高1.8—4.0℃[2],而Thomas等[3]认为在高纬度和高海拔地区温度升幅会更大。自1965—1995年,气温升高1—2℃以上的地区主要集中在北纬50°以上的陆地,该地区植被对温度变化异常敏感[4]。Hall等[5]和 Keeling等[6]研究也发现,高纬度地区大气 CO2的季节振幅在不断升高的同时全球陆地生态系统的净初级生产力也在增加。因此,科学家们普遍认为高纬度和高海拔生态系统对温度升高的响应更为敏感而迅速[7]。
有“中华水塔”和“世界第三极”之称的青藏高原属于气候变化的敏感区和生态脆弱带[8-9]。有研究表明[10-11],随着全球变暖,青藏高原气候呈现出暖化趋势,而气候因素的变异将成为诱发生态变异的动力。作为青藏高原较为典型的植被类型,高寒草甸是适应高原隆起与长期低温环境形成的特殊产物[12],是典型的高原地带性和山地垂直地带性植被[13],也是牧民的主要牧草来源。但其生态系统极其脆弱,对人类干扰和由温室气体引起的全球气候变化极其敏感,一旦遭受破坏很难在短期内得到恢复,并可能导致草地退化和沙漠化发生,从而影响牧民经济生活。在全球气候变暖的背景下,随着青藏高原气候暖化,高寒草甸植被的物候与生长、光合特征、生物量生产与分配,以及群落的演替和碳氮含量等都会随之发生改变。因此,研究青藏高原高寒草甸植被在全球气候变化下的动态变化规律及其驱动机制,对高纬度和高海拔地区植被的保护和有效利用,防止草地退化和沙漠化发生具有重要意义。为研究高寒植被在全球气候变化下的动态变化规律,在青藏高原高寒草甸区进行模拟增温实验,试图回答以下两个问题:(1)高寒草甸夏季植被表现怎样的生长动态特征?(2)高寒草甸环境与植被对短期增温如何响应?
1 研究方法
1.1 研究区概况
研究区位于中国科学院冻土工程国家重点实验室青藏高原研究基地(简称北麓河试验站),地理坐标为34°49'33.98″—34°49'36.58″N,92°55'57.19″—92°56'06.32″E,平均海拔 4630 m。该地属青藏高原干寒气候区,年均气温为-5.9℃,年均降水量267.6 mm,年均潜在蒸发量1316.9 mm,年均风速4.1 m/s,冻结期为9月至翌年4月[14]。实验期间风速较小,4 m高度处平均风速为3.4 m/s。风向以西风为主,有时为西南偏西风。植被属高寒草甸类型,以高山嵩草(Kobresia pygmaea)为建群种,伴生有矮火绒草(Leontopodium nanum)、美丽风毛菊(Saussurea pulchra)、藏嵩草(Kobresia tibetica)、青藏苔草(Carex moorcroftii)、细小棘豆(Oxytropis pusilla)等,以莎草科和菊科的植物为主,蓼科的珠芽蓼 (Polygonum viviparum)也较为常见,植被盖度达83%。动物主要是高原鼠兔(Ochotona curzoniae),营群居生活,筑巢掘出土壤在地面堆积形成“小土丘”。土壤为高山草甸土,以沙土居多,剖面发育具有薄层性、粗骨性特点;表层具有5—15 cm厚草皮层,土层一般仅为4—6 cm,有机质含量达8—25 g/kg;表层以下常夹带多量砾石,呈As-A1-C/D结构,B层发育不明显[14]。
1.2 样地设置
实验样地设在距北麓河试验站约300 m的典型高寒草甸地段,植被分布均匀,地势较为平坦,未受放牧、鼠兔啃食等干扰。增温实验采用红外线辐射器,用于真实模拟全球气候变暖中增强的向下红外线辐射。不同能量辐射到地表可不同程度改变地面温度,据此实验布设3种能量梯度:0 W/m2(对照,T0)、130 W/m2(使地面温度约增加1℃,T1)和150 W/m2(使地面温度约增加3℃,T2),每种梯度5个重复,共计15个增温样地。每个增温样地面积2 m×2 m,分布位置如图1所示。增温样地正上方距地面1.5 m高度处架设红外线辐射器,其中T0处理只设灯架,用于消除各增温处理中灯架遮阴对植被的影响;距地面1 m高度处架设SI-111红外地表温度传感器,测定下垫面温度;距地面20 cm高度处架设HMP45C温湿度探头,测定20 cm高度空气温度、空气相对湿度和空气水汽压;土壤中布设109SS-L温度探头测定20、40、60、100 cm深度土壤温度,布设FDR(Envior SMART)水分探头测定10、20、40、60、100 cm深度土壤水分。采用CR1000数据采集仪进行数据采集,频度为10 min采集1次。为减弱强风对增温实验影响,根据研究区主风向(西风),在距增温样地中心位置1.5 m处设置两块高度为1.5 m的挡风板,分别位于增温样地的北面和西面。由于每个增温样地均设有挡风板,故各增温处理中挡风板遮阴对植被的影响也可消除(同灯架设置)。在增温样地外部空旷处架设一小型生态气象观测站,用于常规气象数据观测。增温样地(图2a)和小型生态气象观测站(图2b)均用铁丝网围拦,以防破坏。整个实验样地于2010年6月完成设置。

图1 实验样地分布示意图Fig.1 Distribution schematic diagram of experimental plots

图2 增温样地与小型生态气象观测站Fig.2 Experimental warming plot and small ecological meteorology station
1.3 调查方法
增温样地用做长期观测,为避免对该样地产生较大人为干扰,在其外围2 m左右处选取高度和盖度与之较为一致的植被作为非实验样地。根据非实验样地植被覆盖情况设置大小为20 cm×20 cm或30 cm×30 cm的样方,测其植被高度、盖度和地上-地下生物量,测定时间为2010年6、8月和2011年6、7、8、10月,每月调查10个样方,共计60个。为保证测定时间的一致性,于2011年夏季 (6、7、8月,已增温1a)测定增温样地植被高度和盖度。由于非实验样地是在增温样地周围近距离处选取,二者生境相同,且植被高度和盖度与增温样地植被较为一致,故可通过建立非实验样地植被地上-地下生物量与高度、盖度的多元回归方程 (见数据分析)间接推导出增温样地不同时期的植被地上-地下生物量。
各样地植被指标按以下方法进行测定:植被高度用特制的直尺测定,由于高寒草甸植物矮小,为减小测量误差,将直尺零刻度线至边缘的空白区去掉,使直尺从零刻度开始,按对角线测定高度值,增温样地每条对角线上随机测定20个,共测40个高度值;非实验样地由于样方小,每条对角线上随机测定5个,共测10个高度值。盖度借助大小为27 cm×27 cm的样方框测定,并根据样方框大小特制一个网格尺寸为2.5 cm×2.5 cm的硬铁丝网,网格数为100个,在测定植被盖度时将其平铺在样方框内,计数被植被覆盖的小方格;增温样地由于面积大,测定时先将样地平分为4个部分,然后测定每一部分的盖度值,取其平均值作为该样地的盖度,非实验样地直接测定样方中的盖度值。地上生物量采用齐地刈割法,在刈割时会有部分植物残片掉落,因此刈割完毕用毛刷将未收集的地上部分扫在一起,去除附着的土块后重新收集到样品袋中;高寒草甸中有些植物铺地生长,如垫状点滴梅(Androsace tapete),对于这类植物普通剪刀难以将其割掉收集,因此对地上部分的刈割采用的是弯剪。地下生物量采用挖土块法,在地上部分刈割完毕,将样方内0—30 cm深度的土壤全部挖出(土量为20 cm×20 cm×30 cm或30 cm×30 cm×30 cm),为防止根系腐烂在北麓河试验站立即放进网孔为1 mm×1 mm的筛网中冲洗、晒干,连同地上部分一起带回实验室放进75℃的烘箱中烘干48 h至恒重,然后称重。为保证大部分根系具有活性,根系采集于夏季进行,而且在实验中发现,根系具有极其相似的灰褐色,为区分根系中的活根和死根,将根斜割断后根据断面的颜色和根的柔韧性进行判断。
1.4 数据分析
通过测定和计算获得用于分析的数据有:非实验样地的60组植被数据(高度、盖度、地上生物量、地下生物量、总生物量、根冠比),其中有30组为夏季植被数据;非实验样地的环境因子数据 (0.5、1、2、4 m高度的空气温度、空气相对湿度和风速,10—100 cm深度的土壤温度和土壤水分);增温样地的夏季植被数据 (高度、盖度)和环境因子数据(20 cm高度的空气温度、空气相对湿度和空气水汽压,红外地表温度,10—100 cm深度的土壤水分,20—100 cm深度的土壤温度)。首先利用非实验样地的这60组植被数据通过SPSS17.0软件构建植被地上生物量和地下生物量与高度、盖度的多元回归方程:AB=72.739C+30.257H-29.95(R2=0.322,P<0.01),BB=14187.995C-340.281H-2249.69(R2=0.604,P<0.01),其中 H 为高度/cm、C 为盖度、AB为地上生物量、BB为地下生物量。然后用SPSS17.0软件和Origin8.1软件对非实验样地和增温样地夏季植被指标进行相关、回归分析,用Origin8.1软件对非实验样地植被随时间的变化情况进行趋势分析,以此得到青藏高原高寒草甸夏季植被特征。最后用Origin8.1软件对增温样地环境因子和植被随增温的变化情况进行趋势分析,得到青藏高原高寒草甸环境与植被对增温的短期响应。指标间的显著性检验由SPSS17.0软件进行方差分析得到,多重比较由Duncan检验完成;分析图的绘制由Origin8.1软件完成。
2 结果与分析
2.1 青藏高原高寒草甸夏季植被特征
2.1.1 夏季植被指标间的相互关系
空间上研究整个样地(增温样地和非实验样地)夏季植被指标间的相互关系,对其进行相关分析 (表1)。结果显示:高度与地上生物量呈极显著正相关,与根冠比呈极显著负相关,但与地下生物量和总生物量的相关性未达到显著水平;盖度与地上生物量、地下生物量和总生物量都呈极显著正相关,与根冠比呈显著正相关。高度与地上生物量的相关系数 (0.892)大于地下生物量 (0.214)和总生物量 (0.239),说明高度对地上生物量影响较大;盖度与地下生物量(0.883)和总生物量(0.888)的相关系数接近,且都大于地上生物量(0.579),说明盖度对地下生物量和总生物量影响较大。地上生物量与地下生物量的正相关性达到极显著水平,说明植被地上-地下生物量密切相关,即植被在将能量分配给地上茎叶的同时也分配到地下根系。

表1 植被指标间的相关分析Table1 Correlation analysis among vegetation indexes in all plots
为进一步探讨植被地上部分和地下部分的相互关系,对各植被指标进行回归分析,得图3。高度与地下生物量、总生物量不呈显著线性关系(表1),而呈极显著幂函数关系(图3)。除图3i外,其他回归关系图都呈现出极显著幂函数关系,幂指数变化范围在0.36—1.7之间,表明高寒草甸植被符合异速生长理论。当幂指数接近于1时,则表现为等速生长。如图3c所示,幂指数为1.0111,表明地上生物量随高度近似等速变化,即高度每增加1 cm,地上生物量就近似增加36.7 g/m2,图3d的幂指数(1.1523)也较接近于1,说明高寒草甸植被地上部分近似等速生长。图3e和图3f的幂指数分别为0.4585和1.7002,表明地下部分却为异速生长。因此,高寒草甸植被地上部分和地下部分由于所处环境不同而表现出不同的生长模式,但就总体而言(图3g和图3h),高寒草甸植被表现为异速生长。10幅回归图中只有图3i表现为负相关,其他为正相关,该结果与表1一致;高度与地上生物量的决定系数 (0.8461)大于地下生物量 (0.1407)和总生物量 (0.1537),盖度与地下生物量(0.9041)和总生物量(0.9111)的决定系数大于地上生物量(0.5133),这也证明了高度对地上生物量影响较大,盖度对地下生物量和总生物量影响较大。
2.1.2 非实验样地植被随时间的变化趋势
从时间上看,非实验样地的数据采集时间跨度1a(2010-6—2011-10),以6月份和8月份的植被数据为例,探讨高寒植被随时间的变化趋势(图4),以6月份的数据来看,1a之后植被生物量都有减小趋势,其中地上生物量显著减小,地下生物量减小不显著,根冠比显著增加;以8月份的数据来看,植被地上-地下生物量也呈减小趋势,但都未达到显著水平,而根冠比呈增加趋势,说明植被地上生物量的减小幅度大于地下生物量。因此,高寒草甸植被根系更新较慢,使地下生物量在1a之后变化不显著。另外,地上生物量 (P<0.05)在6月份对环境较地下生物量(P>0.05)敏感,但在8月份敏感性减弱,使生物量年际变化较大。
为分析植被生物量减小的原因,对非实验样地1a之后6月份和8月份的环境因子进行统计分析。图5显示,1a之后不同深度的土壤温度在6月份和8月份均极显著减小;土壤水分在6月份除10 cm深度未达到显著水平外,其他各深度均显著减小,在8月份则只有10 cm深度达到显著水平,但总体也呈现减小趋势。1a之后不同高度的空气温度在6月份和8月份均显著减小;空气相对湿度和风速未达到显著水平,且二者的变化趋势也不明显。空气相对湿度在6月份和8月份略有减小;风速在6月份略有增大,在8月份略有减小。可见,实验期间空气相对湿度和风速对植被影响较小。通过对图4和图5的分析可知,1a之后植被生物量的减小与土壤温度、土壤水分及空气温度的显著减小密切相关,并且地上生物量较地下生物量对温度和水分的响应更为敏感。

图3 植被指标间的回归分析Fig.3 Regression analysis between vegetation indexes in all plots
2.2 青藏高原高寒草甸环境与植被对增温的短期响应
2.2.1 增温样地环境因子随温度升高的变化趋势
(1)温度的变化
图6所示,温度随土层加深和高度增加而减小,随增温幅度增强(T0—T2)而增加,并且在土壤40 cm深度以后的T0和T1之间差异不再显著。空气、地表、土壤温度都随增温幅度增强而增加,表明红外辐射器起到了提高温度的作用,即红外辐射器在高寒草甸的增温度效果较好。另外,红外辐射器对0—40 cm深度的土壤温度影响较大 (P<0.05),对60—100 cm深度的土壤温度影响较小 (P>0.05)。随土层加深和高度增加,增温处理间距缩小,表明增温对温度影响减弱。

图4 非实验样地植被指标1a后的变化Fig.4 Variation of vegetation indexes in non-experiment plots after one year
(2)水分的变化
图7所示,随土壤深度增加,土壤水分在0—20 cm内减少,20—100 cm内增加,表明高寒草甸区土壤水分主要分布在深层。由于高寒草甸植被根系浅,主要利用表层土壤水分,致使0—20 cm内土壤水分降低。增温处理间距在0—40 cm内减小,40—100 cm内增加,表明增温促进0—40 cm内土壤水分减少,40—100 cm内土壤水分增加,即增温对土壤水分的影响随土层加深而增加,与土壤温度的变化趋势相反。20 cm高度空气湿度随增温而降低,并在T0和T2之间差异达到显著水平;20 cm高度空气水汽压随增温有先减小后增加的趋势,但整体变化不大,且增温处理间的差异也不显著,这说明增温1a后0—40 cm内的土壤水分较少蒸发到空气中,而是大部分下移到土壤深层,并在100 cm深度处的T0和T2之间出现显著差异。不同土层土壤水分在不同增温处理下的变化趋势也表明,红外辐射器在高寒草甸起到了较好的增温效果。
2.2.2 增温样地植被随温度升高的变化趋势
在非实验样地,从空间和时间两个角度探讨了植被指标间的相互关系,以此得到高寒草甸夏季植被的生长动态特征。在模拟增温处理下,该植被会发生怎样的变化,如图8所示。各类植被指标在不同增温处理下的变化趋势可分为三类:高度和地上生物量为一类,其变化趋势在6月和8月先增加后减小,增温1℃和增温3℃大于增温0℃,增温3℃略小于增温1℃;在7月则逐渐增加。第二类为盖度、总生物量和地下生物量,其变化趋势在6月和7月先增加后减小,增温1℃大于增温0℃和增温3℃;在8月增温0℃和增温3℃相差不大。第三类为根冠比,其变化趋势在6月和7月逐渐减小;在8月先减小后增加,增温0℃和增温3℃相差不大。可见,增温对植被的影响在不同月份较不一致,但总体来说,增温对植被有正效应,其中植被高度和地上生物量随增温有增加趋势,盖度、地下生物量和总生物量在前期有增加趋势,后期增加趋势减弱 (表2)。就植被在T1—T2的变化趋势而言,各植被指标均有减小趋势,而且各指标在T2与T1之间的平均差值均为负值(表2),这表明温度持续升高对植被产生负效应。各植被指标的方差分析都未达到显著水平,说明短期增温对该植被影响并不显著。
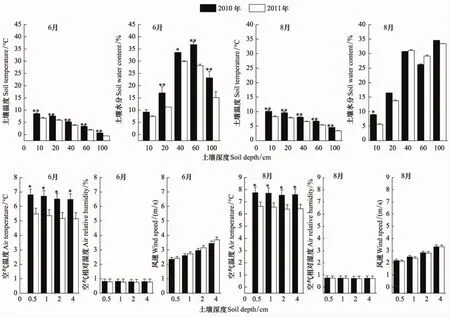
图5 非实验样地环境因子1a后的变化Fig.5 Variation of environment factors in non-experiment plots after one year

图6 增温样地不同处理下温度的变化趋势Fig.6 Changing trend of temperature in different treatments of experimental warming plots
3 讨论
3.1 高寒植被生物量对增温的响应
温度控制着生态系统中许多生物化学反应速率,且几乎影响所有生物学过程[15-16]。温度升高在一定程度上满足了植物对热量的需求,但也改变了植物群落的小气候环境,从而通过多种途径直接或间接影响植物的生长发育及生物量生产[11,17]。在本研究中,增温对高寒植被的影响在不同月份较不一致,总体来说,植被高度盖度和地上-地下生物量随增温有增加趋势 (T0—T1),但温度持续升高会对植被产生负面影响 (T1—T2);各植被指标的方差分析都未达到显著水平,得到短期增温对该植被影响并不显著的结论。在生物量生产对增温响应的研究上,不同学者得到的结论不尽相同:
(1)增温可通过降低土壤含水量或增加植物呼吸作用减少植物生物量生产。Melillo等[18]认为,增温后土壤含水量减少或植物呼吸作用增强,都能导致植物净初级生产力下降。Boeck等[19]的研究结果也显示,由于增温导致土壤含水量减少,地上和地下生量都明显下降,其中地上生物量下降了18%,地下根系生物量下降了23%。

图7 增温样地不同处理下水分的变化趋势Fig.7 Changing trend of water content in different treatments of experimental warming plots

图8 各月份不同处理下植被指标的变化趋势Fig.8 Changing trend of vegetation indexes in different treatments of different months
(2)增温可通过提高新陈代谢增加植物的光合能力或通过较高的分解作用增强植物对矿物营养的吸收,从而增加植物生物量生产。研究表明,温度升高能提高极地和高山地区植物的营养生长,促进该区植物的生理活动和表现,使生物量增加[20-21]。对于大多数温寒带和北方树种而言,在水分和养分充足的条件下,增温也会促进植物生物量积累[22]。然而,羊留冬等[23]的研究却表明,增温在一定程度上降低了峨眉冷杉幼苗对养分的利用效率,使幼苗的生物量降低了18.97%,认为增温对幼苗生长和生物量积累具有明显的限制作用,对叶片生长的阻碍作用尤为突出。

表2 各植被指标在不同增温处理间的差值百分比(平均值±标准误)* /%Table2 Difference percentage of vegetation indexes between different warming treatments(Mean±SE)
(3)由于增温持续时间不同,增温对植物生物量的影响差异较大。Zhang等[24]和周华坤等[13]通过1a的增温试验认为,在短期增温条件下群落的总生物量变化不明显。而李英年等[12]通过5a的增温试验研究表明,在模拟增温初期生物量增加,但增温5a后生物量反而下降。杨兵等[25]通过65个月的增温试验研究显示,增温对岷江冷杉幼苗的茎、侧枝、叶和总生物量具有显著的促进作用,但对根生物量没有显著影响,认为长期增温能显著促进岷江冷杉幼苗的生长和物质积累,改变生物量分配格局,促使叶片物质向茎转移,降低光合物质投入。
(4)不同的增温幅度对植物生物量的影响也不一样。李娜等[26]研究表明,小幅度增温使高寒草甸 OTC1内0—5 cm根系层的生物量增加,地上和地下5—20 cm根系层生物量分配比例减少,但变化均不显著;大幅度增温处理后,由于受到水分条件的限制更明显,OTC2内地上生物量分配比例减小,地下生物量开始向着深层土壤的根系层转移,但统计检验也不显著。在本研究中发现,增温后0—40 cm内的土壤水分较少蒸发到空气中,而是大部分下移到土壤深层,且T2处理下的下移幅度大于T1,这样就可能使植物根系生物量向深层转移。同时本研究也得到,温度持续升高对植被产生负效应(T1—T2),但也未达到显著水平。因此,增温对植物生物量生产的影响较为复杂,有正效应,也有负效应,并受增温持续时间和增温幅度限制。
3.2 高寒植被的生长模式
异速生长规律描述生物的个体大小和其它属性之间的非线性数量关系,通常以幂函数形式表示,它可以表示生物体的两个不同器官大小或不同属性之间的相关关系[27]。West等[28-30]提出的分形分配网络模型从养分和水分高效输导的角度解释了生物的各种异速生长关系。随后,Enquist等[31]又发展了异速生长理论,提出等速生长理论。本研究得到高寒草甸植被地上部分和地下部分表现出不同的生长模式,地上部分近似等速生长(幂指数为1.0111),地下部分却表现为异速生长 (幂指数为0.4585),但整体上呈现异速生长 (幂指数为0.4732)。Mokahy等[32]从全球尺度上研究了草地地下-地上生物量的关系,发现二者存在弱的幂指数关系(R2=0.12,P=0.05)。Yang等[33-34]从群落水平上研究了中国草地地下-地上生物量的分配关系,结果表明二者符合极显著的幂指数函数关系(R2=0.56,P<0.001),且经对数转换后线性关系的斜率范围为0.93—1.1,平均1.01,其中高寒草地的斜率为0.94,说明在群落水平上中国草地/青藏高寒草地地上-地下生物量分配符合等速生长理论。王亮等[35]从植物个体水平上研究了中国草地地下-地上生物量分配关系,得到的结论并不支持等速生长假说,且青藏高寒草地植物个体地上生物量与地下生物量相关生长关系的斜率 (0.71)显著低于内蒙温带草地植物(0.84)。在本研究中,青藏高寒草甸植被地上生物量与地下生物量也存在极显著的幂指数函数关系 (R2=0.38,P<0.001),但经对数转换后线性关系的斜率为0.68,符合异速生长理论。本研究和王亮等[35]的研究并不支持等速生长理论,可能与研究区植被的生长特点有关。青藏高寒草地植物的分形结构并不像木本植物那样清楚,许多多年生草本物种为莲座状叶基生植物,其茎主要是繁殖器官的支持结构,而非起到向叶运输营养的通道作用;地下部分也不都是吸收营养和水分的器官,它们常常异化出具有储藏或者其他功能的结构,如块茎、块根、地下茎等[35]。所以,很多高寒草地植物不能完全满足 Enquist等[31]人的理论假设,特别是关于植物茎长度与根长度大致按比例增长的假设。本研究还得到高寒草甸植被地上部分和地下部分表现出不同的生长模式,这可能与地上部分和地下部分所处环境差异较大有关,如地气温差。在本研究中,3种增温处理下20 cm深度土壤温度和20 cm高度空气温度的差值分别为1.16℃、2.17℃、2.9℃(数值为6、7、8月的平均值),且随增温幅度呈递增趋势,其中T0处理为对照组,可以反映自然状态。因此,青藏高原高寒草甸夏季的地气温差约为1.16℃,但在气候变暖的背景下,该地气温差有增大趋势。张文纲等[36]认为,青藏高原冬季地气温差很小,夏季地气温差最大。王澄海等[37]的研究也表明,青藏高原地区月地气温差从1月开始增大,到6月达到最大值,平均为1.3℃。本研究得到的高原夏季地气温差略小于王澄海等[37]人的结论,是因为地气温差在7月之后逐渐减小,到12月达到全年的最小值。
3.3 根系采样的误差分析
在本研究中,根系采集时间选择夏季进行,此时植被根系大多具有活性,然后从根系的颜色和柔韧性两方面对活根和死根进行了鉴别,但结果显示地下生物量比Yang等[33-34]和王亮等[35]的研究大,这可能与采样尺度、植被类型及环境因素等有关。王亮等[35]研究的个体数据采样点和群落水平采样点都是内蒙古温带草地及青藏高寒草地的典型植被样地,地理位置和采样时间并不完全一致,可能会存在小环境的差别。而本研究只选择高寒草甸,且样地布置位于同一生境,小环境的影响可以忽略。Yang等[33-34]的研究能够很好的反映中国草地地下-地上生物量比(R/S),但由于采样尺度、放牧干扰及植物物候的影响,使R/S的估测仍具有不确定性。本实验样地设在植被分布均匀、地势较为平坦且未受放牧、鼠兔啃食等干扰的地区,并用铁丝网将实验样地围栏,于植被生长季进行根系采集,但得到的根系生物量仍具有较大差异。因此,根系采集的误差不仅受环境因子、生态类型的影响,还受采样尺度、采样方法及采样时间的限制。王亮等[35]认为虽然通过颜色等方法区分了活根和死根,但由于草地群落中植物的种类众多,根的颜色、形态多样,使区分活根和死根的难度很大,而地下部分可能被高估。因此,今后需要探索出更准确、更便捷的方法对根系活性进行鉴定。
4 结论
4.1 青藏高原高寒草甸夏季植被特征
夏季植被高度与地下生物量、总生物量关系不显著,但对地上生物量影响较大,盖度对地下生物量和总生物量影响都较大。在植被生长过程中,地上部分与地下部分密切相关,植被在将能量分配给地上茎叶的同时也分配到地下根系。然而,由于地上部分和地下部分所处环境差异较大(如地气温差)而表现出不同的生长模式,地上部分近似等速生长,地下部分则表现为异速生长,但植被整体呈现异速生长。高寒草甸植被根系更新较慢,使地下生物量在1a之后变化不显著;地上生物量在6月份对环境较地下生物量敏感,但在8月份敏感性减弱,使生物量年际变化较大。1a之后植被地上生物量和地下生物量均呈减小趋势,这与土壤温度、土壤水分及空气温度的显著减小密切相关,并且地上生物量较地下生物量对温度和水分更为敏感。
4.2 青藏高原高寒草甸环境与植被对增温的短期响应
红外辐射器在高寒草甸的增温度效果较好。空气-地表-土壤温度都随增温幅度增强而增加,并对0—40 cm深度土壤温度产生较大影响。增温对温度的影响随土层加深和高度增加而减弱,对土壤水分的影响随土层加深而增强。增温促使0—40 cm深度土壤水分大部分下移至深层,并在100 cm深度处出现显著差异,因此增温促进0—40 cm深度土壤水分减少,增加40—100 cm深度土壤水分。增温对植被的影响在不同月份较不一致,但总体来说,增温对植被产生正效应,其中植被高度和地上生物量随增温有增加趋势,盖度和地下生物量在前期有增加趋势,后期增加趋势减弱。就植被在T1—T2的变化趋势而言,温度持续升高会对植被产生负效应。各植被指标的方差分析都未达到显著水平,表明短期增温对该植被影响并不显著。
最后应说明的是本研究中实验样地仅获得1a的数据,很难作出长期预测,但仍可以看出增温在短期内对青藏高原高寒草甸土壤温度、土壤水分以及植被的高度、盖度、地上生物量、地下生物量均产生了一定影响。致谢:感谢Becky Sherry、周旭辉、李锋瑞教授和邵锋副教授对本文写作的帮助;感谢顾梦鹤、彭飞、尤全刚、陈勇在实验过程和数据处理中给予的帮助。
[1] Oreskes N.The scientific consensus on climate change.Science,2004,306(5702):1686-1686.
[2] Intergovernmental Panel on Climate Change(IPCC).The Physical Science Basis.The Fourth Assessment Report of Working Group,2007.http://www.ipcc.ch/.Cited 14 May 2007.
[3] Thomas C D,Cameron A,Green R E,Bakkenes M,Beaumont L J,Collingham Y C,Erasmus B F N,Siqueira M F,Grainger A,Hannah L,Hughes L,Huntley B,Jaarsveld A S,Midgley GF,Miles L,Ortega-Huerta M A,Peterson A T,Phillips OL,Williams SE.Extinction risk from climate change.Nature,2004,427(6970):145-148.
[4] Goulden M L,Wofsy SC,Harden JW,Trumbore SE,Crill P M,Gower ST,Fries T,Daube B C,Fan SM,Sutton D J,Bazzaz A,Munger J W.Sensitivity of boreal forest carbon balance to soil thaw.Science,1998,279(5348):214-217.
[5] Hall C A S,Ekdahl C A,Wartenburg D E.A fifteen-year record of the biotic metabolism in the Northern Hemisphere.Nature,1975,255(5504):136-138.
[6] Keeling CD,China JF S,Whorf T P.Increased activity of northern vegetation inferred from atmospheric CO2measurements.Nature,1996,382(6587):146-149.
[7] Grabherr G,Gottfried M,Pauli H.Climate effects on mountain plants.Nature,1994,369(6480):448-450.
[8] Yang Y H,Piao SL.Variations in grassland vegetation cover in relation toclimatic factors on the Tibetan Plateau.Journal of Plant Ecology,2006,30(1):1-8.
[9] Yin H J,Lai T,Cheng X Y,Jiang X M,Liu Q.Warming effects on growth and physiology of seedling of Betula albo-sinensis and Abiesfaxoniana under two contrasting light conditions in subalpine coniferous forest of Western Sichuan,China.Journal of Plant Ecology,2008,32(5):1072-1083.
[10] Wang M,Li Y,Bai X Z,Huang RQ.The impact of global warming on vegetation resources in the hinterland of the Qinghai-Tibet Plateau.Journal of Natural Resources,2004,19(3):331-336.
[11] Shi F S,Wu N,Luo P.Effect of temperature enhancement on community structure and biomass of subalpine meadow in Northwestern Sichuan.Acta Ecologica Sinica,2008,28(11):5286-5293.
[12] Li Y N,Zhao L,Zhao Q X,Zhou H K.Effects of a 5-years mimic Temperature Increase to the structure and productivity of Kobresia humilis meadow.Acta Agrestia Sinica,2004,12(3):236-239.
[13] Zhou H K,Zhou X M,Zhao X Q.A preliminary study of the influence of simulated greenhouse effect on a Kobresia humilis meadow.Acta Phytoecologica Sinica,2000,24(5):547-553.
[14] Zhao X Q.Alpine meadow ecosystem and global climate change.Beijing:Science Press,2009:1-32.
[15] Xu Z F,Hu T X,Zhang Y B,Xian JR,Wang K Y.Freezing damage in early spring induced by simulated global warming:a case study in Abies faxoniana.Acta Ecologica Sinica,2009,29(11):6275-6280.
[16] Xu Z F,Hu T X,Zhang L,Zhang Y B,Xian JR,Wang K Y.Short-term gas exchange responses of Betula utilis to simulated global warming in a timber-line ecotone,eastern Tibetan Plateau,China.Chinese Journal of Plant Ecology,2010,34(3):263-270.
[17] Zhang LR,Niu H S,Wang S P,Li Y N,Zhao X Q.Effects of temperature increase and grazing on stomatal density and length of four alpine Kobresia meadow species,Qinghai-Tibetan Plateau.Acta Ecologica Sinica,2010,30(24):6961-6969.
[18] Melillo J M,McGuire A D,Kicklighter D W,Moore B,Vorosmarty C J,Schloss A L.Global climate change and terrestrial net primary production.Nature,1993,363(6426):234-240.
[19] De Boeck H J,Lemmens C M H M,Gielen B,Bossuyt H,Malchair S,Carnol M,Merckx R,Ceulemans R,Nijs I.Combined effects of climate warming and plant diversity loss on above-and below-ground grassland productivity.Environmental and Experimental Botany,2007,60(1):95-104.
[20] Wada N,Shimoni M,Miyamoto M,Kojima S.Warming effects on shoot developmental growth and biomass production in sympatric evergreen alpine dwarf shrubs Empetrum nigrum and Loiseleuria procumbens.Ecological Research,2002,17(1):125-132.
[21] Sandvik SM,Heegaard E,Elven R,Vandvik V.Responses of alpine snowbed vegetation to long-term experimental warming.Ecoscience,2004,11(2):150-159.
[22] Danby R K,Hik D S.Responses of white spruce(Picea glauca)to experimental warming at a subarctic alpine treeline.Global Change Biology,2007,13(2):437-451.
[23] Yang L D,Yang Y,Wang G X,Guo J Y,Yang Y.Short-term effects of warming on growth and stoichiometrical characteristics of Abies fabiri(Mast.)Craib seedling in Gongga mountain.Acta Ecologica Sinica,2011,31(13):3668-3676.
[24] Zhang Y Q,Welker JM.Tibetan alpine tundra responses to simulated changes in climate:aboveground biomass and community responses.Arctic and Alpine Research,1996,28(2):203-209.
[25] Yang B,Wang JC,Zhang Y B.Effect of long-term warming on growth and biomass allocation of Abies faxoniana seedlings.Acta Ecologica Sinica,2010,30(21):5994-6000.
[26] Li N,Wang G X,Yang Y,Gao Y H,Liu L A,Liu G S.Short-term effects of temperature enhancement on community structure and biomass of alpine meadow in the Qinghai-Tibet Plateau.Acta Ecologica Sinica,2011,31(4):895-905.
[27] Han W X,Fang JY.Review on the mechanism models of allometric scaling laws:3/4 VS.2/3 power.Journal of Plant Ecology,2008,32(4):951-960.
[28] West G B,Brown J H,Enquist B J.A general model for the origin of allometric scaling laws in biology.Science,1997,276(5309):122-126.
[29] West G B,Brown J H,Enquist B J.A general model for the structure and allometry of plant vascular systems.Nature,1999,400(6745):664-667.
[30] West G B,Brown J H,Enquist B J.The fourth dimension of life:fractal geometry and allometric scaling of organisms.Science,1999,284(5420):1677-1679.
[31] Enquist B J,Niklas K J.Global allocation rules for patterns of biomass partitioning in seed plants.Science,2002,295(5559):1517-1520.
[32] Mokany K,Raison R J,Prokushkin A S.Critical analysis of root:shoot ratios in terrestrial biomes.Global Change Biology,2006,12(1):84-96.
[33] Yang Y H,Fang JY,Ji C J,Han W X.Above-and belowground biomass allocation in Tibetan grasslands.Journal of Vegetation Science,2009,20(1):177-184.
[34] Yang Y H,Fang JY,Ma WH,Guo D L,Mohammat A.Large-scale pattern of biomass partitioning across China's grasslands.Global Ecology and Biogeography,2010,19(2):268-277.
[35] Wang L,Niu K C,Yang Y H,Zhou P.Patterns of above-and belowground biomass allocation in China's grasslands:evidence from individual-level observations.Science China Life Sciences,2010,53(7):851-857.
[36] Zhang W G,Li SX,Wu T H,Pang Q Q.Changes of the differences between ground and air temperature over the Qinghai-Xizang Plateau.Acta Geographica Sinica,2006,61(9):899-910.
[37] Wang C H,Cui Y.Characteristics of the difference of temperature between surface and atmosphere over the Tibetan Plateau in the early stage of East Asian summer monsoon onset.Climatic and Environmental Research,2011,16(5):586-596.
参考文献:
[8] 杨元合,朴世龙.青藏高原草地植被覆盖变化及其与气候因子的关系.植物生态学报,2006,30(1):1-8.
[9] 尹华军,赖挺,程新颖,蒋先敏,刘庆.增温对川西亚高山针叶林内不同光环境下红桦和岷江冷杉幼苗生长和生理的影响.植物生态学报,2008,32(5):1072-1083.
[10] 王谋,李勇,白宪洲,黄润秋.全球变暖对青藏高原腹地草地资源的影响.自然资源学报,2004,19(3):331-336.
[11] 石福孙,吴宁,罗鹏.川西北亚高山草甸植物群落结构及生物量对温度升高的响应.生态学报,2008,28(11):5286-5293.
[12] 李英年,赵亮,赵新全,周华坤.5年模拟增温后矮嵩草草甸群落结构及生产量的变化.草地学报,2004,12(3):236-239.
[13] 周华坤,周兴民,赵新全.模拟增温效应对矮篙草草甸影响的初步研究.植物生态学报,2000,24(5):547-553.
[14] 赵新全.高寒草甸生态系统与全球变化.北京:科学出版社,2009:1-32.
[15] 徐振锋,胡庭兴,张远彬,鲜骏仁,王开运.模拟增温引发的早春冻害:以岷江冷杉为例.生态学报,2009,29(11):6275-6280.
[16] 徐振锋,胡庭兴,张力,张远彬,鲜骏仁,王开运.青藏高原东缘林线交错带糙皮桦幼苗光合特性对模拟增温的短期响应.植物生态学报,2010,34(3):263-270.
[17] 张立荣,牛海山,汪诗平,李英年,赵新全.增温与放牧对矮嵩草草甸4种植物气孔密度和气孔长度的影响.生态学报,2010,30(24):6961-6969.
[23] 羊留冬,杨燕,王根绪,郭剑英,杨阳.短期增温对贡嘎山峨眉冷杉幼苗生长及其CNP化学计量学特征的影响.生态学 报,2011,31(13):3668-3676.
[25] 杨兵,王进闯,张远彬.长期模拟增温对岷江冷杉幼苗生长与生物量分配的影响.生态学报,2010,30(21):5994-6000.
[26] 李娜,王根绪,杨燕,高永恒,柳林安,刘光生.短期增温对青藏高原高寒草甸植物群落结构和生物量的影响.生态学报,2011,31(4):895-905.
[27] 韩文轩,方精云.幂指数异速生长机制模型综述.植物生态学报,2008,32(4):951-960.
[35] 王亮,牛克昌,杨元合,周鹏.中国草地生物量地上-地下分配格局:基于个体水平的研究.中国科学:生命科学,2010,40(7):642-649.
[36] 张文纲,李述训,吴通华,庞强强.青藏高原地气温差变化分析.地理学报,2006,61(9):899-910.
[37] 王澄海,崔洋.东亚夏季风建立前青藏高原地气温差变化特征.气候与环境研究,2011,16(5):586-596.
