IGF-Ⅱ、PCNA在子宫肌瘤患者诊断中的意义
2013-09-07叶英
叶 英
河南省商丘市第一人民医院妇产科,河南商丘 476100
子宫肌瘤又称子宫平滑肌瘤,是女性生殖器最常见的一种良性肿瘤。大多数患者发病初期无明显症状,子宫肌瘤的发病机制可能与体内雌激素水平过高,长期受雌激素刺激有关[1]。子宫肌瘤发病率占女性生殖器官良性肿瘤的一半以上,子宫肌瘤的发生发展与年龄、遗传、激素和免疫水平存在密切关系。2008年针对全国21个主要省份子宫肌瘤发病率的调查结果显示我国25~30岁女性子宫肌瘤发病率已超过3%,我国成为子宫肌瘤发病率最高的国家。既往医学认为子宫肌瘤属于良性肿瘤,其发生与细胞遗传无关,但随着研究的进一步加深,子宫肌瘤与机体染色体异常、基因畸形存在紧密关联。Vikhlyera EM[2]等研究表明子宫肌瘤的发生具有“家庭聚集现象”,子宫肌瘤患者的亲代肌瘤发生率接近30%,是正常人群的2倍。越来越多研究表明,子宫肌瘤的发生发展与细胞有丝分裂有关,而IGF-Ⅱ、PCNA是促进细胞有丝分裂的重要因子,笔者为探讨IGF-Ⅱ、PCNA在子宫肌瘤诊断中的临床意义,通过对80例患者子宫平滑肌组织进行观察,具体报道如下:
1 资料与方法
1.1 一般资料
选择本院2008年1月~2012年3月40例病理证实子宫肌瘤患者为观察组,年龄 33~58 岁,平均(45±3.4)岁,取其子宫肌瘤组织、肌瘤旁平滑肌组织进行观察,同期40例病理证实卵巢良性肿瘤患者设为对照组,年龄32~59岁,平均(46±2.8)岁,取其子宫平滑肌组织进行观察。所有入组患者均排除恶性肿瘤史、类固醇使用史(3个月内)。两组患者一般情况比较,差异无统计学意义(P>0.05),具有可比性。
1.2 检测方法
1.2.1 标本制作 将组织切取厚度约为0.2~0.3 cm,大小1.5 cm×1.5 cm×0.3 cm,用4%多聚甲醛溶液固定48 h。梯度酒精脱水,二甲苯透明,然后入熔解的石蜡浸透,每次30 min,共3次,备包埋。将包埋好组织蜡块切成5 μm的切片,进行免疫组化(IHC)进行检测,抗体使用兔抗人IGF-Ⅱ多克隆抗体(厦门鹭隆生物工程有限公司),鼠抗人增殖细胞核抗原单克隆抗体(武汉生工生物技术有限公司),操作按照说明书进行。
1.2.2 结果判定 IGF-Ⅱ阳性表达是细胞浆出现棕色颗粒;PCNA阳性表达是细胞核出现棕色颗粒;每张切片随机选择5个视野,统计着色细胞与为着色细胞的比值(阳性率)[3]。
1.3 统计学处理
采用SPSS 18.0对所得数据进行统计分析,组间显著性比较采用t检验;计数资料以百分率表示,组间显著性比较采用卡方检验,以P<0.05为差异有统计学意义。
2 结果
观察组IGF-Ⅱ、PCNA表达水平与对照组相比,差异有统计学意义(P<0.05),观察组高于对照组。具体见表1。IGF-Ⅱ与PCNA呈正相关关系,具体见表2。
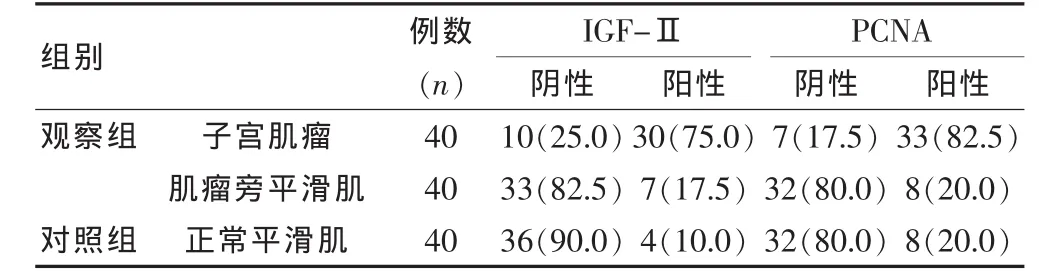
表1 IGF-Ⅱ、PCNA在子宫肌瘤组织、肌瘤旁平滑肌组织以及正常平滑肌组织中表达[n(%)]

表2 子宫肌瘤组织中IGF-Ⅱ与PCNA的相关性
3 讨论
胰岛素样生长因子(IGFs)含有IGFⅠ和IGF-Ⅱ两个类别,均与细胞的增殖分化、凋亡转化有密切联系,IGF-Ⅱ是与胰岛素具有相似结构的氨基酸单链多肽,IGF-Ⅱ和受体IGF-ⅡR结合后介导细胞的有丝分裂,促进细胞的增殖,促进细胞中DNA、蛋白质、多糖的合成,对胚胎的生长发育起到良性刺激作用。正常生理条件下,IGF-Ⅱ的结合受体只在胚胎具有活性,出生后IGF-Ⅱ受体将处于沉默状态。肿瘤发生后,IGF-Ⅱ受体被激活,与IGF-Ⅱ重新结合后促使IGF-Ⅱ活性增强[4]。IGF-Ⅱ属于肿瘤组织的自分泌生长因子,因此在肿瘤组织中有高表达。雌激素在子宫肌瘤的发生发展中具主要介导作用,子宫肌瘤属于激素依赖型肿瘤,而生长激素、胎盘生乳素等内分泌激素也是子宫肌瘤形成的催化剂,子宫肌瘤的异常分泌导致胰岛素样生长因子IGF浓度增多而进一步加速子宫肌瘤细胞的有丝分裂,故内分泌失调是形成子宫肌瘤的重要危险因素。Li SR等[5]通过研究发现,IGF-Ⅱ的基因印记丢失导致其在消化道肿瘤中出现高表达;BYRNE等也通过细胞实验验证IGF-Ⅱ介导肿瘤发生发展的机制与血管新生有关。本研究结果显示IGFⅡ在子宫肌瘤、肌瘤旁平滑肌、正常子宫平滑肌的表达水平有差异存在,IGFⅡ在子宫肌瘤组织中的表达较其他组织上调,笔者认为这种结果存在的原因有以下几种:(1)机体通过自分泌系统产生IGFⅡ,细胞膜上的IGF受体与之相结合后激活体内酪氨酸激酶(PTK),PTK能催化多种底物蛋白质酪氨酸残基磷酸化,作用于细胞信号转导通路,促进细胞生长、增殖、分化。BYRNE AT等[6]发现敲除胎鼠IGFⅡ基因后胎鼠胚胎停止发育;将肝卵细胞株植入加有IGF-Ⅱ的培养基中,肝卵细胞株增生速度增快,在培养基中注入IGF-Ⅱ受体阻滞剂后,细胞增生减缓甚至停止。(2)凋亡系统是正常机体清除死亡细胞、异常细胞的途径,避免肿瘤的发生发展,IGF-Ⅱ可协助突变细胞逃逸凋亡机制的清理而发展为肿瘤,IGF-Ⅱ作用于Fas基因,导致其表达下调而达到抗凋亡的目的。(3)IGF-ⅡR与Ras、c-fos等信号通路相关,子宫肌瘤发生时,癌基因的过度表达刺激了信号通路,使IGF-ⅡR的活性上调,导致了IGF-Ⅱ表达的增高[7-10]。本研究结果表明,40例子宫肌瘤标本中IGF-Ⅱ阳性表达率高达60%,远远高于肌瘤旁平滑肌、正常子宫平滑肌的阳性表达率,故本文认为IGF-Ⅱ可作为子宫肌瘤生长发展的一种指标。
PCNA于1978年由Miyachi首次从红斑狼疮患者血清中分离发现的,由于其属于增殖性细胞而得名。PCNA是真核细胞DNA聚合酶的推动因子,能与多种蛋白质相结合,对细胞核组织内的DNA的复制起到辅助作用,细胞周期中蛋白cyclin、激酶CDK以及CKI的抑制蛋白CKI之间具有相互调节作用,可形成不同的复合体,相互协作调控细胞的周期,PCNA同时是一种功能转换因子,像纽带一样将cyclin、CDK、CKI与相应的底物连接起来,促进了其磷酸化的进程,通过对上述因子的调控实验对细胞凋亡周期进行作用[11-14]。本研究结果显示:PCNA在子宫肌瘤组织、肌瘤旁平滑肌组织以及正常子宫平滑肌组织中的阳性具有显著差异,子宫肌瘤的阳性表达率远高于其他组织。笔者通过本文证实IGF与PCNA存在正相关关系,笔者认为IGF通过促进PCNA的表达而使子宫肌瘤组织处于增殖状态,PCNA的表达量直接影响细胞的活性。陈文雪等[15]在研究中指出,子宫肌瘤组织PCNA阳性指数为(0.27±0.04),远远高于正常子宫平滑肌的PCNA阳性指数。这一数据与本研究的研究结果相符。本研究进一步发现子宫肌瘤的PCNA与肌瘤旁平滑肌的表达量亦存在差异。故笔者认为PCNA可作为评价细胞增殖状态的指标。PCNA与肿瘤发生发展、分级、分期、预后、复发和转移等各个方面具有密切相关性
总之,通过对IGF-Ⅱ、PCNA的测定,了解子宫肌瘤的发展程度,对肿瘤的预防及治疗亦有重要意义,降低IGF-Ⅱ、PCNA的表达水平可能可以成为治疗肿瘤的新靶向方案。
[1]Mathur SP,Mathur RS,Gray EA,et al.Serum vascular endothelial growth factor-C (VEGF-C)as a specific biomarker for advancedcervical cancer: relationship to insulin-like growth factor II (IGF-II ),IGF binding protein 3 (IGF-BP3)and VEGF-B[J].GynecolOnco,2005,98:467-483.
[2]Vikhlyera EM,WU YP.The relationship between IGF-2 and breast cancer[J].Journal of Medical Molecular Biology,2006,3(4):309-312.
[3]齐法莲,徐军,杜秀敏,等.五种恶性肿瘤血清IGF-II水平及意义[J].放射免疫学杂志,2002,15(5):275-277.
[4]任玉萍,吴毅平.胰岛素样生长因子2与乳腺癌[J].医学分子生物学杂志,2009,3(4):309-312.
[5]Li SR,Chungfar Jeremy NG,Ayan Banerjea,et al.Bustin differential expression patterns of the insulin-like growthfactor 2 fene in human colorectal cancer[J].Tumor Biol,2010,25:62-68.
[6]Byrne AT,Southgate J,Brison DR,et al.Effects of insulin-like growth factors I and II on tumour-necrosis-factoralpha-induced apoptosis in early murine embryos[J].Reprod Fertil Dev,2009,14:79-83.
[7]Katayama K,Ohtsuka R,Takai H,et al.Expression of p53 and its transcription target genes mRNAs in the ethylnitrosourea-induced apoptosis and cell cycle arrest in the fetal central nevous system[J].Histol Histopathol,2008,17(3):715-720
[8]Baek WK,Kim D,Jung N,et al.Increased expression of cyclinG1 in leiomyoma compared with normal myometrium[J].Am J Obstet Gynecol,2009,188(3):634-639
[9]Shimizu A,Nishida J,Ueoka Y,et al.Cyclin G contributes to G2/M arrest of cells in response to DNA damage[J].Biochem BiophysRes Commun,1998,242(3):529-533
[10]李莜梅,郑英.宫颈癌组织中cyclin E和细胞增殖核抗原检测[J].郑州大学学报,2009,39(3):468~470
[11]Yamauchi H,Katayama K,Ueno M,et al.Involvement of p53 inbeta-D-arabinofuranosylcytosine-induced rat fetal brain lesions[J].Neurotoxicol Teratol,2004,26(4):579-5862
[12]高伟,李连宏.IGF-2,Ki-67在乳腺癌中的表达及其意义[J].大连医科大学学报,2010,32(1):22-25.
[13]石殿鹏,李道堂,仲伟霞.食管癌中PCNA基因蛋白的表达及意义[J].中华中西医杂志,2011,2(9):779.
[14]Zhai YL,Kobayashi Y,Mori A,et al.Expression of steroid receptors,Ki-67,and p53 in uterine leiomyosarcomas[J].Int J Gynecol Pathol,2009,18:20-28.
[15]陈文雪,李彦群,吴小华,等.子宫肌瘤细胞凋亡及增殖状况研究[J].中国实用妇科与产科杂志,2003,19(10):603-605.
