ANGPTL4基因表达和血管生成与胃癌发展的关系
2013-09-07赵剑锋陈金坤林丽娟蔡清河郑龙志陈建新
赵剑锋 陈金坤▲ 林丽娟 蔡清河 郑龙志 陈建新
1.莆田学院附属医院普外科,福建莆田 351100;2.莆田学院附属医院胸外科,福建莆田 351100
胃癌是高发的消化道恶性肿瘤,并具有早期多发转移的生物学特性,肿瘤的进展与多种因素有关,由于高代谢状态促使其对血供需求剧增,而新生血管形成在肿瘤的生长、浸润、转移过程中起关键作用。血管生成素样蛋白4是一种新发现的血管生成相关因子,2002年被国际人类基因组织命名为ANGPTL4,其基因和蛋白具有与血管生成素相似的结构和功能[1]。近年来研究发现其广泛存在与内脏器官组织细胞中,与血管内皮细胞迁移、管状成形及血管重新分布有关[2-3]。本研究通过观察胃癌组织中ANGPTL4基因的表达及其与血管生成和肿瘤发展的关系,探讨其在胃癌发展中的作用,为临床早期预防提供参考。
1 资料与方法
1.1 一般资料
收集2011年2月~2012年2月本院行胃贲门癌手术治疗患者50例的病理组织标本为实验组,男28例,女22例,年龄 33~75 岁,平均(56.93±10.37)岁,术前均未经化疗、放疗或免疫治疗。病理检验证实均为腺癌,组织病理分级:低分化14例,中分化20例,高分化16例;临床分期按国际抗癌协会(UICC)TNM标准:Ⅰ期11例、Ⅱ期20例、Ⅲ期10例、Ⅳ期9例;淋巴结转移26例,无淋巴结转移24例;浸润浅肌层16例,浸润深肌层22例,浸润浆膜层12例。每例患者均选择肿瘤组织及手术切缘组织标本。另选择同期我院电子胃镜活检胃溃疡旁正常胃黏膜组织10例作为对照组,男6例,女4例,年龄 35~72岁,平均(55.86±10.45)岁。
1.2 试剂与仪器
人ANGPTL4单克隆抗体、鼠抗人CD34单克隆抗体、免疫组化试剂盒购自均购自北京中杉金桥生物技术有限公司;原位杂交预杂交液,NBT/BCIP,原位杂交5'端生物素标记ANGPTL4 mRNA探针购自上海瑞齐生物科技有限公司。美国雅培ThermoBrite S500型原位杂交仪,奥林巴斯FV1000激光共聚焦显微镜。
1.3 研究方法
1.3.1 原位杂交技术检测ANGPTL4 mRNA
标本切片常规进行脱蜡、梯度酒精脱水、H2O2预孵、蛋白酶消化,滴加20 μL预杂交液处理4 h,加入含ANGPTL4基因荧光标记探针、探针缓冲液、超纯水配制的混合液10 μL,置杂交仪中,于73℃变性5 min,37℃杂交12 h,洗脱液浸泡、洗涤,NBT/BCIP染色,避光显色2~3 h[4]。以阳性结果胃癌组织作为阳性对照,不含探针标本为阴性对照。
1.3.2 免疫组化染色法检测微血管密度(MVD)
标本切片脱蜡、H2O2预孵、漂洗、高温高压修复抗原,按照免疫组化试剂盒说明采用链霉素亲和素-生物素-过氧化物酶复合物技术(SABC)以CD34标记血管染色[5]。以试剂盒公司提供的阳性样本作为阳性对照,PBS替代一抗为阴性对照。
1.4 结果判定
ANGPTL 4 mRNA阳性判定:激光共聚焦显微镜观察杂交信号并进行计数,细胞质ANGPTL 4 mRNA信号于细胞质内呈浅黄色至棕黄色颗粒阳性,随机选取5个细胞数>200个的高倍视野,按染色强度及阳性细胞占比进行结果判定,染色强度由阴性~棕黄为0~3分;阳性细胞占比<10%为1分,10%~50%为2分,>50%为3分;后将两者得分相乘计算总分,总分≥3为阳性,<3为阴性。MVD阳性判定:染色呈棕色的1个内皮细胞或成群无官腔细胞簇均计为微血管,管径>50 μm及肌层较厚者不计为微血管,随机选取5个细胞数>200个的高倍视野计数微血管数,5个区域微血管计数均值作为MVD值。
1.5 统计学处理
采用SPSS 17.0统计学软件进行分析,计数资料采用卡方检验,计量资料以均数±标准差表示,两独立样本比较采用t检验,多样本比较采用F检验,两两比较采用q检验,等级资料相关性采用Spearman等级相关分析,两变量间直线相关性采用Pearson相关分析,P<0.05为差异有统计学意义。
2 结果
2.1 胃癌组织、癌旁组织和正常胃黏膜ANGPTL 4 mRNA表达及MVD计数
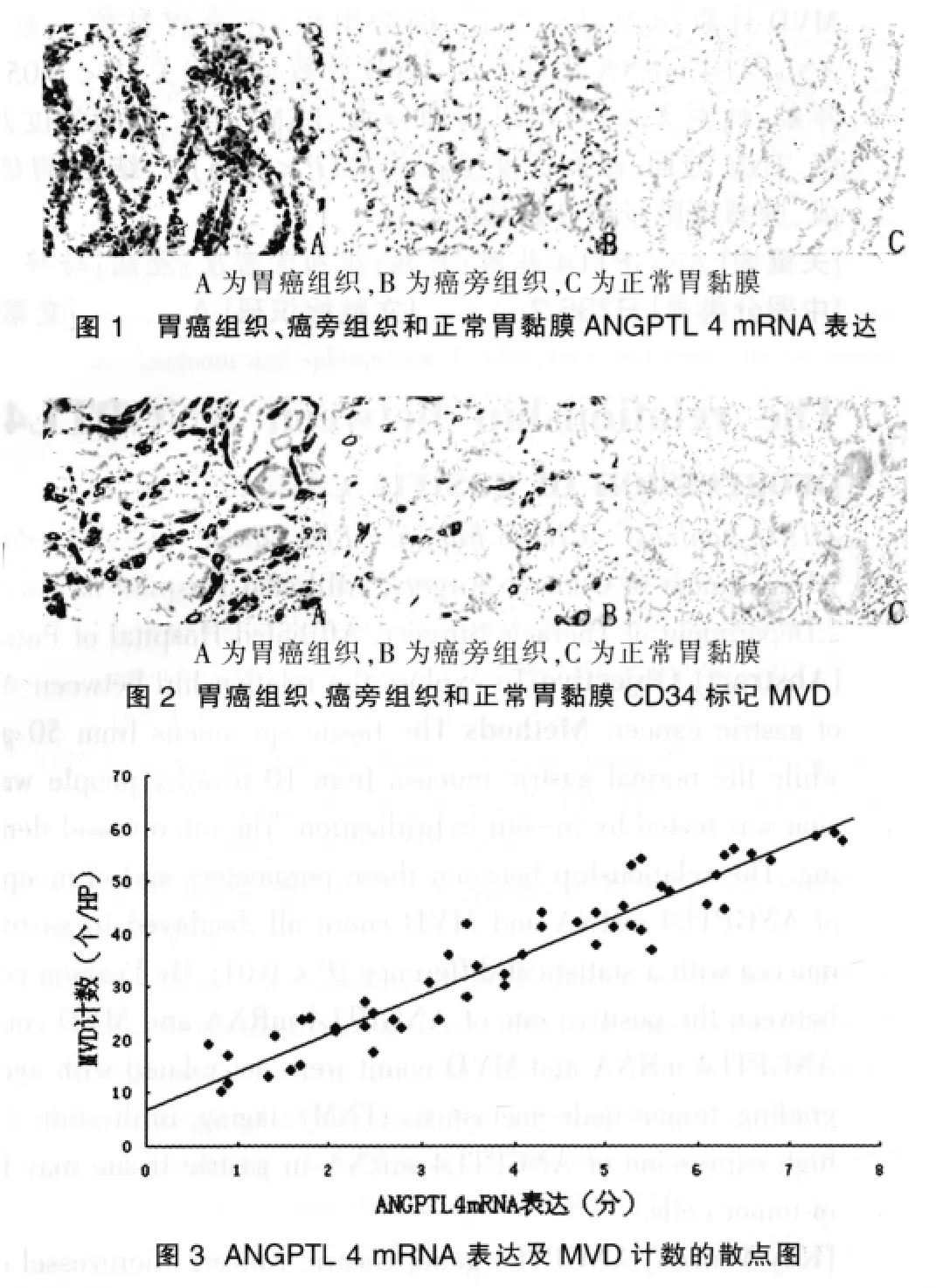
ANGPTL 4 mRNA在胃癌组织中高表达,癌旁组织中存在一定的阳性表达,而正常胃黏膜阳性率较低,阳性率为胃癌组织>癌旁组织>正常胃黏膜,差异有统计学意义(P<0.01)。MVD计数在胃癌组织中显著升高,为胃癌组织>癌旁组织>正常胃黏膜,差异有统计学意义(P<0.01)。见表 1,图 1、2。
2.2 ANGPTL 4 mRNA表达及MVD计数的关系
ANGPTL 4 mRNA表达强度与MVD计数之间呈一定的相关趋势(图3),经Pearson相关分析,两者呈正相关(r=0.63,P < 0.05)。
2.3 ANGPTL 4 mRNA表达与胃癌临床特征关系
胃癌组织中ANGPTL 4阳性表达率与MVD计数与年龄、性别无关,与组织病理分级、TNM分期、浸润深度及淋巴结转移密切相关(P<0.05),经Spearman等级相关分析ANGPTL 4阳性表达与组织病理分级、TNM分期、浸润深度呈正相关 (r=0.61,0.59,0.65,P < 0.05),MVD 计数与组织病理分级、TNM分期、浸润深度呈正相关(r=0.57,0.56,0.60,P < 0.05),见表 2。
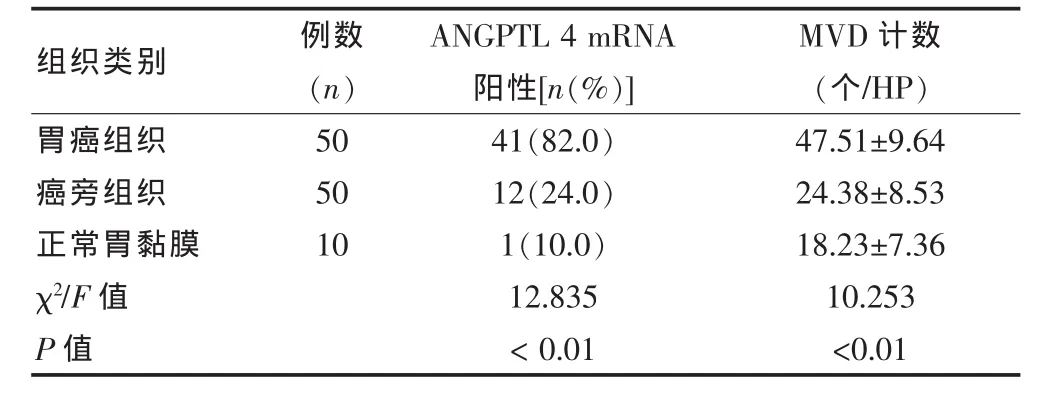
表1 胃癌组织、癌旁组织和正常胃黏膜ANGPTL 4 mRNA表达及MVD计数
3 讨论
ANGPTL 4是分泌型糖蛋白ANGPTL家族的一员,其主要表达于恶性肿瘤坏死病灶边缘[1-6],并且在体内、外环境中对恶性肿瘤的作用仍存在争论。韩杰等[7]通过体外转染检测,发现ANGPTL 4基因的表达对大肠癌细胞HT29的迁移及伪足形成有抑制作用。曾一元等[8]认为ANGPTL 4基因对肝癌Huh-7细胞体外增殖有抑制作用并抑制其裸鼠体内成瘤,但对MHCC-LM3细胞和MHCC-97L细胞的体外增殖有促进作用并促进其体裸鼠内成瘤。但其对血管内皮细胞的迁移、侵袭和管状成形的作用基本得到认同[9-10]。
本研究选取了50例胃腺癌组织标本进行ANGPTL 4 mRNA及MVD测定,结果显示ANGPTL 4 mRNA在胃癌组织中显著高表达,阳性率为82.0%,肿瘤手术切缘作为癌旁组织的标本中ANGPTL 4 mRNA存在阳性表达,但阳性率显著降低,而在正常胃黏膜对照标本中,其表达率较癌旁组织显著降低,三种组织类型中ANGPTL 4 mRNA阳性表达率之间差异有统计学意义。表明ANGPTL 4 mRNA在正常胃黏膜中阳性表达率较低,其存在和高表达与胃癌发展有关。而Klopper JP等[11]研究认为ANGPTL 4基因在胃癌MKN28和MKN74两个细胞系及原位胃癌组织中表达下降,与本研究的差异可能与胃癌组织学分类及标本所处肿瘤部位选择不同有关,并有待进一步研究证实。通过计数三种组织标本中的MVD结果显示,其在胃癌组织中计数显著升高,同时癌旁组织中计数也显著高于正常胃黏膜组织。进一步分析ANGPTL 4 mRNA表达强度与MVD计数的关系显示,两者呈现显著的正相关,MVD计数随则ANGPTL 4 mRNA表达增强而增多,ANGPTL 4 mRNA对微血管的增殖、形成有明显的促进作用,而微血管大大量增加为肿瘤细胞提供所需的血液供应,并为其进一步浸润侵袭,血液转移提供前提。因此可以想见ANGPTL 4 mRNA的高表达与胃癌肿瘤细胞的浸润、转移之间关系密切。
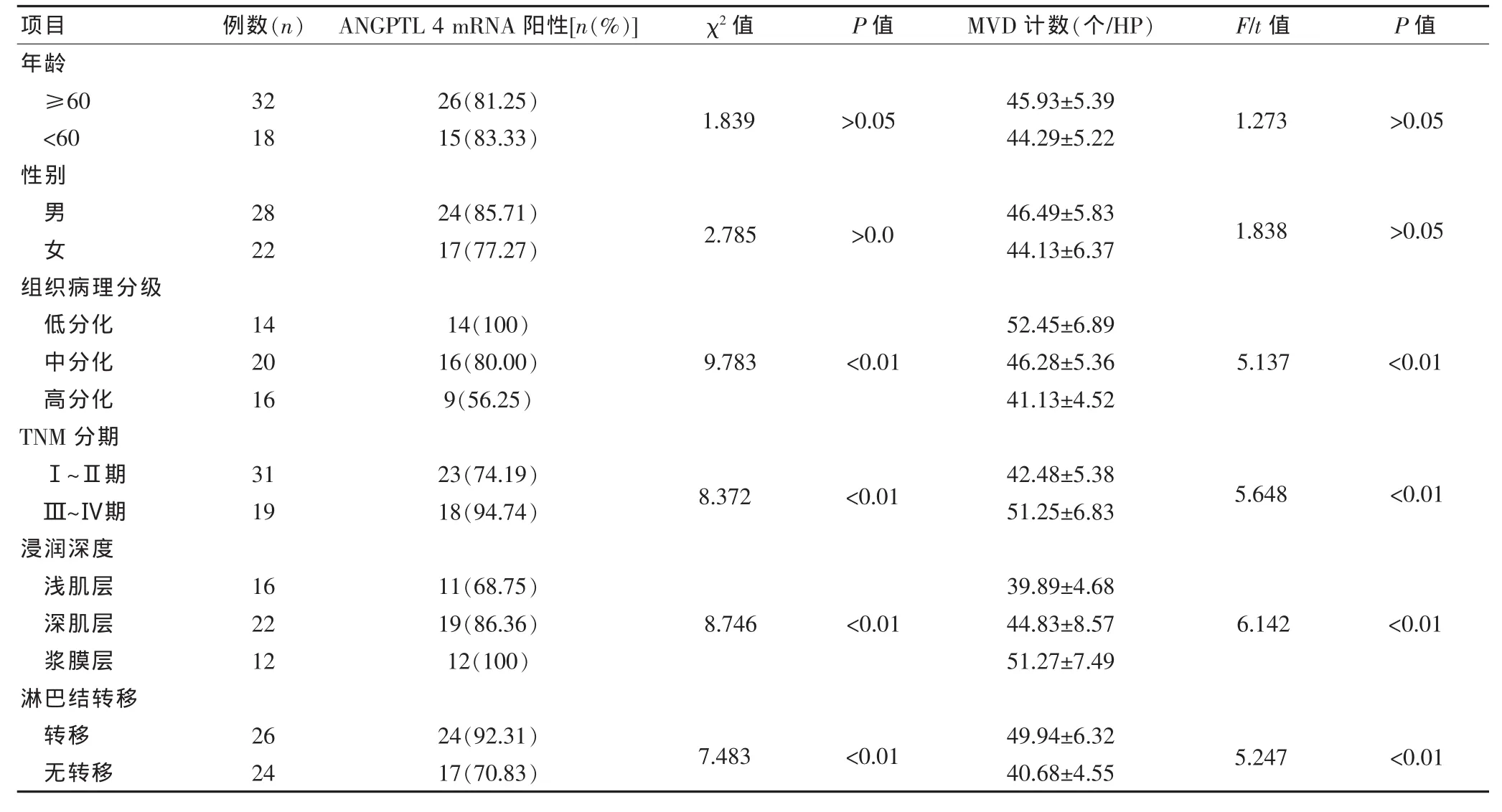
表2 ANGPTL 4 mRNA表达及MVD计数与胃癌临床特征关系
本研究通过对胃癌患者临床病理学特征与ANGPTL 4 mRNA表达的分析结果显示,在不同年龄和性别的胃癌患者胃癌组织中ANGPTL 4 mRNA表达无显著差异,但ANGPTL 4 mRNA表达则表现出与组织病理分级、TNM分期、浸润深度及淋巴结转移的密切相关性,低分化腺癌组织中ANGPTL 4 mRNA阳性率显著升高,并明显高于中分化和高分化腺癌组织,呈现与组织病理分级的正相关,表明恶性程度越高其ANGPTL 4 mRNA表达越强,其对血管生成的影响越明显以满足肿瘤细胞的增殖、生长所需供养[12-13]。胃癌细胞浸润深度体现了其侵袭性,而浸润至深肌层,甚至浆膜层的胃癌组织中ANGPTL 4 mRNA表达显著升高,表明ANGPTL 4可能对胃癌细胞迁移功能和伪足的形成有促进作用[14]。同时ANGPTL 4 mRNA的高表达也与淋巴结转移关系密切,其与胃癌多发转移有关,还可能促进微淋巴管内皮细胞增殖、管状形成[15]。其与临床TNM分期关系与以上结果相应,而对胃癌组织中MVD计数与临床病理学特征的关系分析显示,MVD计数与病理学特征的关系与ANGPTL 4相似。表明ANGPTL 4 mRNA在胃癌发展过程中起促进作用,可能是通过促进微血管生成来达到。
综上所述,ANGPTL 4在体内胃癌组织中的表达升高,其促使微血管通道形成的作用,对胃癌细胞的增殖、生长提供充足营养,促进胃癌细胞侵袭性,并为肿瘤转移提供途径通道。应进行动物体内、外实验以进一步明确其在胃癌发展中的作用机制和生物学特性。
[1]Nettleton JA,Volcik KA.Carbohydrate intake modifies associations between ANGPTL4(E40K) genotype and HDL-cholesterol concentrations in White men from the Atherosclerosis Risk in Communities(ARIC) study[J].Atherosclerosis,2009,203(1):214-220.
[2]Dutton S.Regulation of angiopoietin-like protein 4/fasting-induced adipose factor(Angptl4/FIAF) expression in mouse white adipose tissue and 3T3-L1 adipocytes[J].The British Journal of Nutrition,2008,100(1):18-26.
[3]Kaddatz K,Adhikary T,Finkernagel F.Transcriptional profiling identifies functional interactions of TGF beta and PPAR beta/delta signaling:synergistic induction of ANGPTL4 transcription[J].The Journal of Biological Chemistry,2010,285(38):29469-29479.
[4]王芳,邵琼,张旭.荧光原位杂交技术检测滑膜肉瘤SS18基因易位的诊断价值[J].中山大学学报(医学科学版),2012,33(2):251-254.
[5]郗彦凤,白文启,李静.免疫组织化学方法和荧光原位杂交技术检测胃癌组织中Her-2表达的比较[J].肿瘤研究与临床,2012,24(6):402-404.
[6]Staiger H,Machicao F,Werner R.Genetic variation within the ANGPTL4 gene is not associated with metabolic traits in white subjects at an increased risk for type 2 diabetes mellitus[J].Metabolism:Clinical and Experimental,2008,57(5):637-643.
[7]韩杰,胡晓彤,黄学锋.shRNA沉默ANGPTL4表达对大肠癌HT-29细胞的迁移能力的影响[J].南方医科大学学报,2011,31(9):1614-1618.
[8]曾一元,郝向芳,李红,等.ANGPTL4基因对不同肝癌细胞株生长的影响[J].肿瘤,2008,28(10):819-824.
[9]刘颖斌,李克强,王建伟,等.重组逆转录病毒载体介导人ANGPTL4基因的抗肝癌作用[J].中华普通外科杂志,2006,21(1):51-54.
[10]Li C.Not all angiopoietin-like proteins (Angptls) are created equal:insights from molecular, genetic, and pharmacological studies on the mechanism of LPL inhibition by Angptl3 and Angptl4[J].Current opinion in lipidology,2009,20(4):357-359.
[11]Klopper JP,Berenz A,Hays WR,et a1.In vivo and microarray analysis of rexinoid-responsive anaplastic thyroid carcinoma[J].Clin Cancer Res,2008,14(2):1589-596.
[12]GeorgiadiA,LichtensteinL,DegenhardtT.InductionofcardiacAngptl4 by dietary fatty acids is mediated by peroxisome proliferator-activated receptor beta/delta and protects against fatty acid-induced oxidative stress.[J].Circulation research,2010,106(11):1712-1721.
[13]Lu B,Moser A,Shigenaga J.The acute phase response stimulates the expression of angiopoietin like protein 4[J].Biochemical and Biophysical Research Communications,2010,391(4):1737-1741.
[14]Lichtenstein L.Modulation of plasma TG lipolysis by Angiopoietinlike proteins and GPIHBP1[J].Biochimica et Biophysica Acta.Molecular and cell biology of Lipids,2010,1801(4):415-420.
[15]Naruhn S,Meissner W,Adhikary.15-hydroxyeicosatetraenoic acid is a preferential peroxisome proliferator-activated receptor beta/delta agonist.[J].Molecular Pharmacology,2010,77(2):171-184.
