水体中氟乐灵的生物毒性和去除研究进展
2013-09-06高梦鸿高乃云
高梦鸿,高乃云,李 军,周 超
(1.同济大学污染控制与资源化研究国家重点实验室,上海 200092;2.上海市政工程设计研究总院 (集团)有限公司,上海 200092)
二硝基苯胺类除草剂主要施用于棉花、大豆、花生等作物以及园艺植物,在较低的剂量 (0.5~1.5磅有效成分/英亩)就能有效防除多种禾本科和阔叶杂草[1]。氟乐灵是二硝基苯胺类类除草剂中广泛使用的选择性芽前除草剂之一,具有易挥发、易光解、水溶性极小和不易在土层中移动等特点,化学名称为2,6-二硝基-N,N-二丙基-4-三氟对甲苯胺,其基本理化性质如表1所示。
研究表明[3~8],在水体和土壤中残留的氟乐灵浓度虽然不高,但其残留时间长,不易降解,有蓄积性和迁移性,且在急性浓度范围内会对人类、家畜、野生动物产生致癌、致畸和致突变等健康危害,因此不少国家都对其制定了限量标准,如表2所示,其中涉及到了大多数水果、坚果、谷物、豆科类等食品。2004年11月,美国环境保护署(Environmental Protection Agency,EPA)拟再次修订最高残留限量要求,其中包括对氟乐灵残留限量要求的重新修订,建议其在薄荷油中的允许残留量为2.0 mg/kg,并对氟乐灵在薄荷油、胡椒薄荷叶和荷兰薄荷叶中的最高残留限量要求做了补充[9]。在氟乐灵的使用情况和有关毒理学试验数据的基础上,美国环境保护署将其列为C类人类可能性致癌物[10]和疑似内分泌干扰物 (Endocrine Disrupting Chemicals,EDCs)[11]。
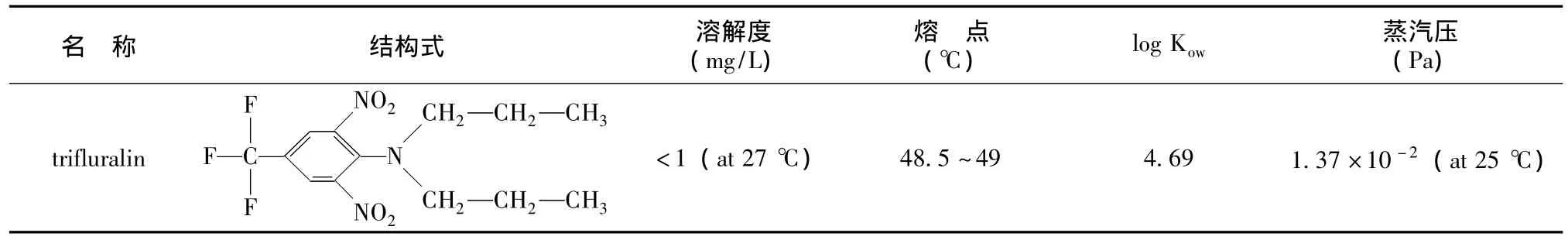
表1 氟乐灵的理化性质[2]Tab.1 Physicochemical properties of trifluralin
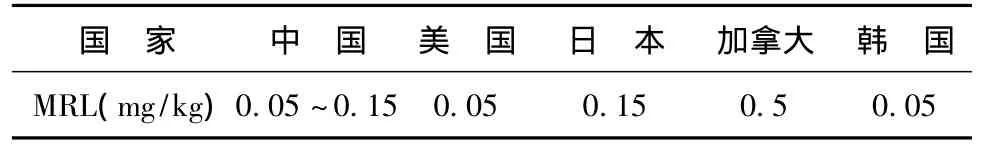
表2 食品中氟乐灵各国最高残留限量要求Tab.2 Maximum residue limit(MRL)of trifluralin in different countries
氟乐灵的广泛使用对环境所造成的危害和对人类健康的威胁,使人们逐渐将研究方向转向寻求可行的去除手段或将高危害性物质转化为对环境和人类低毒低害的其它物质。由于水源中农药污染浓度通常很低 (小于10-6mg/L或10-9mg/L),饮用水处理中混凝、沉淀和过滤等常规工艺对其去除作用非常有限,因此探索高效可行的去除技术成为当前研究的热点。
1 水体中氟乐灵的来源及生物毒性
近年来氟乐灵对水产养殖方面的污染越来越受到人们的广泛关注。2010年日本多次检出我国出口的鳗鱼、梭子蟹等水产品中氟乐灵超标。因此,研究氟乐灵对水生生物的遗传毒性和作用机理、建立快速高效的检测方法和探索可行去除手段,对降低氟乐灵对环境和人类的危害至关重要。
1.1 来源
氟乐灵进入到水环境的途径主要有3条:其一,在生产过程中逸散到空气而进入水体;其二,生产和加工废水的排放污染[12];其三,作为除草剂施入土壤后,通过农田灌溉、挥发、光解、微生物和化学作用溶于水,由地表水和地下水进入水环境中[13]。
1.2 生物毒性
水体中氟乐灵的生物毒性主要体现在其对水生生物的影响。目前,有关氟乐灵对水生生物的毒性研究主要集中在急性和亚急性浓度范围,其半致死浓度 LC50在 18.5 ~ 12000 μg/L 范围内[3]。Vesna等[4]对鲤鱼进行了氟乐灵的急性和亚急性毒性实验,研究结果表明,氟乐灵浓度与鲤鱼血液、组织中功能酶活性呈负相关,较高浓度的氟乐灵会严重损伤鲤鱼的鳃和肾等部位,使鱼体对外界环境变化的敏感程度增加,抵抗力降低。Konen等[5]通过微核试验分析评价了低质量浓度氟乐灵连续暴露对罗非鱼DNA的影响,观察到罗非鱼外周血红细胞微核率随暴露浓度增加而显著提高,表明氟乐灵对鱼类具有致突变性和遗传毒性。冯碧[6]将鲫鱼巨噬细胞和淋巴细胞作为研究对象,探讨氟乐灵与鱼类免疫细胞活性和功能的关系,结果表明氟乐灵对鲫鱼巨噬和淋巴细胞呈现一定的毒性,抑制和扰乱鱼体免疫细胞的正常活性和功能,对鱼类的免疫系统有显著影响。
氟乐灵主要通过受污染的水产品、饮用水等渠道在人体内富集。虽然没有确切证据表明氟乐灵具有遗传毒性,但通过对怀孕动物的暴露实验可以观察到氟乐灵对于母婴的不良影响,包括母体进食减少、体重下降,且胎儿的死亡率与母体暴露毒性的剂量呈正相关[3]。Saghir等[7]通过对小白鼠的试验发现,长期摄入氟乐灵会使小白鼠甲状腺激素(TSH)水平增高,刺激甲状腺滤泡增生肥大,从而诱发甲状腺滤泡细胞瘤。Ribas等[8]通过人类淋巴细胞的彗星试验 (单细胞凝胶电泳试验)发现,氟乐灵对DNA有一定的破坏作用,对哺乳动物细胞具有基因毒性。在亚慢性吸入毒性实验中,将大鼠暴露于氟乐灵浓度分别为100、300和1000 mg/m3(根据美国EPA/OPP发布的暴露量评估,对应的暴露剂量分别为27、81和270 mg/kg/d)的实验室中超过30d,观察发现,在暴露剂量为270 mg/kg/d时大鼠有疑似肝中毒迹象[3]。
1.3 毒性机理
目前对氟乐灵生理毒性的研究大多来自于动植物实验,对人类机体健康影响的资料十分有限。根据理化性质和毒理学研究[4~8],其毒性机理可归纳为两点:其一,氟乐灵作为可疑内分泌干扰物和致癌物,对人体具有潜在致畸、致突变和遗传毒性[14]。其作用机理和二硝基苯胺类除草剂 (如黄草消和二甲戊乐灵)以及秋水仙碱类似,通过与微管蛋白二聚体结合,阻止微管蛋白转换,抑制纺锤体的形成,使细胞停止于有丝分裂中期。因此,细胞不能够复制,并且被打乱正常增长,对机体造成损伤;其二,美国科学家Fine于1974年对广泛使用的农药中亚硝胺含量进行了检测,结果发现氟乐灵中亚硝胺的含量高达154 mg/kg[15]。因此推断氟乐灵在生产使用过程中容易产生有害的亚硝胺类化合物 (R2N-NO)。研究表明[16],氟乐灵溶于水后可作为亚硝基二甲胺 (NDMA)的前体物通过亚硝化机制生成NDMA。而NDMA由于其高致癌和致突变风险已被美国EPA列为200种致癌物质之一。
2 去除研究
饮用水是人体摄入氟乐灵的主要途径,因此研究如何降低饮用水中的氟乐灵含量,从而减轻其对人体的副作用成为了当务之急。饮用水中氟乐灵的去除方法可归纳为3种,即物理法、化学法和生物法。物理法包括活性炭吸附法和膜分离法;化学法包括传统的加氯氧化法和在紫外 (UV)、臭氧(O3)基础上发展起来的高级氧化工艺 (Advanced Oxidation Process,AOPs);生物法即为生物膜工艺。
2.1 物理法
2.1.1 活性炭吸附法
常用活性炭可分为颗粒活性炭 (GAC)和粉末活性炭 (PAC),其中GAC以其优越的吸附性能,广泛应用于饮用水中微量物质的去除。活性炭对水体中农药的去除主要受活性炭本身特性、农药初始浓度、温度、pH值及合成或天然有机物(NOM)竞争吸附等因素的影响。研究表明[17],Freundish吸附等温线常数>200的农药均易于被活性炭去除。活性炭在实际应用中的吸附性通常不如实验室条件下,这可能是源水中含有的NOM对吸附点位竞争吸附和对活性炭孔道堵塞的结果。
目前国内外尚缺少对单独活性炭吸附水体中氟乐灵的动力学和热力学研究,但根据GAC对二甲戊乐灵 (Pendimethalin,一种二硝基苯胺类除草剂)的吸附效果 (活性炭吸附柱高0.9 m,空床接触时间5.62 min,起始浓度0.2 μg/L,去除率>99%)推断[17],粉末活性炭对水中氟乐灵有较好的吸附效果。从常规净水工艺对包括氟乐灵在内的44种农药去除试验中发现[18],预臭氧化可去除水中70%的农药,随后的混凝沉淀过程对农药几乎无去除效果,但最后的活性炭吸附将农药的去除率提高至90%,由此可见活性炭吸附工艺对水中微量农药的去除有一定效果。因此,建立活性炭吸附水体中氟乐灵的匹配模型,探讨其等温吸附行为、机理及热力学性质,是目前研究的当务之急。
2.1.2 膜分离法
水处理中常用的膜工艺有反渗透 (RO)、纳滤(NF)、超滤 (UF)和微滤 (MF)等。其中MF和UF由于不能脱除低分子物质,单独使用时出水效果不佳,故很少运用于水体中微量有机污染物的去除。自1960年起,研究[19~23]发现在实验室条件下RO对极性和非极性的除草剂具有较好的去除效果,此后低压反渗透 (NPRO)工艺在此领域得到了广泛的研究和应用[24]。常用的反渗透膜有醋酸纤维膜 (CA)、聚酰胺膜 (PA)以及薄层复合膜(TFC)。试验表明[35],在起始浓度为 1578.9 μg/L时,CA和TFC对氟乐灵的去除率能达到99.74%和99.99%。NF膜介于RO和UF膜之间,由于其膜本体带有电荷性的特性,使得在很低压力下仍能截留分子量为数百的物质,因此近几年在研究饮用水中有毒有害物质的脱除方面有了较大的进展。Sanches等[25]通过纳滤膜对不同水源中农药和激素类污染物的吸附性试验得到了较好的去除效果(67.4%~99.9%),而在国内尚缺乏采用膜处理工艺去除水体中微量农药的深入研究。
膜分离技术在国外已走向成熟,其选择性好、适应性强,且在分离过程中无化学反应,不会产生有毒副产物,但在国内由于膜成本较高和应用经验不足而难以推广,在此基础上膜工艺仍具有很广泛的发展前景,同时将RO/NF与活性炭吸附、AOPs以及传统净水工艺的有机组合联用将为强化饮用水处理效果提供新的方案[26]。
2.2 化学法
在饮用水处理中,化学氧化法是去除农药的有效手段之一。国内外在水处理过程中通常采用的氧化剂有自由氯 (Cl2/HOCl)、氯胺 (NH2Cl)、二氧化氯 (ClO2)、高锰酸钾 (KMnO4)等。在化学氧化的基础上,逐步发展出AOPs工艺,即UV、O3等在催化剂 (如H2O2、TiO2)作用下产生具有强氧化能力的羟基自由基 (·OH),由于·OH的高活性,致使很多不能被普通氧化剂氧化或被生物降解的有机污染物得以去除。因此,AOPs在农药的降解去除方面得到了深入的研究和运用[27~29]。
2.2.1 加氯氧化法
饮用水处理中最常用的3种含氯消毒剂为自由氯、氯胺和二氧化氯。其中,自由氯与农药可能通过氧化、加成和亲电取代作用进行反应,二氧化氯通过电子转移反应氧化农药[30]。目前国内外关于这3种消毒剂对农药的降解已做了一些研究,但有关氟乐灵的报道较少。有研究表明氟乐灵的浓度即使低至1 μg/L,也不能被10 mg/L的 C12分解。田芳等[30]研究了3种含氯消毒剂 (自由氯、氯胺和二氧化氯)与8类使用广泛或在水源中已检测出有残留的农药的反应活性,结果表明,氟乐灵均难以被这3种消毒剂去除。因此寻找更合适的氧化剂或在常规工艺后进行深度处理以使氟乐灵含量达到出水标准成为了当务之急。
2.2.2 UV和基于UV的AOPs
Dimoua等[31]通过模拟太阳光在不同水体中对氟乐灵的降解实验发现,水体中天然有机物抑制其降解,而硝酸根离子会促进其光解速率。随着UV辐射时间的增长,氟乐灵水溶液的毒性随之降低。其在水体中的降解机理涉及脱烷、环化及还原反应。
刘超等研究发现[32],在平均光强为10.8 mW/cm2,波长为254 nm的紫外线辐射下,30 min后超纯水中氟乐灵降解率为69.2%,其准一级反应速率常数k<0.0005 s-1,表明在饮用水处理正常投加剂量范围内单独紫外光照射对氟乐灵的降解率并不高,降解率的提高只能通过改变反应条件,如增大光强等来实现。虽然UV对氟乐灵有一定程度的降解效果,但考虑到饮用水处理的常规UV投加量(40 mg/cm2),用单独的UV工艺去除农药并不现实,而在UV工艺中加入H2O2或与O3工艺联用,则能使氟乐灵的降解得以大幅的强化。
Chelme等[33]通过UV和UV/H2O2组合工艺对超纯水和不同天然水体中氟乐灵去除效果的研究发现,波长为253.7 nm的紫外光在不同pH下对氟乐灵的光解反应都遵循一级反应动力学,在超纯水中氟乐灵的平均反应速率常数为10.4×10-4s-1,天然水体中略低,分别为7.8×10-4s-1和4.6×10-4s-1。而采用UV/H2O2联用工艺测得在超纯水中的平均反应速率常数为12.6×10-4s-1,天然水体中分别为 9.1 ×10-4s-1和 7.2 ×10-4s-1。结果表明,UV/H2O2联用法相比直接光解法提高了对氟乐灵的去除率,且pH值和去除率呈正相关。经过UV和UV/H2O2后氟乐灵的急性毒性均有所降低。
2.2.3 O3和基于O3的AOPs
Buxton[34]等研究发现,臭氧反应生成的·OH与超纯水中有机化合物的反应动力学常数约在107~1010M-1·s-1左右。Pamela 等[39]研究了常规臭氧反应中氟乐灵的氧化反应动力学及其降解机制,推断O3降解氟乐灵主要通过脱烷和羟基化作用,这可能是由于O3作为亲电子反应剂,极易攻击有机物的芳香环、不饱和双键与三键,以及含N、S等的还原性化学基团,因此O3对氟乐灵有较好的去除效果。研究结果显示[30,32],UV只有在高剂量下才可降解大部分农药,而臭氧在常规剂量下即可有效降解多数农药。在臭氧水溶液初始浓度为4.1~6.2 mg/L下反应30 min后,氟乐灵的降解率在90%以上,表明O3在常规剂量下即可对氟乐灵有较好的去除效果。
2.3 生物法
目前被运用于饮用水处理中的生物处理工艺主要是生物膜工艺,生物膜工艺被认为是去除水中痕量有机物的有效方法。关于氟乐灵的生物降解已有不少研究[36~39],推断其主要的降解途径是通过氧化作用和硝基还原。氟乐灵由于分子量大、空间结构稳定、不易溶于水、具有一定的生物毒性,因此更能抗生物降解。Bellinaso等[39]从土壤中分离出8种氟乐灵的耐药菌,并在浓缩液体培养基中进行降解反应,30d后氟乐灵的降解率最高仅达到25%。且一般降解菌的世代周期较长,降解农药需要较长的时间,同时易受到周围环境因素的影响,如温度、湿度、pH值、进水化合物组成等,使得单一的微生物降解农药很难应用到实际生产。因此寻找组合菌种或筛选培养新的更有效的降解菌将是采用微生物降解水体中氟乐灵的研究重点。
近年来,伴随着基因工程和分子生物学研究技术的发展,高效工程菌的构建研究为微生物降解农药开辟了新途径。Bellinaso等[40]通过对氟乐灵分解代谢遗传方面的研究发现,从氟乐灵降解菌中提取出的双氧酶基因其产物可以作为降解菌的底物,通过共代谢作用降解氟乐灵。另外,通过一些常见农药的研究发现[41~43],AOPs工艺后农药形成的中间产物及最终产物易被生物降解,例如臭氧-生物活性炭工艺是近年来被广泛使用的化学法和生物法相结合的饮用水深度处理工艺,活性炭吸附可以去除水中的大部分有机农药,而臭氧促进农药的分解,提高原水的可生物降解性,延长活性炭的使用寿命。因此采用生物降解和AOPs工艺联合去除水体中的氟乐灵将有较好的发展前景。
2.4 其它方法
一种新型真空灯 (VUV)和高能超声源的发展又提供了一种产生羟基自由基的新技术。将高能超声源 (频率为15~100 MHz)引入液体反应体系中,引起多种化学变化[44],并且由于真空紫外光的辐射,可使水分子发生变化产生羟基自由基和氢分子,羟基自由基和有机底物发生反应,完成不同的氧化和还原过程。其它新技术还有电化学氧化法和湿式氧化法 (WAO),电化学氧化法是用 Pt、IrO2或Ti/SiO2作为阳极,在电极上发生直接电化学反应或利用电极表面产生的强氧化性活性物质使污染物发生氧化还原转变;湿式氧化法是使有机底物被高温 (200℃ ~325℃)、高压 (>150 bar)的液相氧分子氧化而分解。
目前,这些新兴技术在国内仍大多限于实验室研究,一是由于缺乏对其系统热力学、动力学行为的深入研究,因此工程设计和过程开发所需数据和资料难以得到;二是由于工程各反应体系温度、压力太高,要求设备材质耐腐蚀、耐高温、耐高压,为工艺控制操作增加了难度,从而阻碍了其在水处理工艺上的发展和实际应用。
3 结论
目前对氟乐灵的毒性评价通常采用急性毒性测试,但在饮用水水源中氟乐灵一般以微污染的形式存在,产生急性毒性的可能性较低,因此水体中微量农药的存在对人体的副作用将会是今后研究的方向。在水处理过程中,农药及其降解副产物的长期累积毒性同样应值得关注,特别是致癌性,这些毒性数据将为饮用水安全评价提供有效的依据。在饮用水处理过程中单一的物理、化学、生物法去除水体中微量浓度的氟乐灵都存在着一定的缺陷。基于UV、O3发展起来的高级氧化技术能产生大量羟基自由基,相比于其他方法提高了对水体中氟乐灵的降解效果,但仍无法将氟乐灵完全矿化或降解成无毒的其他成分,且考虑到实际运用中源水水质波动对反应过程的影响和水体中无机离子、溶解性及悬浮有机物等对羟基自由基的竞争作用,因此将高级氧化技术与生物降解及其它合适的工艺相结合,才能达到将污染物完全除去的目的。
[1]叶承道,唐洪元.国外二硝基苯胺类除草剂研究进展[J].世界农药,1979,1(4):23-29.
[2]Worthing C R,ed.The pesticide manual[A].The British Crop Protection Council[C].UK:Farnham,1991.
[3]Durkin P R and Worthing C R.Trifluralin:Human health and ecological risk assessment[R].New York:Syracuse Environmental Research Associates,Inc.2011.
[4]Vesna P H,Vesela K.Effects of trifluralin on carp:Biochemical and histological evaluation[J].Ecotoxicology and Environmental Safety,1999,43:213-221.
[5]Koenen S,Cavas T.Genotoxicity testing of the herbicide trifluralin and its commercial formulation treflan using the piscine micronucleus test[J].Environmental and Molecular Mutagenesis,2008,49(6):434-438.
[6]冯 碧.三种环境激素对鱼类免疫细胞活性与功能的影响[D].杭州:浙江大学,2003.
[7]Saghir S A,Charles G D,Bartels M J.Mechanism of trifluralininduced thyroid tumors in rats[J].Toxicology Letters,2008,180(1):38-45.
[8]Ribas A G,Frenzilli H G,Baraleb R,et al.Herbicide-induced DNA damage in human lymphocytes evaluated by the single-cell gel electrophoresis(SCGE)assay[J].Mutation Research-Genetic Toxicology,1995,344:41-54.
[9]霍江莲,李 军,葛毅强,等.二硝基苯胺类除草剂残留检测技术的研究进展[J].农药,2006,45(4):222-226.
[10]U.S.EPA,1998a.Registration Eligibility Decision(RED)Facts-Bromoxynil[EB/OL].U.S.Environmental Protection A-gency,http://www.epa.gov(accessed August 2006).
[11]U.S.EPA,1998b.Registration Eligibility Decision(RED)Facts-Bromoxynil[EB/OL].EPA-738-R-98-013.U.S.Environmental Protection Agency,Washington,D.C.
[12]U.S.Department of Health and Human Services.Hazardous substances data bank national toxicology information program[M].USA:US.National Library of Medicine,Bethesda,1993.
[13]Yockim R S,Isensee A R,Walker E A.Behavior of trifluralin in aquatic model ecosystems[J].Bulletin of Environmental Contamination and Toxicology,1980,24:134-141.
[14]吕 潇.李慧冬.杜红霞,等.农药类内分泌干扰物的研究进展[J].华中农业大学学报,2006,25(1):94-100.
[15]Fine D H,Ross R,Fan T,et al.Determination of N-nitroso compounds in air,water and soil[A].172nd National Meeting of the American Chemical Society[C].San Francisco:CA,1976.
[16]Shen R Q,Andrews S A.Demonstration of 20 pharmaceuticals and personal care products(PPCPs)as nitrosamine precursors during chloramine disinfection[J].Water Research,2011,45:944-952.
[17]Speth T F,Miltner R J.Technical note:adsorption capacity of GAC for synthetic organics[J].Journal(American Water Works Association),1990,82(2):72-75.
[18]Ormad M P,Miguel N,Claver A,et al.Pesticides removal in the process of drinking water production[J].Chemosphere,2008,71(1):97-106.
[19]Ironside R,Sourirajan S.The reverse osmosis membrane separation technique for water pollution control[J].Water Research,1967,1:179-180.
[20]Hindin E,Bennett P J,Narayanan S S.Organic compounds removed by reverse osmosis[J].Water Sew Works,1969,116(12):466-470.
[21]Chian E S K,Willis N B,Fang H H P.Removal of pesticides by reverse osmosis[J].Environmental Science Technology,1975,9(1):52-59.
[22]Fang H H P,Chian E S K.Removal of alcohols,amines,and aliphatic acids in aqueous solution by NS-100 membrane[J].Journal of Applied Polymer Science,1975,19(5):1347-1358.
[23]Fang H H P,Chian E S K.Reverse osmosis separation of polar organic compounds in aqueous solution[J].Environmental Science Technology,1976,10(4):364-369.
[24]Hofman J A M H,Beerendonk E F,Folmer H C,et al.Removal of pesticides and other micropollutants with cellulose-acetate,polyamide and ultra-low pressure reverse osmosis membranes[J].Desalination,1997,113(2-3):209-214.
[25]Sanches S,Penetra A,Rodrigues A,et al.Nanofiltration of hormones and pesticides in different real drinking water sources[J].Separation and Purification Technology,2012,94:44-53.
[26]Sarkar B,Venkateswralu N,Rao R N,et al.Treatment of pesticide contaminated surface water for production of potable water by a coagulation– adsorption–nanofiltration approach[J].Desalination,2007,212(1-3):129-140.
[27]Chiron S,Fernández-Alba A R,Rodríguez A.Pesticide chemical oxidation processes:an analytical approach[J].Trends in Analytical Chemistry,1997,16(9):518-525.
[28]Ikehata K,El-Din M G.Aqueous pesticide degradation by ozonation and ozone based advanced oxidation processes:A review(Part I)[J].Ozone:Science and Engineering,2005,27(2):83-114.
[29]Ikehata K,El-Din M G.Aqueous pesticide degradation by ozonation and ozone based advanced oxidation processes:A review(Part II)[J].Ozone Science and Engineering,2005,27(3):173-202.
[30]田 芳,强志民,刘 超,等.含氯消毒剂与多类农药的反应活性研究[J].环境工程学报,2008,2(7):875-879.
[31]Dimoua A D,Sakkas V A,Albanis T A.Trifluralin photolysis in natural waters and under the presence of isolated organic matter and nitrate ions:Kinetics and photoproduct analysis[J].Journal of Photochemistry and Photobiology,2004,163(3):473-480.
[32]刘 超,强志民,田 芳,等.多类农药与紫外光、臭氧和高锰酸钾的反应活性研究[J].环境科学,2009,30(1):127-133.
[33]Chelme-Ayala P,El-Din M G,Smith D W.Degradation of bromoxynil and trifluralin in natural water by direct photolysis and UV plus H2O2advanced oxidation process[J].Water research,2010,(44):2221-2228.
[34]Buxton G V,Greenstock C L,Helman W P,et al.Critical Review of Rate Constants for Oxidation of Hydrated Electrons,Hydrogen Atoms and Hydroxyl Radicals(·OH/·O-)in Aqueous Solutions[J].Phys.Chem.Ref.Data,1988,17:513-886.
[35]Chelme-Ayala P,El-Din M G,Smith D W.Kinetics and mechanism of the degradation of two pesticides in aqueous solutions by ozonation[J].Chemosphere,2010,78(5):557-562.
[36]Hamdi Y A,Tewfik M S.Decomposition of the herbicide trifluralin by a Pseudomonad[J].Acta Microbiol Polinica Series B,1969,1(2):83-84.
[37]Carter N D,Camper N D.Soil enrichment studies with trifluralin[J].Weed Science,1975,23(1):71-74.
[38]Sato Y.Degradation of trifluralin by bacteria isolated from soil[J].Weed Research Japan,1992,37:213-219.
[39]Bellinaso M D L,Greer C W,Peralba M C,et al.Biodegradation of herbicide trifluralin by bacteria isolated from soil[J].Microbiology Ecology,2003,43(2):191-194.
[40]Bellinaso M D L,Henriques J A,Gaylarde C C,et al.Genes similar to naphthalene dioxygenase genes in trifluralin-degrading bacteria[J].Pest Management Science,2004,60(5):474-478.
[41]Kross B C,Vergara A,Raue L E.Toxicity assessment of atrazine,alachIol and carbofuran and their respective environmental metabolites s using Microtox[J].Journal of Toxicology and Environmental Health,1992,37(2):149-159.
[42]Chan C Y,Tao S,Dawson R,et al.Treatment of atrazine by integrating Photocatalytic and biological precesses[J].Environment Pollution,2004,131(1):45-54.
[43]Amold S M,Hickey W J,Harris R F,et al.Integrating chemical and biological remediation of atrazine and s-triazine-containing pesticide wastes[J].Environmental Toxicology and chemistry,1996,5(11):1255-1262.
[44]Hoffmann M R,Inez H,Hchemer R.Application of ultrasonic irradiation for the degradation of chemical contaminants in water[J].Ultrasonics Sonochemistry,1996,3(3):163-172.
