水体汞光还原研究进展
2013-09-06赵士波孙荣国王定勇王小文
赵士波,孙荣国,王定勇,3,王小文
(1.西北大学城市与环境学院,西安 710127;2.西南大学资源环境学院,三峡库区生态环境教育部重点实验室,重庆 400715;3.重庆市农业资源与环境研究重点实验室,重庆 400716)
1 引言
汞是毒性极强的重金属元素。自从20世纪50年代日本水俣病发生以来,汞污染一直受到人们的广泛关注。汞及其化合物尤其是甲基汞 (Methylmercury,MMHg)具有很强的生物毒性。MMHg可以通过水生食物链逐级富集到大型食肉性鱼类体内,对人类及食鱼生物的健康构成威胁。水体作为地球覆盖面积最大的生态系统,是汞迁移转化的重要场所。研究显示,水体汞的光化学反应对汞在水-气、土-气界面释放等全球性地球化学循环起重要作用[1]。水体汞的光化学反应主要包括Hg(0)的光氧化、Hg(Ⅱ)的光还原、MMHg的生成与分解等4个过程[1]。Hg(Ⅱ)的光还原及随后的释放过程可以减轻水体汞负荷,进而降低汞通过甲基化反应生成毒性更强的MMHg的过程[2],对于全球汞循环具有重要意义[3]。鉴于光致汞还原在汞的环境地球化学行为中的重要性,科学家对水生系统中汞的光还原过程及影响因素做了一系列研究。本文综述了近年来水体汞光还原研究进展及成果,并评述了光致汞还原研究存在的问题。
2 汞的光还原
汞的光还原是最主要的非生物汞还原过程。它是指由光照引发的汞的化合价降低并对Hg(0)在界面释放的促进过程[4]。该过程是水体汞向大气释放的主要途径,也是造成地表汞二次释放的重要作用[5,6]。就局部而言,汞的光还原减少了水体汞负荷,进而降低了汞甲基化及生物富集的风险[6]。但就全球而言,进入大气的汞可以在大气中停留0.5~2年[7],随大气长距离迁移,通过干湿沉降至地表,造成偏远地区汞污染。因此,汞的光还原在汞的生物地球化学循环中起着重要作用。
分析汞的光还原速率常数可以发现,汞的光还原属于一级动力学反应[3,8~10],即光还原速率与可光还原态Hg(Ⅱ)的浓度呈正相关关系。然而,由于实验条件、环境条件等影响因素的差异,不同学者研究所得到的光还原速率常数相差较大。光照作为光反应的必要条件,由于辐射强度及波长的差异导致汞光还原速率不同,是影响汞光还原的主要因素。水体中存在大量的溶解性有机质 (Dissolved Organic Matter,DOM)及可溶性离子,通过与汞相互作用或改变环境条件成为影响水汞光还原的另外两大因素。此外,水生生物对光反应的直接调节作用及对环境条件的影响也不容忽视。其他影响因素还包括颗粒含量、温度、pH等。
3 影响因素
3.1 光辐射强度与波长
能够到达水体表面的辐射波段包括可见光(400~700 nm)和紫外光UVR(290~400 nm),其中UVR由95%的UVA和5%的UVB组成。由于到达地表的各波段波长在水中的穿透能力及光强度有一定差异,致其是水汞还原反应的重要影响因素[11]。
早期研究主要针对全波段辐射,实验光源多采用太阳光辐射或氙灯,所得到的结果比较一致。Xiao等[12]发现水体汞界面释放的日变化模式为汞的释放速率在早晨到中午的时间呈上升趋势,中午到傍晚呈下降趋势;光辐射强度与水体汞的释放速率有明显的正相关关系。Amyot等[13]采用不同的监测方法也可观察到类似的变化趋势。实验室结果也显示,光照条件能够促进Hg(Ⅱ)溶液中溶解性气态汞 (Dissolved Gas Mercury,DGM)的产生[14]。
由于不同波长的光辐射与水生系统中可溶性分子间的相互作用不同,导致其在水体汞光还原过程中所起的作用存在较大差异。其中UVR波长短,能量高,入射到水体后能够有效引发水体的光化学反应并为汞与DOM等中间分子的结合提供能量。Garcia等[15]发现,大多数的 DGM(61% ~73%)是在UVR条件下生成的,而只有不到27%是在可见光作用下生成的。另有研究发现,在使用聚酯薄膜去除UVB后DGM的产率无显著变化[11],而去除UVA后的DGM产率会明显下降[16],并且DGM产量与光漂白 (主要由UVA引起)之间存在显著的相关性[15],由此可推断UVA可能是控制汞光还原反应的主要波段。但另一些研究显示,对水体汞的光还原起主要作用的可能是 UVB。O'Driscoll等[3,9]发现UVB条件下的汞还原速率常数 (6.00×10-5~4.40 ×10-4s-1)要大于 UVA(5.26 ×10-5~3.04 ×10-4s-1);另外,在 UVA 条件下可观察到可溶性有机碳荧光 (Dissolved Organic Carbon fluorescence,DOCF)降低约50%,溶解性有机碳 (Dissolved Organic Carbon,DOC)浓度没有变化;而 UVB条件下 DOCF和 DOC的变化(<10%)都很小。该现象表明UVA是改变DOM结构而导致荧光消失的主要驱动力。可见,波长是影响水汞还原反应的重要因素,其对水汞还原反应的作用机制及机理仍不清楚。
DOM作为一种光敏剂,其自身的浓度与结构对光辐射的穿透能力有重要影响。其中含有的不同官能团对不同波长光辐射具有一定的吸收特征,高浓度的DOM不仅吸收光辐射能力强,本身也会发生光漫反射,进而影响光穿透能力,削弱水中光照强度。Amyot等[17]在北极高纬度地区湖泊的研究中发现,DOM浓度较高的中性湖泊,可见光对汞的光还原反应起主导作用;DOM浓度较低的清澈湖泊主要是由UVR负责汞的光还原。而Garcia等[15]在对加拿大北部湖泊的研究中发现UVA条件下,腐殖质含量高的湖泊所产生的DGM相比清澈湖泊更多;相反UVB条件下,清澈湖泊产生的DGM更多。这是由于DOM中的腐殖酸和富里酸对290 nm~400 nm的UVR有较强的吸收作用[18]。另外,腐殖质包含的大量芳香环更易吸收短波辐射,因而在腐殖质含量较高的水体,UVB的衰减程度要大于 UVA[19,20]。
一般,淡水中DOM含量高于海水,因而淡水中UVR衰减更快,光活性层更浅。Lean[19]观察到DOM>10 mg/L的湖水中,UVB在水深20 cm处衰减量可达90%,而在太平洋及大西洋水深15 m处仍可发生光化学反应。这表明在DOM浓度较低的淡水中,一部分汞的光还原反应发生在更深层水域,因而可能会有一部分DGM无法穿越水体释放到大气。另外,水体中大量的颗粒物也会造成光辐射衰减,所以总悬浮颗粒物 (Total Suspended Solids,TSSs)及DOM浓度越低的湖泊,汞的光还原速率越大[21]。这也是海水中光辐射衰减缓慢的原因之一[19,22]。
3.2 溶解性有机物
DOM对汞光还原的作用十分复杂,研究结果还存在争议。Wollenberg和 Peters[23]曾报导 DOM对DGM产生无显著影响;然而该研究所涉及的DOM浓度 (3.3~4.7 mg/L)范围很小,只是大多数淡水中DOM浓度的最低水平。Ahn等[24]也发现DOM浓度并不影响DGM的产量。但也有报道称,DOM浓度低的湖泊 DGM 产量较高[14,15],即 DOM浓度与DGM产量之间呈负相关关系。与此相反的是,O’Driscoll等[25]发现DOM浓度与DGM产量初始时呈正相关关系,但到达临界值之后会抑制DGM的产生。
DOM浓度和结构是影响水生系统中汞光还原反应的重要因素[3,9,25~27]。若 DOM 结构和其他溶解性离子保持不变,DOM浓度与DGM产量呈正相关关系;同时,O’Driscoll等[25]还指出四周没有树木的湖泊相对于四周分布茂密森林的湖泊,DGM产率更低。作者在之后的研究中解释存在该差异的原因可能是两类湖泊中的DOM结构不同,四周树木的枯枝落叶腐解产生的外源DOM进入湖泊,相对于单纯的只有自身DOM的湖泊而言,DOM的结构更为复杂[9]。然而,DOM结构控制汞光化学反应的研究结果尚不统一。一些学者认为,DOM结构可能改变了可光还原态汞[9]及二次光反应物[28]的可利用性,从而间接影响汞的光还原速率。Amyot等[17]认为DOM会与无机汞发生络合反应,导致发生光还原反应的汞底物含量减少。Rolfhus等[29]的研究也支持该观点,他发现在DOM浓度高的湖泊中,活性汞 (参与光反应的汞)会与其他化合物结合而使其含量迅速减少,而该现象在DOM浓度较低的河水中很少出现。然而O’Driscoll等[3,9]认为,与 DOM 功能团结合的汞才是发生光还原的汞形态,这时DOM可能起到电子传递的作用[30]。
另有研究指出,DOM的羧基官能团是影响汞光反应的重要结构[31~33]。然而,羧酸对汞光还原的作用是分子内作用还是分子间作用,目前还不清楚。Si和Ariya[33]研究了光照条件下,半挥发性、小分子二元羧酸 (C2~C4)对Hg(Ⅱ)的还原作用。结果显示,在UV条件下,一部分Hg(Ⅱ)被R(CO2)﹣2还原为Hg(0);另一部分Hg(Ⅱ)与DCA(Dicarboxylic acids,二元羧酸)发生络合反应形成Hg-DCA络合物,Hg-DCA光解通过分子内两个电子转移使Hg(Ⅱ)还原为Hg(0)。O’Driscoll等[9]也提出了DOM中羧基官能团对汞光还原反应的重要性。如前所述,O’Driscoll等[9]发现湖泊周围的树木可能会影响湖泊中DOM的组成和结构,随着湖泊周围森林砍伐量的增加,湖泊DOM中羧基部分随之增加,从而限制了其与可还原态汞的络合,导致DGM产率下降;同时,该结论也支持了汞的光还原是分子内反应的观点。
Allard和 Arsenie[34]认为溶解性腐殖质可将Hg(Ⅱ)还原为Hg(0),并推测起关键作用的可能是腐殖酸中存在的半醌类等中间媒介物。室外模拟实验结果也显示,在自然光条件下,天然水体外加腐殖酸和富里酸可提高汞的光还原速率[12,35]。Lin和Pehkonen[36]也发现汞与有机酸 (草酸)的反应可提高汞的光还原率,并指出有机酸光解产生的HO2·促进Hg(Ⅱ)的还原作用。
尽管有机颗粒物对汞光还原作用的研究结果还存在争议,但总体来说,其影响作用主要有以下两方面:(1)在颗粒物表面与光反应物结合;(2)改变光辐射强度和波长。Beucher等[37]在热带水域的研究中发现,水样过滤之后DGM的产量并无显著变化,由此可推测汞的光反应可能与溶解相及胶体相有关[14,38]。此外,Lean[19,22]指出淡水中 DOC的浓度要比颗粒态有机碳浓度高2~40倍,因而湖泊中颗粒物对紫外吸收的影响相对很小。如3.1所述,另一些学者认为,有机颗粒物通过阻挡或吸收光辐射间接影响汞的光化学反应。悬浮颗粒物及DOM含量较高的湖泊,光衰减作用更强,DGM产率更低[15,39~41]。
通过以上分析可以发现,DOM与汞光还原之间的关系十分复杂,研究结果差异较大。但总体来说,DOM主要通过两种方式影响水体中汞的光还原,DOM分子中某些活性基团 (如半醌等结构)在汞的氧化还原反应中起到电子传递介质的作用或者DOM中某些还原基团 (如羧基等)直接对Hg(Ⅱ)起还原作用;DOM浓度较高时阻挡、吸收光辐射或与Hg(Ⅱ)发生络合反应从而降低可光还原态汞的利用性。
3.3 可溶性离子
无机离子通过影响光辐射、与Hg(Ⅱ)竞争DOM光活性位点、产生活性较强的自由基等基团等过程间接作用于水体汞的光还原。对水汞光还原影响较为重要的离子包括Fe(Ⅲ)、Cl﹣及NO﹣3。在外源加入Fe(Ⅲ)的水中发现DGM的产量会大幅度上升[42]。其作用机制如下:
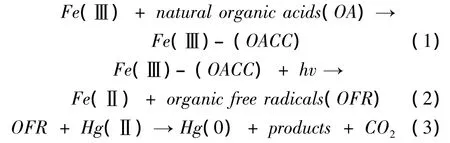
并且,Hg(0)可能通过如下反应重新被氧化为Hg(Ⅱ):
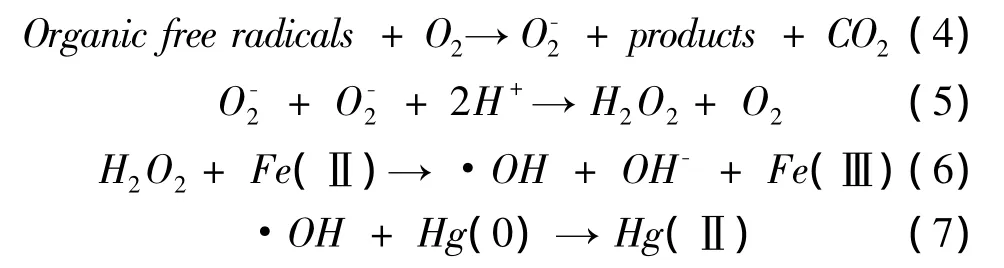
在氙灯的辐射下,外加铁氧化物会增加Hg(Ⅱ)的光还原[43]。Deng 等[6]也认为 Fe(Ⅲ)对汞的光还原起促进作用。Ababneh等[2]通过研究草酸铁对二价汞光还原的影响发现,草酸铁光解产生强还原自由基离子·COOH,Hg(Ⅱ)+·COOH→Hg(I)+CO2⇌Hg(I)Hg(0)+Hg(Ⅱ);该结果支持了Zhang and Lindberg的观点。另外,Maloney等[44]指出Fe(Ⅲ)与DOM结合会增加腐殖质湖泊的UVR吸收,这可能是DGM产量上升的另一原因。然而,Wollenberg和Peters[23]的研究结果却截然不同。他们发现在原位实验中,总铁离子和Fe(Ⅲ)与溶解性汞的浓度或表层汞的释放都无显著相关性。这种矛盾可能是DOM结构等系统变量不同所致。
关于Cl﹣对汞光还原的影响,大多数研究认为Cl﹣可与溶液中Hg(Ⅱ)强有力地络合使得溶液中活性的或可还原的Hg(Ⅱ)浓度下降,从而抑制汞的光还原。Si and Ariya[33]指出由于Cl﹣可与Hg(Ⅱ)形成稳定的络合物,因而Cl﹣的存在会与DCAs竞争Hg(Ⅱ),降低参加光还原Hg(Ⅱ)的浓度。而在 Ababneh等[2]的研究中,Cl﹣可与 Hg(Ⅱ)竞争草酸铁光解产生的还原性自由基·COOH。Allard and Arsenie[34]也认为 Cl﹣是竞争离子,对汞的还原起抑制作用。Sun等[45]在研究氯化甲基汞光降解时发现,Cl﹣对甲基汞光降解产物-无机汞的还原具有较强的抑制作用,认为Cl﹣存在时,由于其存在较强的络合作用,使得Hg(Ⅱ)/Hg0的电动势降低,因而对无机汞还原有一定的抑制作用。然而,也有学者认为汞的光还原作用并不受Cl﹣的影响[21,46]。由于海水低 DOM和高Cl﹣的环境,海水中Cl﹣对汞光还原的作用更应该被关注。Rolfhus等[47]注意到入海河口与河流中段相比富含更多活性Hg(Ⅱ),因此汞的光还原作用相对较强。另外,也有学者猜测Cl﹣抑制汞光还原是因为Cl﹣可以促进Hg(0)的光氧化[48]。
Zhang等[25]在 Hg(NO3)2的光还原实验中发现,Hg(NO3)2的光还原率顺序为黑暗>自然光>UVA,与HgCl2,HgS,Hg(SO4)2,的实验结果完全相反。他指出是由于光解产生的·OH将Hg(0)重新氧化为Hg(Ⅱ)所致。可见,对汞的光化学行为有重要的影响。此外,铁氧化物、锰氧化物、Al2O3和ZnO属于半导体金属氧化物,溶于水后在光作用下会激发出电子,Hg(Ⅱ)可截获电子被还原为 Hg(0)[28]。
3.4 生物影响
生物过程对水汞光还原的影响可分为两个方面。一方面,生物有机体通过影响DOM的浓度及结构从而改变光反应的化学条件;另一方面,生物过程可直接参与调解光化学反应。Ahn等[24]在韩国人工水库的实验中观察到,除冬季之外,其他3季DGM的产生与光照辐射均无明显相关性,而与水温呈一定相关性,该结果与之前研究普遍认为的DGM的产生受光还原作用控制的观点相矛盾;作者推测该人工水库在春夏秋三季,异养细菌对汞的还原作用占主导地位,而冬季微生物活性较低的条件下,汞的光还原作用占主导地位。许多报道称,DGM的产生与浮游植物色素[49~51]、海藻生理特性[52]、藻细胞密度[53,54]有关,说明浮游生物可能对Hg(0)产生的起关键作用。藻类对汞光生物还原的作用主要受其所释放的有机小分子及自由电子的控制。在光照条件下,硅藻细胞培养液和细胞分泌物中的DGM产率非常接近[55],据此推测细胞分泌物可能也参与汞的生物光还原作用。总的来说,藻类对Hg(Ⅱ)光还原的促进作用包括3种可能机制:(1)藻细胞表面酶还原作用;(2)水合电子还原作用;(3)藻类光解产生的DOM起间接促进作用[53]。
4 结论及展望
目前虽然已经证实了光照条件下,水体中的Hg(Ⅱ)可被还原为Hg(0),但是对于汞光还原的确切机制还不清楚,许多因素的影响机制也存在争议。最主要的争议焦点有3方面:一是哪种类型的光辐射对水体汞的光还原起最主要作用。二是DOM与可还原态Hg之间的相互作用关系,即DOM对汞光还原的作用属于分子内反应还是分子间反应;三是对于可光还原态汞的定位,可光还原态汞到底是与DOM结合的部分还是其他汞形态需要进一步研究证实。
目前多数研究是针对单一影响因子的研究,而缺少对各种因素综合作用的研究。不同的研究结果可能反映了不同的还原机制及研究区域的特殊性。因此,对各因素综合影响的研究可能会成为今后研究的重点。
[1]张玉涛.光照和DOM对水体中汞转化的影响机制及动力学研究[D].重庆:西南大学,2011.1-117.
[2]Fuad A.Ababneh,Susannah L.Scott,Hassan A.Al-Reasi,David R.S.Lean.Photochemical reduction and reoxidation of aqueous mercuric chloride in the presence of ferrioxalate and air[J].Science of the Total Environment,2006,367:831-839.
[3]O’Driscoll N J,Siciliano S D,Lean D R S,Amyot M.Gross photoreduction kinetics of mercury in temperate freshwater lakes and rivers:application to a general model of DGM dynamics[J].Environmental Science Technology,2006,40:837-843.
[4]阴永光,李雁宾,蔡 勇,江桂斌.汞的环境光化学[J].环境化学,2011,30(1):84-91.
[5]Smith-Downey N V,Sunderland E M,Jacob D J.Anthropogenic impacts on global storage and emissions of mercury from terrestrial soils:Insights from a new global model[J].Journal of Geophysical Research:Biogeosciences,2010,115(G3):2156-2202.
[6]冯新斌,付学吾,Jonas S,Jerry L,商立海,仇广乐.地表自然过程排汞研究进展及展望[J].生态学杂志,2011,30(5):845-856.
[6]Deng L,Deng N,Mou L,Zhu F.Photo-induced transformations of Hg(Ⅱ)species in the presence of Nitzschia hantzschiana,ferric ion,and humic acid [J].Environmental Sciences,2010,22(1):76-83.
[7]Schroeder W H,Munthe J.Atmospheric Mercury-an overview[J].Atmospheric Environment,1998,32(5):809-822.
[8]Xiao Z F,Stromberg D,Lindqvist O.Influence of humic substances on photolysis of divalent mercury in aqueous solution[J].Water,Air and Soil Pollution,1995,80:789-798.
[9]O’Driscoll N J,Siciliano S D,Peak D,Carignan R,Lean D R S.The influence of forestry activity on the structure of dissolved organic matter in lakes:implications for mercury photoreactions[J].Science of the Total Environment,2006,366:880-893.
[10]Zhang Y,Sun R,Ma M,Wang D.Study of inhibition mechanism of NO3ˉon photoreduction of Hg(Ⅱ)in artificial water[J].Chemosphere,2012,87:171-176.
[11]Amyot M,Mierle G,Lean D R S,McQueen D J.Sunlight-induced formation of dissolved gaseous mercury in lake waters[J].Environmental Science Technology,1994,28:2366-2371.
[12]Xiao Z F,Munthe J,Stromberg D,Lindqvist O.Photochemical behaviour of inorganic mercury compounds in aqueous solution[A].In:Watras C J,Huckabee J W,editors.Mercury pollution:integration and synthesis[C].Florida:Lewis Publishers,CRC Press,1994.581-592.
[13]Qureshi A,O’Driscoll N J,MacLoed M,Neuhold Y-M,Hungerbuhler K.Photoreactions of mercury in surface ocean water,gross reaction kinetics and possible pathways[J].Environmental Science Technology,2010,44(2):644-649.
[14]Amyot M,Mierle G,Lean D R S,McQueen D J.Effect of solar radiation on the formation of dissolved gaseous mercury in temperate lakes[J].Geochimica et Cosmochimica Acta,1997,61:975-987.
[15]Garcia E,Amyot M,Ariya P.Relationship between DOC photochemistry and mercury redox transformation in temperate lakes and wetlands[J].Geochimica et Cosmochimica Acta,2005,69(8):1917-1924.
[16]Vette A F.Photochemical influences on the air-water exchange of mercury[D].Michigan:University of Michigan,1998.1-98.
[17]Amyot M,Lean D R S,Mierle G.Photochemical formation of volatile mercury in high Arctic lakes[J].Environmental Toxicology and Chemistry,1997,16(10):2054-2063.
[18]Nriagu J O.Mechanistic steps in the photo-reduction of mercury in natural waters[J].The Science of Total Environment,1994,154:1-8.
[19]Lean D R S.Attenuation of solar radiation in humic waters[A].In:Hessen D O,Tranvik L J,editors.Aquatic humic substances[C].New York(NY):Springer-Verlag,1998.109-124.
[20]Kirk J T O.Optics of UV-B radiation in natural waters[J].Arch Hydrobiol Beih Ergeb Limnol,1994,43:1-16.
[21]Whalin L,Kim E-H,Mason R.Factors influencing the oxidation,reduction,methylation and demethylation of mercury species in coastal waters[J].Marine Chemistry,2007,107(3):278-294.
[22]Lean D R S.Influence of UVB radiation on aquatic ecosystems[A].In:Little EE,DeLonay AJ,Greenberg BM,editors.Environmental toxicology and risk assessment[C].Philadelphia(PA):American Society for Testing and Materials,1998.1-20.
[23]Wollenberg J L,Peters S C.Mercury emission from a temperate lake during autumn turnover[J].Science of the Total Environment,2009,407(8):2909-2918.
[24]Ahn M-C,Holsen T B,Yi S-M,Han Y-J.Factors influencing concentrations of dissolved gaseous mercury(DGM)and total mercury(TM)in an artificial reservoir[J].Environmental Pollution,2010,158:347-355.
[25]O’Driscoll N J,Lean DRS,Loseto L L,Carignan R,Siciliano S D.Effect of dissolved organic carbon on the photoproduction of dissolved gaseous mercury in lakes:potential impacts of forestry[J].Environmental Science Technology,2004,38:2664-2672.
[26]O’Driscoll N J,Siciliano S D,Lean D R S,Amyot M.Gross photo-reduction kinetics of mercury in temperate freshwater lakes and rivers:application to a general model of DGM dynamics[J].Environmental Science Technology,2004,40:837-843.
[27]He F,Zheng W,Liang L Y,Gu B H.Mercury photolytic transformation affected by low-molecular-weight natural organics in water[J].Science of The Total Environment,2012,416(0):429-435.
[28]Nriagu J O.Mechanistic steps in the photoreduction of mercury in natural waters[J].Science of the Total Environment,1994,154:1-8.
[29]Rolfhus K R,Lamborg C H,Fitzgerald W F,Balcom P H.Evidence for enhanced mercury reactivity in response to estuarine mixing[J].Journal of Geophysical Research,2003,108:3353-3364.
[30]Si L,Ariya P.Aqueous photoreduction of oxidized mercury species in presence of selected alkanethiols[J].Chemosphere,2011,84(8):1079-1084.
[31]O’Driscoll,N J,Rencz,A N,Lean,D R S.The biogeochemistry and fate of mercury in natural environments[A].In:Sigel A,Sigel H,Sigel RKO,editors.Metal ions in biological systems[C].New York(NY):Marcel Dekker,Inc,2005.43.
[32]O’Driscoll N J,Rencz A N,Lean D R S,editors.Mercury Cycling in a Wetland Dominated Ecosystem,A Multidisciplinary Study[M].Pensacola(FL):SETAC Publishers,2005.
[33]Si L,Ariya P.Reduction of oxidized mercury species by dicarboxylic acids(C2-C4):kinetic and product studies[J].Environmental Science Technology,2008,42:5150-5155.
[34]Allard B,Arsenie I.Abiotic reduction of mercury by humic substances in aquatic system-an important process for the mercury cycle[J].Water,Air and Soil Pollution,1991,56:457-464.
[35]Costa M,Liss P S.Photo-reduction of mercury in sea water and its possible implications for Hg0 air-sea fluxes[J].Marine Chemistry,1999,68:87-95.
[36]Lin C J,Pehkonen S O.Aqueous free radical chemistry of mercury in the presence of iron oxides and ambient aerosol[J].Atmospheric Environment,1997,31(24):4125-4137.
[37]Beucher C,Wong-Wah-Chung P,Richard C,Mailhot G,Bolte M,Cossa D.Dissolved gaseous mercury formation under UV irradiation of unamended tropical waters from French Guyana[J].Science of the Total Environment,2002,290:131-138.
[38]Amyot M,Lean D R S,Poissant L,Doyon M-R.Distribution and transformation of elemental mercury in the St.Lawrence River and Lake Ontario[J].Canadian Journal of Fisheries and A-quatic Sciences,2000,57:155-163.
[39]O’Driscoll N J,Poissant L,Canário J,Ridal J,Lean DRS.Continuous analysis of dissolved gaseous mercury and mercury volatilization in the upper St.Lawrence River:exploring temporal relationships and UV attenuation[J].Environmental Science Technology,2007,41:5342-5348.
[40]Tseng C M,Lamborg C,Fitzgerald W F,Engstrom D R.Cycling of dissolved elemental mercury in Arctic Alaskan lakes[J].Geochimica et Cosmochimica Acta,2002,68:1173-1184.
[41]Castelle S,Schäfer J,Blanc G,Dabrin A,Lanceleur L,MassonM.Gaseous mercury at the air-water interface of a highly turbid estuary(Gironde Estuary,France)[J].Marine Chemistry,2009,117:42-51.
[42]Zhang H,Lindberg S.Sunlight and iron(Ⅲ)-induced photochemical production of dissolved gaseous mercury in freshwater[J].Environmental Science Technology,2001,35:928-935.
[43]Lin C J,Pehkonen S O.Aqueous free radical chemistry of mercury in the presence of iron oxides and ambient aerosol[J].Atmospheric Environment,1997,31(24):4125-4237.
[44]Maloney K O,Morris D P,Moses C O,Osburn C L.The role of iron and dissolved organic carbon in the absorption of ultraviolet radiation in humic lake water[J].Biogeochemistry,2005,75(3):393-407.
[45]Sun R G,Wang D Y,Zhang Y T,et al.Photo-degradation of monomethylmercury in the presence of chloride ion[J].Chemosphere,2013,91(11):1471-1476.
[46]Matthiessen A.Reduction of divalent mercury by humic substances—kinetic and quantitative aspects[J].Science of the Total Environment,1998,213:177-183.
[47]Rolfhus K R,Lamborg C H,Fitzgerald W F,Balcom P H.Evidence for enhanced mercury reactivity in response to estuarine mixing[J].Journal of Geophysical Research,2003,108:3353-3364.
[48]Lalonde J D,Amyot M,Kraepiel A M,Morel F M M.Photo-oxidation of Hg(0)in artificial and natural waters[J].Environmental Science Technology,2001,35:1367-1372.
[49]Vandal G M,Mason R P,Fitzgerald W F.Cycling of volatile mercury in temperate lakes[J].Water,Air and Soil Pollution,1991,56:791-803.
[50]Baeyens W,Leermakers M.Elemental mercury concentrations and formation rates in the Scheldt Estuary and the North Sea[J].Marine Chemistry,1998,60:257-266.
[51]Poulain A J,Amyot M,Findlay D,Telor S,Barkay T,Hintelmann H.Biological and photochemical production of dissolved gaseous mercury in a boreal lake[J].Limnology and Oceanography-Methods,2004,49(6):2265-2275.
[52]Ben-Bassat D,Mayer A M.Light induced volatilization and O2evolution in chlorella and the effect of DCMU and methylamine[J].Physiologia Plantarum,1978,42(1):33-38.
[53]Deng L,Wu F,Deng N,Zuo Y.Photo-reduction of mercury(Ⅱ)in the presence of algae,Anabaena cylindrical[J].Journal of Photochemistry and Photobiology B:Biology,2008,91:117-124.
[54]Morelli E,Ferrara R,Bellini B,Dini F,Giuseppe G,Fantozzi L.Changes in the non-protein thiol pool and production of dissolved gaseous mercury in the marine diatom Thalassiosira weissflogii under mercury exposure[J].Science of the Total Environment,2009,408(2):286-293.
[55]Lanzillotta E,Ceccarini C,Ferrara R,Dini F,Frontini F P,Banchetti R.Importance of the biogenic organic matter in photoformation of dissolved gaseous mercury in a culture of the marine diatom Chaetoceros sp [J].Science of the Total Environment,2004,318(1-3):211-221.
