铁过载对脐带血来源的造血干祖细胞及造血支持细胞的作用观察
2013-09-05赵明峰卢文艺李玉明
肖 霞,赵明峰,卢文艺,柴 笑,穆 娟,邓 琦,李 青,李玉明
(天津市第一中心医院,天津 300192)
铁是人体必需的微量元素,细胞内生理量的铁在其DNA合成、电子传递、氧气运输等生物学过程中均发挥了重要的作用。但细胞内铁过载却能够引起组织器官和细胞的损伤。一些血液系统疾病如骨髓异常增生综合征(MDS)、再生障碍性贫血(AA)、地中海贫血等由于骨髓造血功能异常和红细胞无效生成需要长期依赖输血。细胞内过多的铁通过Haber-Weiss反应催化活性氧物质(ROS)的生成,改变了细胞内的氧化还原状态。细胞内ROS升高及其所致的抗氧化物质的相应减少,促进脂类、蛋白质和DNA的氧化,进而导致细胞和组织的损伤。而过多的铁沉积在肝、脾、心脏、胰腺等器官上,也造成了相应器官的衰竭。铁过载的相关研究显示,在MDS和地中海贫血患者骨髓细胞中均能发现自由铁,且祛铁治疗可改善这些患者的症状[1]。国外研究证实地中海贫血患者血中ROS水平明显高于正常人[2]。因此,我们假设铁过载通过ROS升高影响了骨髓造血功能。2012年3月~2013年3月,我们通过体外培养脐带血的过程中加入枸橼酸铁胺建立体外铁过载模型,然后检测其对骨髓造血功能的影响。
1 材料与方法
1.1 材料 细胞脐带血间充质干细胞(UC-MSCs)由中国医学科学院血液病研究所惠赠,新鲜脐带血来自本院产科足月健康妊娠产妇分娩后,征得产妇及家属知情同意后用于科学研究。
1.2 主要试剂 DMEM 低糖培养基、FBS、0.25%胰酶、鼠尾胶原均购自美国Gibco公司,细胞因子IL-3、IL-6、干细胞生长因子(SCF)、FLT-3 配基(FLT-3 ligand,FL)购自美国PeproTech公司,甲基纤维素半固体培养基及H5100培养基购自加拿大Stem cell公司,枸橼酸铁铵(FAC)、钙荧光素乙酰氧基甲酯(calcein-AM)购自美国Sigma公司,ROS检测试剂盒购自碧云天生物技术公司,AnnexinV-FITC流式细胞术检测试剂盒购自上海美季公司。
1.3 实验方法
1.3.1 细胞培养
1.3.1.1 脐带血单个核细胞(UC-MNCs)提取与培养 新鲜脐血标本肝素抗凝后,采用羟乙基淀粉沉淀法联合Ficoll梯度密度离心法分离UC-MNCs,用完全培养液(含20%胎牛血清、100 U/mL青霉素、100 μg/mL 链霉素和细胞因子 IL-3、IL-6、SCF、FLT-3浓度均为2 μg/L的 RPMI-1640培养液)重悬细胞,以1×106/mL的密度接种于12孔板中。
1.3.1.2 UC-MSCs 培养 用含 15%FBS、100 U/mL青霉素和100 U/mL链霉素的DMEM低糖培养液培养,细胞达到80%~90%融合时,按1∶3进行传代。取第3代UC-MSCs进行实验。
1.3.2 实验分组 分为MNCs-CTL组、MNCs-FAC组、MSCs-CTL组、MSCs-FAC组,每组设3个复孔,实验重复3次。
1.3.3 铁过载模型的建立 MNCs-CTL组、MSCs-CTL组细胞常规培养于DMEM培养液中。MNCs-FAC组、MSCs-CTL组向培养液中添加200 μmol/L的FAC,培养24 h后离心换液,于完全培养液中继续培养。通过测定细胞内不稳定铁池(LIP)的相对水平判断铁过载模型建立是否成功。向MNCs-FAC组和MSCs-FAC组培养液中添加200 μmol/L的FAC培养24 h,细胞内calcein荧光强度分别低于MNCs-CTL组和MSCs-CTL组,说明MNCs-FAC组和MSCs-FAC组细胞内LIP水平相对升高,即细胞外铁进入细胞内造成细胞铁过载,成功建立铁过载模型。
1.3.4 检测方法 观察铁过载的UC-MNCs和UCMSCs细胞内LIP、ROS水平变化;观察铁过载对UCMNCs和UC-MSCs细胞的增殖、分化、凋亡的影响。
1.3.4.1 造血细胞集落计数 收集MNCs-CTL组和MNCs-FAC组的UC-MNCs细胞,并计数。在24孔板中进行培养,每孔中甲基纤维素半固体培养基0.5 mL,加入各组 MNCs,1 ×105个。在 37℃ 5%CO2培养箱中培养7~14 d后,在显微镜下分别对红系祖细胞集落形成单位(CFU-E)、粒—单核系祖细胞集落形成单位(CFU-GM)、爆式红系祖细胞集落形成单位(BFU-E)和混合系祖细胞集落形成单位(CFU-mix)进行计数。
1.3.4.2 各系造血干祖细胞计数 收集 MNCs-CTL组和 MNCs-FAC组的 UC-MNCs 1×106个细胞,用PBS洗涤2次后分别加入10 μL CD33-PE、10 μL GlyA-PE 或 10 μL CD34-PE/CD45-FITC 抗体,阴性对照管加入10 μL PBS,同型对照管加入人鼠抗IgG2-PE 10 μL,室温避光孵育 15 min,再用 PBS 洗涤2次后重悬细胞,上流式细胞仪检测。记录MNCs-CTL组和MNCs-FAC组造血干细胞()、髓系造血细胞()、红系造血细胞(GlyA+)比例和计数。
1.3.4.3 检测铁过载对UC-MSCs增殖功能的影响将MSCs-CTL组和MSCs-FAC组P3代的UCMSCs细胞分别以4×104/孔的密度接种于12孔板上,在37℃的温箱中培养,当细胞达到融合的时候,用胰酶消化传代,按以下公式计算UC-MSCs的倍增时间:DT=CT×log2/log(X1/X0),X0是细胞最初的数量,X1是细胞最终的数量,CT是细胞培养时间。
1.3.4.4 细胞凋亡检测 将4组的 UC-MNCs和UC-MSCs的细胞调整细胞密度为1×106/mL,按照试剂盒说明进行操作。取100 μL细胞悬液于流式管中,加 5 μL Annexin V-FITC 和 10 μL 碘化丙啶(PI),以PBS组为阴性对照,混匀后室温避光孵育15 min,上流式细胞仪检测细胞凋亡率。
1.3.4.5 ROS 测定 根据文献[3]将 MNCs-FAC 组的细胞培养2 d后加入FAC,继续培养24 h,PBS洗涤细胞2次,调整细胞密度为1×106/mL,加入DCFH-DA,使其终浓度为0.5 μmol/L;将 MSCs-FAC组的细胞以1×105/mL的密度接种于6孔板上,加入FAC,继续培养24 h,PBS洗涤细胞两次,加入DCFH-DA,使其终浓度为10 μmol/L;处理细胞15 min后,洗涤细胞3次,每孔加入细胞裂解液700 μL,37℃摇床裂解细胞10 min后将混匀的裂解液加入到96孔板中,在激发波长为488 nm、吸收波长为530 nm下用荧光酶标仪检测荧光强度。
1.5 统计学方法 使用SPSS17.0统计软件,采用独立样本t检验法进行统计学比较,实验结果以表示,P≤0.05为差异有统计学意义。
2 结果
2.1 造血细胞集落计数 MNCs-FAC组各集落形成单位数均低于MNCs-CTL组,差异具有统计学意义(P <0.05)。见图1。
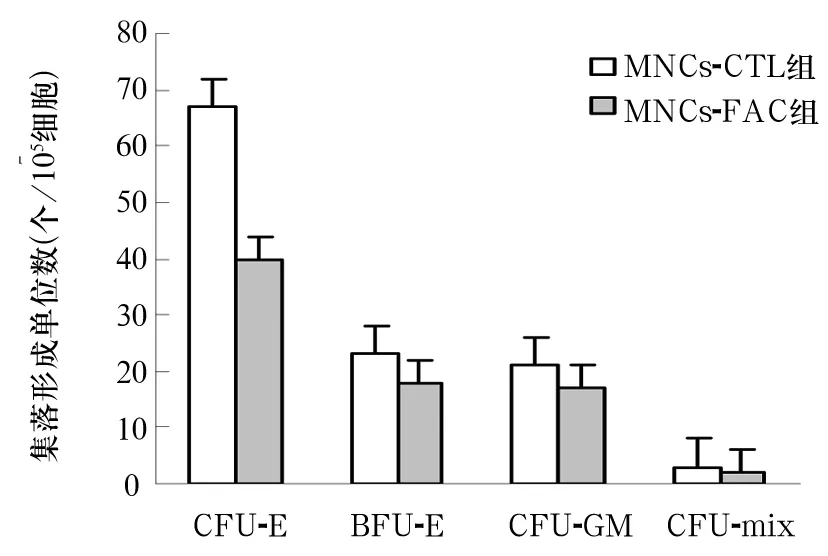
图1 MNCs造血干祖细胞集落形成能力变化
2.2.2 各系造血干祖细胞计数 MNCs-FAC组MNCs细胞数比MNCs-CTL组明显减少,MNCs-FAC组比例和细胞计数均低于MNCs-CTL 组(P 均 <0.05),见表1。
2.3 铁过载对UC-MSCs功能的影响 MSCs-FAC组UC-MSCs的群体倍增时间DT为(24.43±2.72)h,MSCs-CTL 组为(16.03 ± 2.31)h,MSCs-FAC 组DT长于MSCs-CTL组(P<0.05),细胞增殖能力下降。
表1 不同处理组MNCs 、GlyA+细胞比例和计数的变化(n=3,)
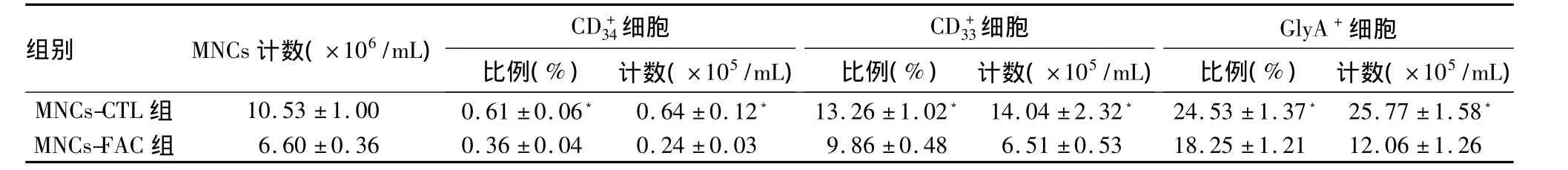
表1 不同处理组MNCs 、GlyA+细胞比例和计数的变化(n=3,)
注:与 MNCs-FAC 组比较,﹡ P <0.05
MNCs-CTL 组 10.53 ±1.00 0.61 ±0.06﹡ 0.64 ±0.12﹡ 13.26 ±1.02﹡ 14.04 ±2.32﹡ 24.53 ±1.37﹡ 25.77 ±1.58)﹡MNCs-FAC 组 6.60 ±0.36 0.36 ±0.04 0.24 ±0.03 9.86 ±0.48 6.51 ±0.53 18.25 ±1.21 12.06 ±1.26
2.4 细胞凋亡的变化 UC-MNCs在200 μmol/L的FAC作用24 h后,MNCs-FAC组凋亡率为(20.903.45)%,MNCs-CTL 组为(9.201.29)%,MNCs-FAC组凋亡率高于MNCs-CTL组(P<0.05)。P3代的UC-MSCs在200 μmol/L的FAC作用24 h后,MSCs-FAC 组的凋亡率为(12.75 ±0.32%),MSCs-CTL组为(3.63±0.80%),MSCs-FAC 组的凋亡率高于 MSCs-CTL组(P <0.05)。
2.5 铁过载脐带血细胞内ROS水平变化 MNCs-FAC组和MSCs-FAC组细胞内ROS水平明显升高,均高于MNCs-CTL组和MSCs-FAC组(P均<0.05)。见图2
3 讨论
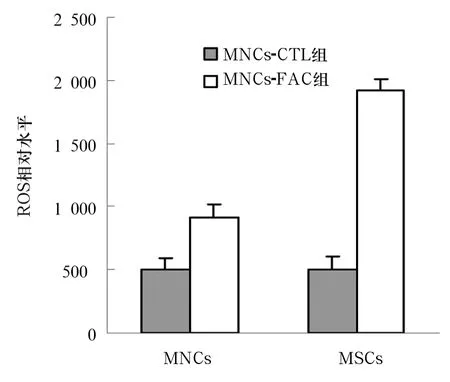
图2 铁过载对脐带血单个核细胞及间充质干细胞ROS水平的影响
一些血液系统疾病如MDS、AA、地中海贫血等需要长期依赖输血,导致铁过载的发生,严重影响患者的治疗效果和预后。研究发现,体外培养地中海贫血患者骨髓的LIP水平和ROS水平明显高于正常人,祛铁处理后,红系祖细胞的细胞质和线粒体中LIP降低,并且与氧化应激(ROS)的减弱相关[4]。因此,明确铁过载对造血功能的影响及其机制对临床改善这些患者的治疗和预后有重要意义。相关研究提示铁过载可造成造血功能的损伤,其机制可能是由于ROS的升高,但是尚缺乏直接的证据证实,如何对造血干祖细胞和造血微环境产生影响也尚不清楚。
脐带血富含造血干祖细胞及MSC。UC-MSC与骨髓来源的MSC相似,具有向成骨细胞、软骨细胞、脂肪细胞等分化潜能,它还可通过细胞接触和分泌细胞因子支持造血。本研究利用体外培养UCMNCs和UC-MSCs的方法检测铁过载对造血细胞及造血支持细胞的影响,在200 μmol/L的FAC中,培养UC-MNCs和UC-MSCs,检测LIP水平增高,提示外源性的铁可进入细胞诱导细胞铁过载。本研究发现,通过FAC促使造血干祖细胞铁过载,MNCs-FAC组的比例和细胞数均明显减低,各系集落形成单位明显降低,凋亡比例明显增加,细胞内ROS水平升高,说明铁过载引起了造血干祖细胞的损伤,诱导ROS升高,可影响造血干、祖细胞的数量、分化及功能,损伤骨髓造血功能。MSCs是造血微环境的重要组成部分,正常的造血微环境使得造血细胞增殖、分化。本研究发现,铁过载使MSCs的增殖能力、造血支持能力下降且凋亡率增加。有研究证明,体内聚集大量的ROS可诱导MSCs的DNA损伤,降低DNA的合成及增殖能力,影响其分化能力,甚至可以诱导细胞衰老[5]。铁过载可造成造血功能的损伤,使造血能力下降,其机制可能是影响了造血干祖细胞的增殖、分化、凋亡以及影响了造血微环境的增殖、凋亡,使其造血支持能力下降。
有文献报道,细胞内LIP诱导ROS生成。铁的动态平衡在许多氧化应激涉及的病理过程中起了重要的作用[6]。细胞内适当水平的ROS在调控一些生物学现象中发挥着重要的作用,包括一些信号通路的激活以及这些信号所涉及的基因的表达。然而,各种原因所致的ROS生成增多直接或间接的破坏正常细胞内的氧化和抗氧化系统的平衡,导致细胞的氧化应激反应[7],从而引起细胞和组织器官的损伤。造血干细胞对非正常的ROS的聚集高度敏感,如果干细胞中ROS长期升高可导致DNA的损伤和老化机制的非正常激活,诱导造血干细胞的老化和凋亡,从而导致造血干细胞再生能力的破坏[8],进而影响造血干细胞的自我更新和定向分化能力。ROS升高通过多种途径影响造血干细胞的数量与活性、自我更新能力和细胞周期变化等。参与其中的信号分子主要有 ATM、FoxO、mTOR和AKT等[8]。已有多项研究发现,ROS大量聚集对支持造血的MSCs同样也具有损伤作用,可影响其增殖、凋亡、分化,近年来,p38MAPK、AKT、p53、ERK等多种信号途径在ROS介导的MSC衰老、凋亡及增殖分化中的作用有相继报道[10,11]。
综上所述,铁过载是促使ROS升高的原因,且ROS升高影响造血干祖细胞增殖、分化和凋亡,对造血支持细胞尤其是MSCs的增殖及造血支持作用造成损伤,影响了造血功能。因此,我们的研究结果旨在为治疗铁过载患者造血功能低下寻找新的靶点(例如祛铁治疗或抗氧化治疗等)提供思路,同时为深入探讨ROS对造血机制的影响提供依据。
[1]Ghoti H,Amer H,Winder A,et al.Oxidative stress in red blood cells,platelets and polymorphonuclear leukocytes from patients with myelodysplastic syndrome[J].Eur J Haematol,2007,79(6):463-467.
[2]Amer J,Goldfarb A,Fibach E.Flow cytometric measurement of reactive oxygen species production by normal and thalassaemic red blood cells[J].Eur J Haematol,2003,70(2):84-90.
[3]Wang G,Gong Y,Burczynski FJ,et al.Cell lysis with dimethyl sulphoxide produces stable homogeneous solutions in the dichlorofluorescein oxidative stress assay[J].Free Radic Res,2008,42(5):435-441.
[4]Prus E,Fibach E.Effect of iron chelators on labile iron and oxidative status of thalassaemic erythroid cells[J].Acta Haematol,2010,123(1):14-20.
[5]Ko E,Lee KY,Hwang DS.Human umbilical cord blood-derived mesenchymal stem cells undergo cellular senescence in response to oxidative stress[J].Stem Cells Dev,2012,21(11):1877-1886.
[6]Bendova P,Mackova E,Haskova P,et al.Comparison of clinically used and experimental iron chelators for protection against oxidative stress-induced cellular injury[J].Chem Res Toxicol,2010,23(6):1105-1114.
[7]Naka K,Muraguchi T,Hoshii T,et al.Regulation of reactive oxygen species and genomic stability in hematopoietic stem cells[J].Antioxid Redox Signal,2008,10(11):1883-1894.
[8]Ghaffari S.Oxidative stress in the regulation of normal and neoplastic hematopoiesis[J].Antioxidants Redox Signaling,2008,10(11):1923-1940.
[9]Ito K,Hirao A,Arai F,et al.Regulation of oxidative stress by ATM is required for self-renewal of haematopoietic stem cells[J].Nature,2004,431(1011):997-1002.
[10]Mimeault M,Batra SK.Recent insights into the molecular mechanisms involved in aging and the malignant transformation of adult stem/progenitor cells and their therapeutic implications[J].Ageing Res Rev,2009,8(2):94-112.
[11]卢文艺,赵明峰.氧化应激对骨髓间充质干细胞的影响[J].中国医学科学院学报,2012,34(1):90-94.
