超声波辅助提取和田玉枣c A MP的工艺研究
2013-09-04王立霞
王立霞
(陕西学前师范学院,陕西西安710100)
环磷酸腺苷(Adenosine 3’,5’-cyclic monophosphate,简称cAMP,结构见图1)普遍存在于哺乳动物体内,控制并调节细胞新陈代谢[1-3],1957年由Sutherland发现。医学研究证实至少40多种疾病(癌症、高血压、冠心病、心源性休克和心肌梗赛等重大疾病)与cAMP代谢有关,cAMP是枣中重要活性物质。据报道,枣成熟果肉中cAMP含量为一般动植物数千至数万倍,具重要开发价值[4-7]。我国枣面积已达150万公顷,产量200万t,新疆和田地区凭借其独特资源优势,近年枣业发展迅速,面积达30多万公顷[8]。本文作者已对不同产地、不同含水量、不同组织骏枣、灰枣中cAMP含量进行研究,并得出结果和田玉枣(山西省交城县骏枣引种于和田后其商品名称为和田玉枣)中cAMP含量相对最高。关于cAMP的提取方法,以往多用传统溶剂法,本研究引入了超声波辅助法,并对这两种方法进行对比,以获取超声波辅助提取和田玉枣cAMP的最优工艺参数。本研究成果为和田玉枣及其他枣品种cAMP深入研究及其开发利用提供参考及理论依据。
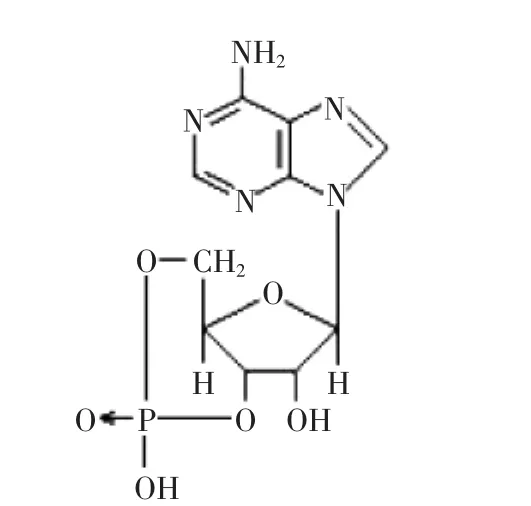
图1 环磷酸腺苷结构图Fig.1 Structural of the cAMP
1 材料与方法
1.1 材料与仪器
红枣 新疆和田玉枣,系2012年10月中旬采摘后烘干的干枣,和田玉枣去核后经40℃干燥,粉碎过60目筛,室温下密封保存,待用;cAMP标准品(纯度≥99%)色谱纯,德国Sigma公司;甲醇(纯度为99.8%)色谱纯,加拿大Promptar公司生产;其余试剂 均为分析纯。
1525型高效液相色谱仪 美国Waters公司;TDL-5型低速大容量离心机 上海安亭科学仪器有限公司生产;UV2550型紫外可见分光光度计 日本Shimadzu公司;JY98-3D型超声波细胞粉碎机 宁波新芝生物科技股份有限公司。
1.2 实验方法
1.2.1 高效液相色谱检测条件 色谱柱:Brava-BDS C18(250mm×4.6mm,5μm)柱;流动相:甲醇∶pH为3的双蒸水(10∶90,V/V);流速0.8mL/min;经紫外全波长扫描确定检测波长为257.0nm;温度为室温;进样量20μL[8-11]。
1.2.2 cAMP标准品溶液的制备及标准曲线的制作精密称取cAMP标品2.5mg,置50mL容量瓶中,加流动相至刻度,摇匀,得0.05mg/L cAMP标品溶液。分别精密吸取标品溶液1、2、3、4、5、6、7、8mL于10mL容量瓶中,加流动相至刻度,摇匀,得5、10、15、20、25、30、35、40μg/mL的系列标准品溶液,分别精密吸取20μL系列标品溶液注入色谱仪,记录色谱图,以浓度为横坐标,以cAMP峰面积为纵坐标进行线性回归,得线性方程Y=21592x-4372.7(r=0.9999)[8-10]。
1.2.3 乙醇体积分数对红枣cAMP提取量的影响实验 准确称取和田玉枣粉2g,室温下,分别以液料比15∶1用浓度为5%、15%、25%、35%、45%、55%乙醇溶解,每个水平重复3次。采用传统溶剂浸提法提取,分别在40℃水浴中加热10h,所得溶液离心、过滤、真空浓缩后用双蒸水定容,过0.45μm滤膜,进样分析,依保留时间法对待分析组分进行定性,以峰面积外标法定量[8-9]。测定不同体积分数乙醇中提取物的提取量(μg/g·dw(干重))。

1.2.4 超声波提取条件对红枣cAMP提取量的影响实验 经文献[12-15]研究可知,影响超声波辅助提取效果的主要因素有超声波提取功率、提取温度、提取时间及液料比,因此先对以上4因素进行单因素实验分析,得出较理想的因素水平,然后再通过正交实验设计,确定最佳提取工艺参数[6-12]。除超声波辅助提取功率单因素实验外,在进行超声波辅助法提取其他单因素实验的同时,与传统溶剂法浸提实验进行对比。
1.2.4.1 超声波功率对红枣cAMP提取量的影响实验准确称取和田玉枣粉2g,室温下,以液料比15∶1加入15%乙醇溶液中,提取温度40℃,分别在200、300、400、500、600、700W的功率下超声30min,每个水平重复3次。分别测定提取物的提取量(μg/g·dw),确定最佳提取功率。
1.2.4.2 提取时间对红枣cAMP提取量的影响实验准确称取和田玉枣粉2g,以液料比15∶1加入15%乙醇溶液中,固定超声波提取温度40℃,提取功率为400W,提取时间分别为 10、30、50、70、90、110min,每个水平重复3次。分别测定提取物的提取量(μg/g·dw),确定最佳提取时间。
1.2.4.3 提取温度对红枣cAMP提取量的影响实验准确称取和田玉枣粉2g,以液料比15∶1加入15%乙醇溶液中,固定超声波提取功率为400W,提取时间为50min,提取温度分别为25、35、45、55、65、75℃,每个水平重复3次。分别测定提取物的提取量(μg/g·dw),确定最佳提取温度。
1.2.4.4 液料比对红枣cAMP提取量的影响实验 准确称取和田玉枣粉2g,分别以液料比10∶1、15∶1、20∶1、25∶1、30∶1、35∶1加入15%乙醇溶液中,固定超声波提取功率为400W,提取时间为50min,提取温度为35℃,每个水平重复3次。分别测定提取物的提取量(μg/g·dw),确定最佳液料比。
1.2.4.5 正交实验 在单因素实验基础上对超声波提取温度、提取时间、液料比、超声波功率采用L9(34)正交实验进行优选,以确定最佳提取条件,因素水平设计见表1。
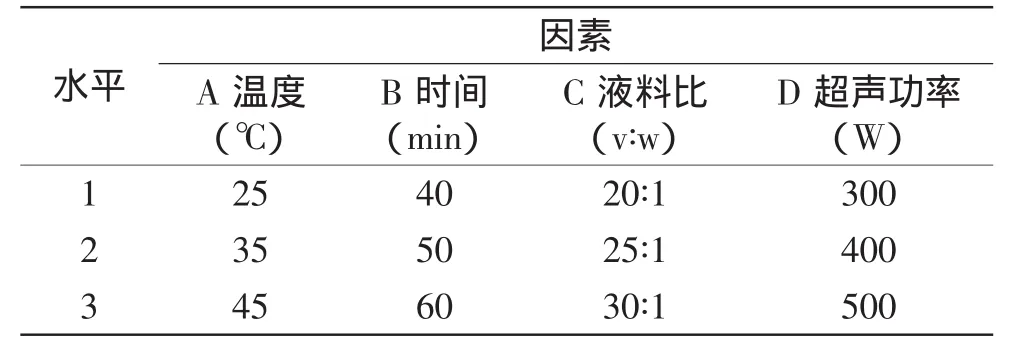
表1 L9(34)实验因素水平表Table 1 L9(34)Orthogonal factor level table
2 结果与分析
2.1 乙醇体积分数对红枣cAMP提取量的影响
乙醇体积分数对红枣cAMP提取量的影响见图2。图2表明,随着乙醇体积分数的增加,cAMP的提取量呈先增大加后缓慢减小趋势。在乙醇体积分数为15%时,cAMP提取量达到最高,为542.33μg/g·dw,考虑能量节省及减少污染等因素,乙醇体积分数以15%为宜。
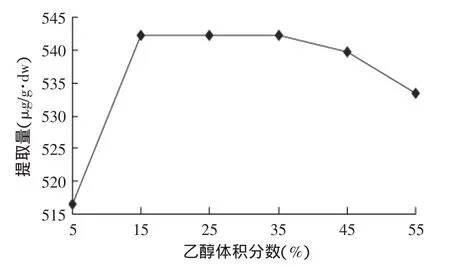
图2 乙醇体积分数对cAMP提取量的影响Fig.2 Effect of ethanol volume fraction on extracting content of cAMP
2.2 超声波提取条件对红枣cAMP提取量的影响
2.2.1 超声波功率对红枣cAMP提取量的影响 超声波功率对红枣cAMP提取量的影响见图3。图3表明,当超声波功率在200~400W时,cAMP提取量随超声波功率的增大而迅速增加,在功率为400~700W时,cAMP提取量分别为553.56、554.57、555.69、555.80μg/g·dw,提取量增加非常平缓。考虑到功率过大可能会影响物质结构,并加重设备负担,因此选择超声波提取功率为400W。
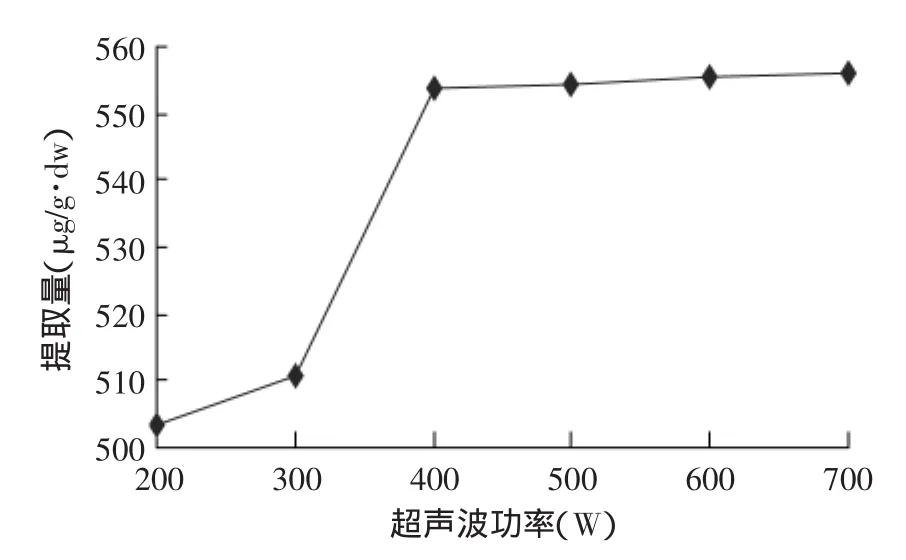
图3 超声波提取功率对cAMP提取量的影响Fig.3 Effect of power of ultrasonic wave on extracting content of cAMP
2.2.2 提取时间对红枣cAMP提取量的影响 提取时间对红枣cAMP提取量的影响见图4。图4表明,同等条件下,超声波辅助提取法较传统溶剂法提取效率高,优势明显。当提取时间为10~50min时,两种方法cAMP提取量均呈增加趋势,提取时间为50min时,超声波提取法提取量为559.92μg/g·dw;当提取时间超过50min时,超声波提取法cAMP提取量趋于平衡,考虑到时间过长会耗能及对仪器造成不良影响,故选择超声波辅助提取时间为50min。

图4 提取时间对cAMP提取量的影响Fig.4 Effect of extracting time on extracting content of cAMP
2.2.3 提取温度对红枣cAMP提取量的影响 提取温度对红枣cAMP提取量的影响见图5。图5表明,同等条件下,超声波辅助提取法较传统溶剂法提取效率高,优势明显。在超声波辅助提取法中,cAMP提取量随提取温度的升高呈先增加后减少趋势,当提取温度为35℃时,提取量最高,为678.58μg/g·dw,故选择超声波辅助提取温度为35℃。
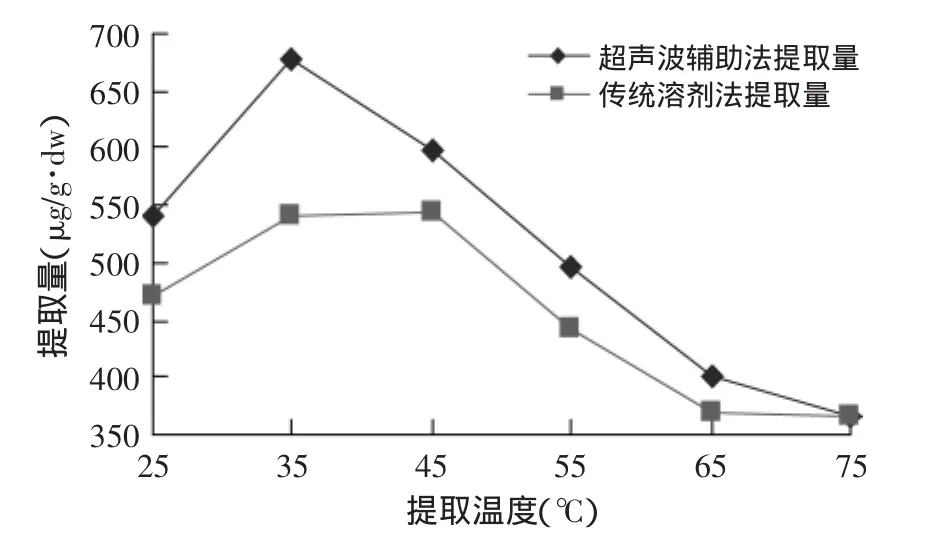
图5 提取温度对cAMP提取量的影响Fig.5 Effect of extracting temperature on extracting content of cAMP
2.2.4 液料比对红枣cAMP提取量的影响 液料比对红枣cAMP提取量的影响见图6。图6表明,同等条件下,超声波辅助提取法较传统溶剂法提取效率高,优势明显。当液料比低于25∶1时,cAMP提取量随液料比的增加而快速增大,当液料比为25∶1时,cAMP提取量为689.87μg/g·dw;高于25∶1时,cAMP的提取量趋于平衡。综上分析,超声波辅助提取样品中cAMP的液料比以25∶1为宜。
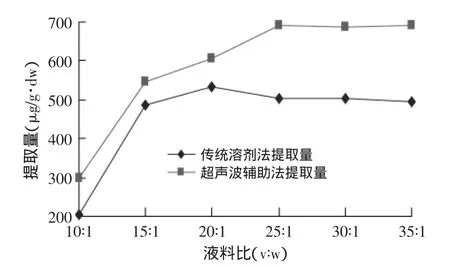
图6 液料比对cAMP提取量的影响Fig.6 Effect of liquid-solid ratio on extracting content of cAMP
2.2.5 正交实验按L9(34)进行正交实验,结果及数据处理见表2。由极差分析可知,各因素对cAMP提取量影响程度的大小顺序为:提取温度>液料比>提取时间>超声波功率。和田玉枣中cAMP的最优提取工艺为A2B2C1D2,提取温度35℃、提取时间50min、液料比20∶1、超声波功率400W。
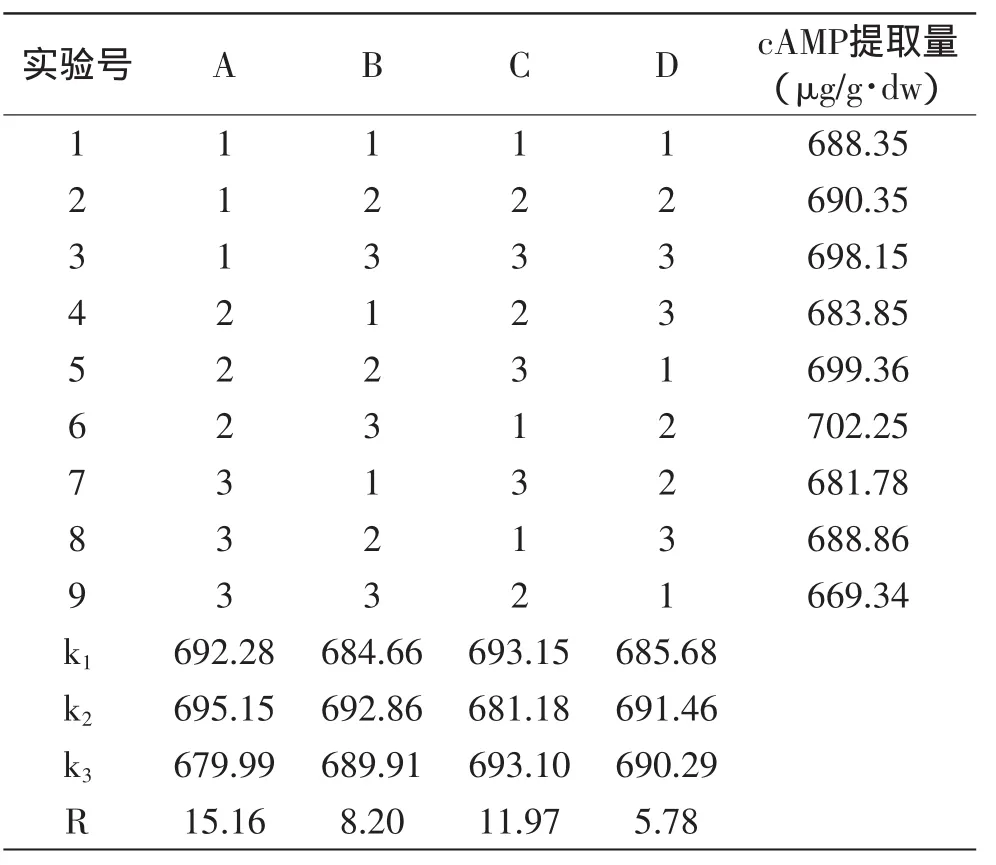
表2 正交实验结果Table 2 Result of orthogonal experiment
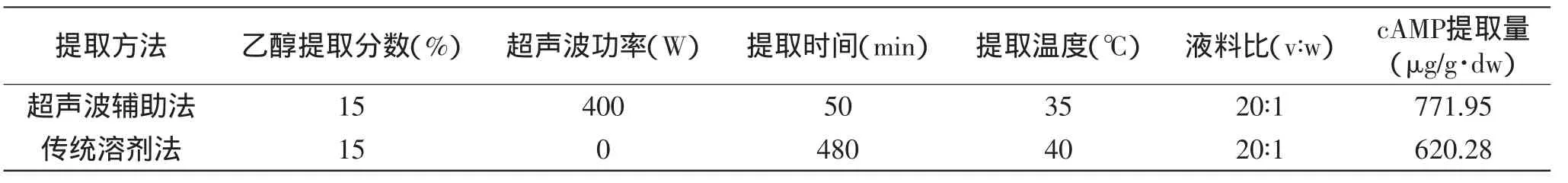
表3 两种提取方法比较Table 3 Comparison of different extraction methods
2.3 提取方法比较
采用传统溶剂法[9]提取和田玉枣cAMP,并与2.2.5中得出的超声波辅助提取法最优工艺条件下的结果进行对比。两种方法的工艺条件及实验结果见表3。表3显示,超声波辅助提取法提取效果明显优于传统溶剂提取法。
3 结论
本研究通过单因素和正交实验分析,确定了超声波辅助提取和田玉枣cAMP的最优工艺条件为:乙醇体积分数15%,提取温度35℃、提取时间50min、液料比20∶1、超声波功率400W。在此工艺条件下,和田玉枣cAMP平均提取量为771.95μg/g·dw;影响和田玉枣cAMP提取量的各因素的显著顺序为:提取温度>液料比>提取时间>超声波功率。
通过对两种提取方法的比较,得知超声波辅助法与传统溶剂浸提法相比,具有提取速度快,提取量高,提取温度低等明显优势。
[1]程功,白焱晶,赵玉英.枣属植物化学成分及药理活性研究概况[J].国外医药·植物药分册,1999,14(4):151-157.
[2]何峰,潘勤,闵知大.枣属植物化学成分研究进展[J].国外医药·植物药分册,2005,20(1):1-5.
[3]党立,王希敏,韩利文,等.环磷酸腺苷的临床应用进展[J].山东科学,2007,20(3),61-64.
[4]姜晶.植物细胞cAMP信使系统[J].植物生理学通讯,2006,42(2):343-348.
[5]Jyong-Chycl Cyong,Kiyomichi Hanabusa.Cyclic adenosine monophosphate in fruits of zizyphus jujuba[J].Pergamon Press Ltd Printed in England,1980(19):2747-2748.
[6]K Hanabusa,J Cyong,M Takahashi.High-Level of Cyclic AMP in the Jujube Plum[J].Hippokrates Verlag GmbH,1981,42:380-384.
[7]刘孟军,王永惠.枣和酸枣等14种园艺植物cAMP含量的研究[J].河北农业大学学报,1991,14(4):20-23.
[8]王立霞.和田玉枣cAMP的分析检测方法的研究[J].食品科技,2011(7):303-306.
[9]王立霞,陈锦屏,张娜,等.和田玉枣中cAMP提取工艺的研究[J].食品工业科技,2009(10):234-236.
[10]王立霞,陈锦屏,张娜,等.和田玉枣中环磷酸腺苷(cAMP)的分离纯化工艺研究[J].食品科学,2008(12):250-254.
[11]吴世斌.高效液相色谱法测定环磷酸腺昔及其制剂的含量[J].中国生物药物杂志,2001,22(1):32-33.
[12]陈晓明.超声波辅助提取木薯皮活性物质工艺[J].农业工程学报,2011,27(5):389-396.
[13]胡斌杰.超声波法与传统热水法提取灵芝多糖的比较研究[J].食品工业科技,2007,28(2):190-192.
[14]马亚琴.超声波辅助提取植物活性成分的研究进展[J].食品科学,2010,31(21):459-463.
[15]李粉玲,蔡汉权,陈桐滨,等.超声波辅助提取木棉花多糖[J].湖北农业科学,2012,51(6):1214-1217.
