斑玉蕈多糖的酶辅助提取及其抗氧化活性分析
2013-09-04陈安徽朱园园张娜娜
郑 义,邵 颖,陈安徽,朱园园,张娜娜
(1.徐州工程学院食品(生物)工程学院,江苏徐州221000;2.江苏省食品资源开发与质量安全重点建设实验室,江苏徐州221000)
斑玉蕈(Hypsizigus marmorens),隶属担子菌亚门、层菌纲、伞菌目、白蘑科、玉蕈属,是一种珍稀药食兼用菌。斑玉蕈提取物对S180肿瘤、MethA纤维肉瘤、Lewis肺癌、HepG2等肿瘤均有明显的抑制作用[1-4],还具有抗氧化、免疫调节、降血脂等作用[5-6]。多糖是真菌的主要活性成分之一,目前已经上市的真菌多糖类保健品有上百种,在临床上正式应用的有香菇多糖、云芝多糖和裂褶菌多糖等多种,而未见有以斑玉覃多糖为主要成分的药品及保健品。目前有关斑玉覃多糖的提取主要以热水(或碱液)浸提法为主[7-8],存在费时、耗能高、多糖活性损失较大等问题。酶辅助提取是近几年发展起来的一种新技术,酶处理可以提高多糖的得率,同时保持多糖的构象与生物活性[9],目前尚未见应用于斑玉覃多糖提取的报道。多糖提取率受到酶解温度、pH、酶添加量等多种因素的影响,需要对提取工艺进行优化。本实验采用酶辅助提取斑玉覃多糖,对提取工艺及抗氧化活性进行研究,旨在为开发以斑玉覃多糖为主要成分的中药及保健品提供基础。
1 材料与方法
1.1 材料与仪器
斑玉蕈子实体 江苏徐州市售;木瓜蛋白酶(酶活≥100000U/g)、纤维素酶(酶活≥11000U/g)均为食品级,购自江苏无锡;1,1-二苯基-2-三硝基苯肼(DPPH)Sigma公司;其他试剂 均为国产分析纯。
TU-1810型紫外-可见分光光度计 北京普析通用仪器有限责任公司;THZ-82型恒温振荡器 常州国华电器有限公司;标准检验筛 浙江上虞华美仪器纱筛厂;风选中药粉碎机 山东省青州市精诚机械制造有限公司;FA2104N型电子分析天平 上海精密科学仪器有限公司;SENCO R201L型旋转蒸发器 上海申生科技有限公司;TGL-20M型高速冷冻离心机 长沙湘仪离心机仪器有限公司。
1.2 实验方法
1.2.1 酶法提取斑玉蕈多糖 将新鲜斑玉蕈用清水洗净,除去其根部,适当切段于60℃干燥箱干燥,待斑玉蕈恒重,放入粉碎机中粉碎,过60目筛,干燥保存待用。准确称取2g斑玉蕈干粉,溶于一定体积的柠檬酸-柠檬酸钠缓冲溶液中,预热至酶解温度,加入一定量的复合酶(木瓜蛋白酶和纤维素酶按1∶1质量比例配合),恒温振荡器中提取一定时间。提取结束后沸水浴灭酶10min,冷却,减压抽滤,滤液浓缩后在4℃下用70%乙醇沉析12h、离心,所得沉淀用无水乙醇洗涤3次,冷冻干燥后得斑玉蕈多糖。
1.2.2 多糖含量测定 多糖含量测定采用苯酚-硫酸法[10]。
多糖得率(%)=斑玉蕈多糖质量/斑玉蕈干粉质量×100。
1.2.3 单因素实验 考察复合酶添加量(复合酶质量占斑玉蕈粉质量的百分比)、pH、酶解温度、提取时间对多糖得率的影响,每组实验重复3次,取其平均值。
1.2.4 Box-Behnken实验设计 在单因素实验的基础上,采取Box-Behnken实验设计安排四因素三水平实验,实验因素水平表如表1所示。每组实验重复3次,取其平均值。
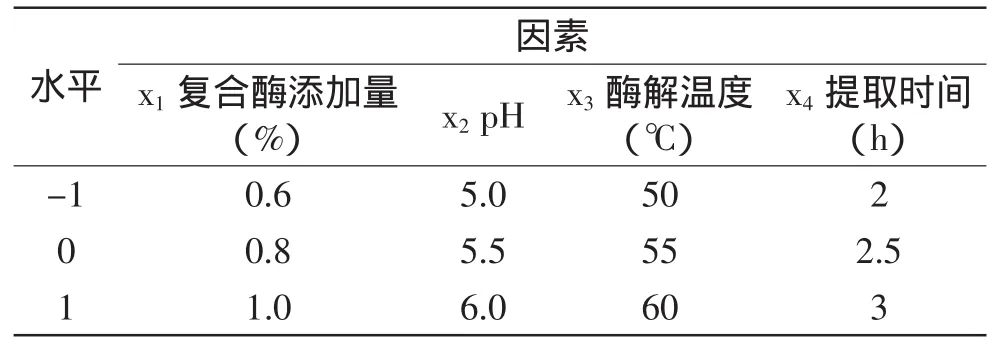
表1 Box-Behnken实验因素水平表Table 1 Factors and levels of Box-Behnken experiments
1.2.5 抗氧化活性测定
1.2.5.1 DPPH自由基清除率测定 DPPH自由基清除率测定参考Wu[11]的方法,重复3次,取平均值。
1.2.5.2 还原力测定 还原力测定采用铁氰化钾法,参考Oyaizu[12]的方法,重复3次,取平均值。
1.2.5.3 羟基自由基清除率测定 羟基自由基清除率测定采用邻二氮菲比色法[13],重复3次,取平均值。
2 结果与分析
2.1 单因素实验
2.1.1 复合酶添加量对多糖得率的影响 固定pH5.0,酶解温度50℃,提取时间2h,考察不同复合酶添加量对多糖得率的影响,结果见图1。由图1可知,多糖得率随酶添加量增加而递增,复合酶质量分数大于0.8%后,提取增加率趋于平缓,这是因为浸提体系中复合酶已接近饱和状态,致使多糖得率增长平缓。考虑酶的成本,宜将复合酶质量分数确定为0.8%左右。
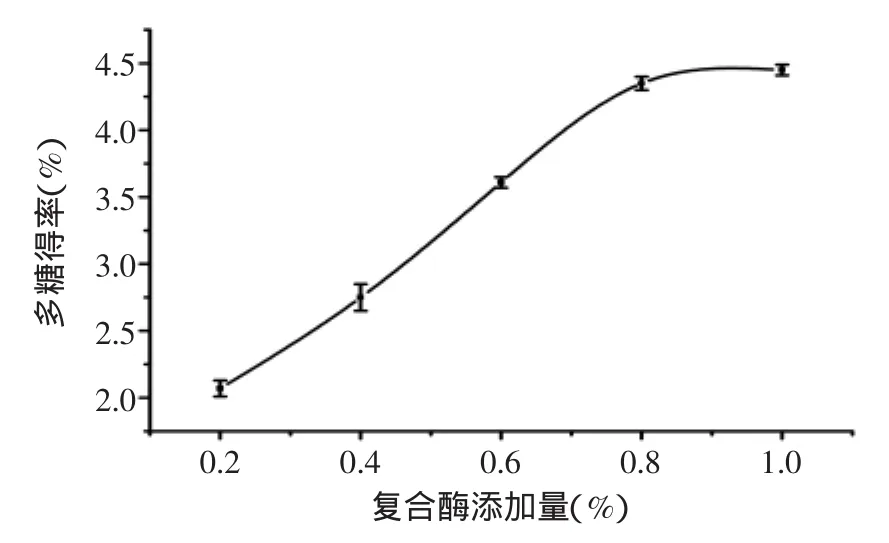
图1 复合酶添加量对多糖得率的影响Fig.1 Effect of complex enzyme amount on the yield of polysaccharides
2.1.2 pH对多糖得率的影响 固定复合酶添加量0.8%,酶解温度50℃,提取时间2h,考察不同pH对多糖得率的影响,结果见图2。多糖得率随着pH的升高,先急剧增加后减少,这表明复合酶催化水解斑玉蕈细胞壁较适宜的pH范围为5.0~6.0,低于或高于适宜pH时,酶的活性降低,从而导致多糖得率降低。在pH5.5附近时,多糖得率相对较高,故选择较优pH为5.5。
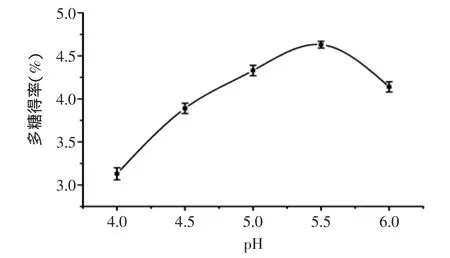
图2 pH对多糖得率的影响Fig.2 Effect of enzymolysis pH value on the yield of polysaccharides
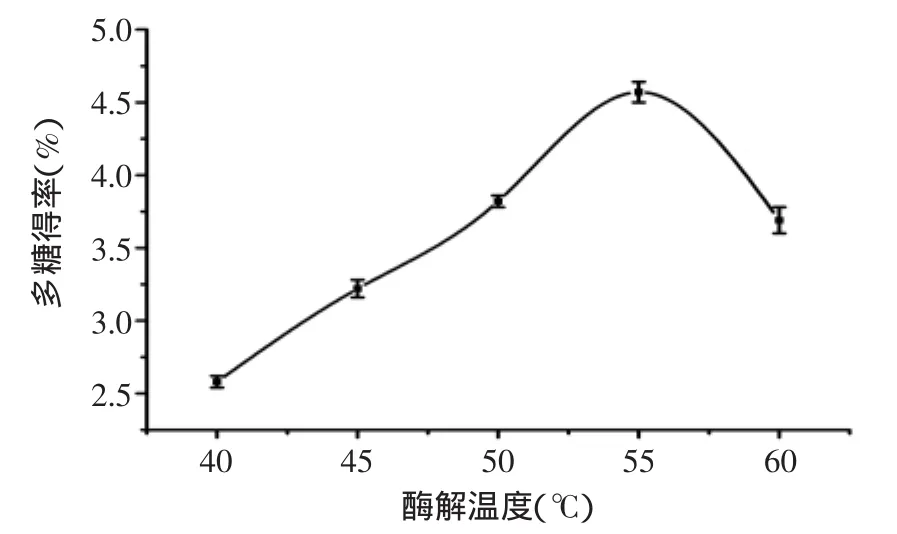
图3 酶解温度对多糖得率的影响Fig.3 Effect of enzymolysis temperature on the yield of polysaccharides
2.1.3 酶解温度对多糖得率的影响 固定复合酶添加量0.8%,pH5.0,提取时间2h,考察不同酶解温度对多糖得率的影响,结果见图3。由图3可知,多糖得率在40~55℃呈显著增加的趋势,这是因为温度越高,浸提体系溶液的粘度越低,有助于胞内多糖分子向外扩散。但温度大于55℃后,酶活受到抑制,多糖得率急剧下降,故选择55℃为酶解温度较优值。
2.1.4 提取时间对多糖得率的影响 固定复合酶添加量0.8%,pH5.0,酶解温度50℃,考察不同提取时间对多糖得率的影响,结果见图4。多糖得率随提取时间的延长逐渐增大,提取时间在1.0~2.5h之间,多糖得率显著增加,当时间超过2.5h后,提取增加率趋于平缓,表明大部分斑玉蕈多糖都已浸出,考虑到能耗,故选较优提取时间为2.5h。
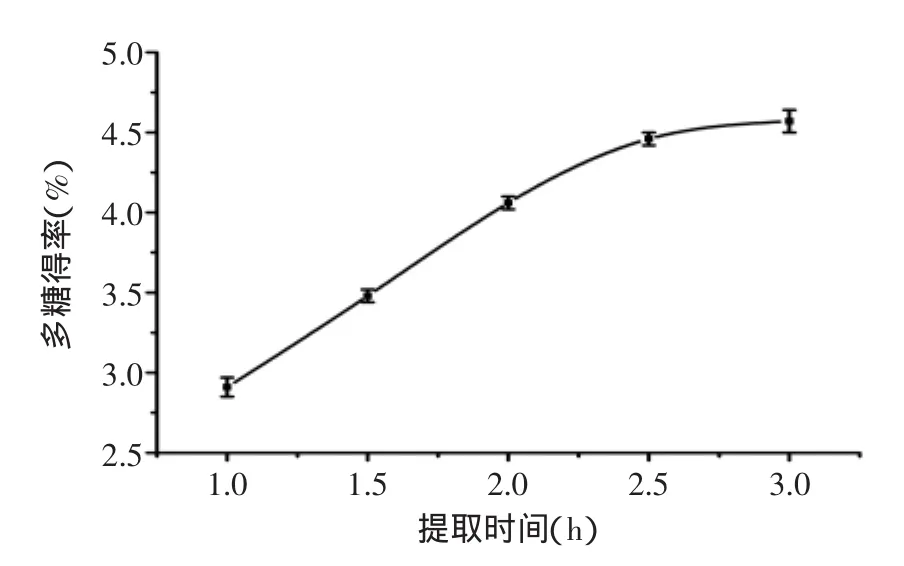
图4 提取时间对多糖得率的影响Fig.4 Effect of extraction time on the yield of polysaccharides
2.2 Box-Behnken实验设计
Box-Behnken实验设计结果如表2所示。
2.2.1 回归模型的建立与检验 对表2实验数据用多元回归拟合后,得到多糖得率(Y)与复合酶添加量(x1)、酶解pH(x2)、酶解温度(x3)和提取时间(x4)的回归方程:

对该回归方程进行方差分析,结果见表3。
该模型达到极显著水平(p<0.01),失拟项不显著(p>0.05),决定系数R2为0.9566,校正决定系数R2Adj为0.9132,信噪比RSN为14.92,可知该回归方程拟合度和可信度均很高,故可用于设计范围内的预测。各因素对斑玉蕈多糖得率的影响大小为:复合酶添加量>提取时间>酶解pH>酶解温度。
对表3回归模型系数的显著性分析可见,一次项中,x1、x4极显著(p<0.01),x2、x3达到显著水平(p<0.05);平方项的回归系数均极显著,说明各因素与多糖得率之间存在明显的二次关系;二次项中仅有x1x4的回归系数均达到显著水平,表明复合酶添加量与提取时间之间的交互作用对斑玉蕈多糖的得率有显著影响。如将不显著项全部剔除,会导致回归模型发生改变[14],故保留p<0.25的各项,简化后的回归方程为式(2):
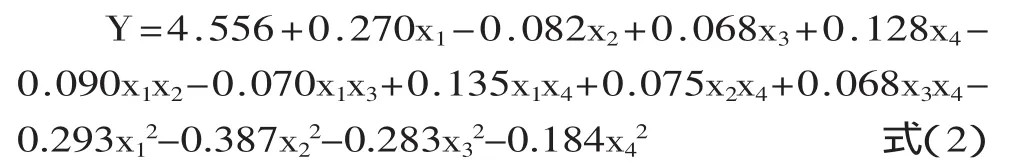
2.2.2 两因素间的交互效应分析 由表3可知,仅复合酶添加量与提取时间的交互作用对斑玉蕈多糖的得率有显著影响,固定酶解温度和pH于零水平,绘出符合酶添加量与提取时间的交互效应的响应面,如图5所示。多糖得率随复合酶添加量和提取时间的变化会产生较大变化。当复合酶添加量处于较低水平(<0.8%)时,多糖得率随着提取时间的延长先明显增加后又呈现出下降趋势;当复合酶添加量处于较高水平(>0.8%)时,多糖得率随着提取时间的延长逐渐提高,而当提取时间超过2.8h后,多糖得率趋于缓慢下降。若要获得较高的多糖得率,复合酶添加量应该在0.8%~1.0%之间,提取时间应该在2.5~3.0h之间。
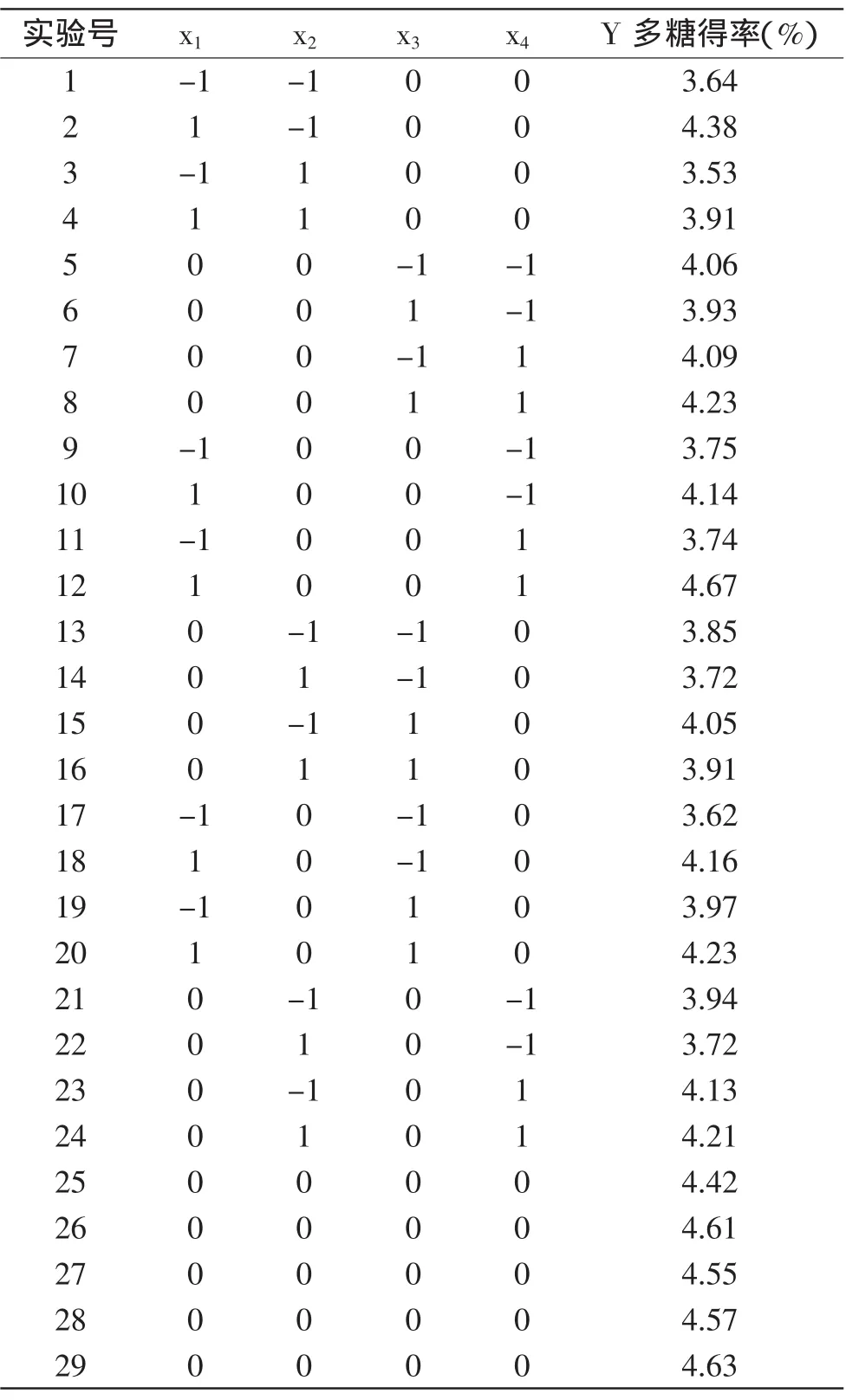
表2 实验设计及结果Table 2 Design and results of experiments
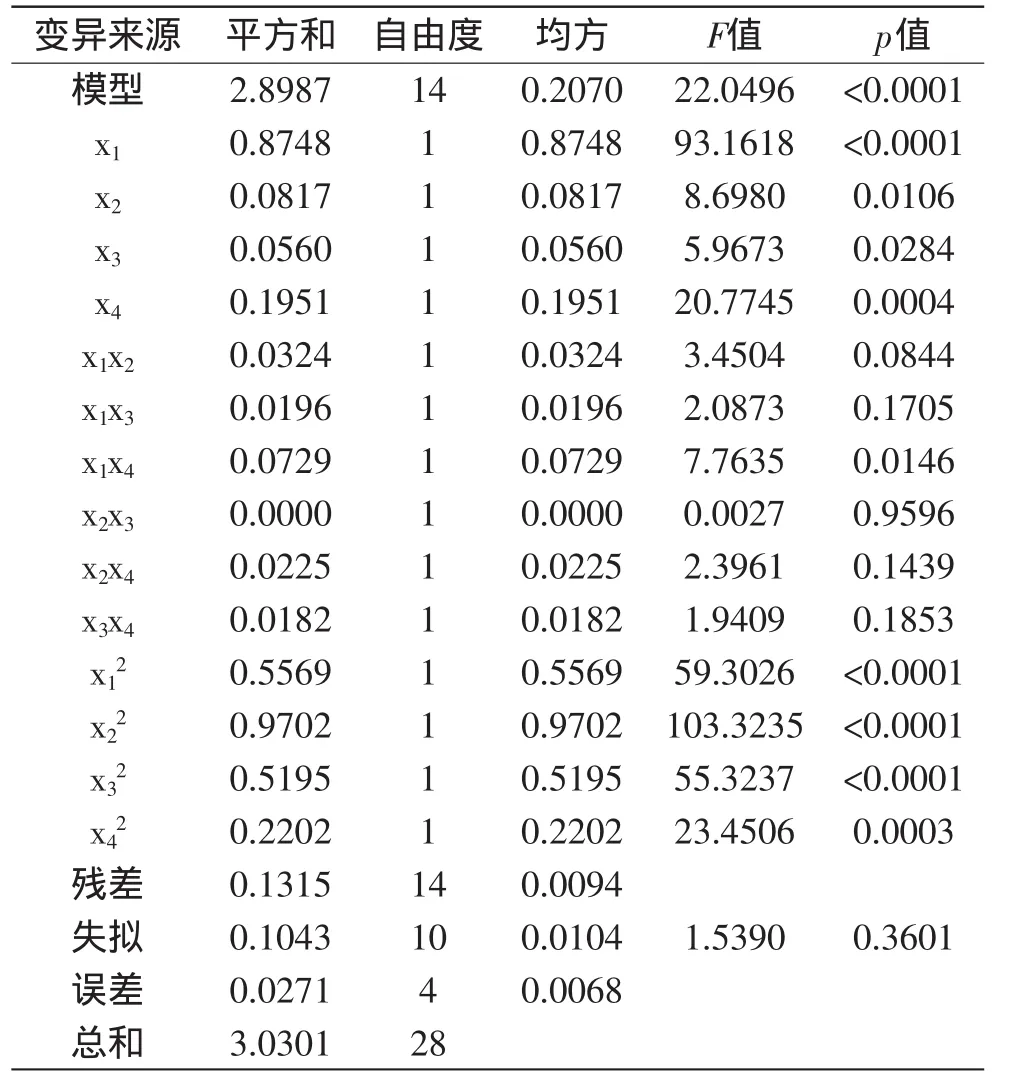
表3 回归模型方差分析Table 3 Analysis of variance with regression model
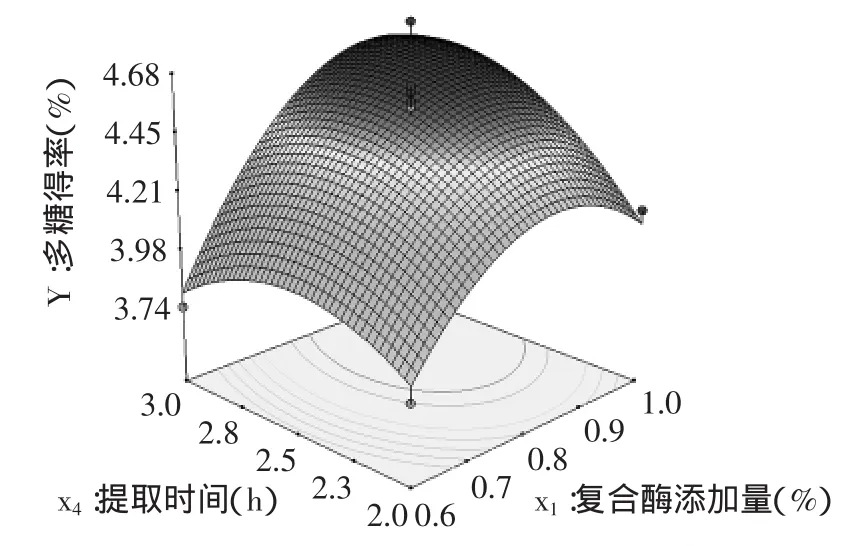
图5 复合酶添加量与提取时间的交互效应对多糖得率的影响Fig.5 Interactive effect of complex enzyme amount and extraction time on the yield of polysaccharides
2.2.3 最佳条件优化及验证结果 通过所得回归模型对提取工艺进行优化,得到最佳提取工艺条件为:复合酶添加量0.9%、酶解pH5.4、酶解温度55.6℃、提取时间2.8h,在此条件下多糖得率的最大理论值为4.68%。对此优化条件进行验证,重复3次,实测平均得率为4.70%;对该工艺进一步放大,取200g斑玉蕈干粉提取多糖,实测得率为4.72%,与预测值基本一致,表明该回归模型具有较好的预测性能,可用于指导生产实践。
2.3 斑玉蕈多糖的抗氧化活性

图6 斑玉蕈多糖对DPPH自由基的清除作用Fig.6 Scavenging effects of polysaccharides from Hypsizigus marmoreus against DPPH radicals
2.3.1 清除DPPH自由基的能力 DPPH法是评价抗氧化活性的常用方法,抗氧化物质可直接作用于DPPH自由基,使其颜色变浅,根据吸光度的变化可测定物质的抗氧化活性。由图6可知,在测定的质量浓度范围,斑玉蕈多糖对DPPH自由基的清除能力随质量浓度增大而增大,且呈良好的线性正相关,线性方程为:y=4.2263+0.5831x,R2=0.9823。以半数效应浓度(IC50值),即清除率为50%时的样品质量浓度,作为评价抗氧化能力的指标,由线性方程得斑玉蕈多糖清除DPPH自由基的IC50值为78.5μg/mL。
2.3.2 还原力 抗氧化物质的抗氧化活性与其还原力存在着直接的联系,还原力越强,抗氧化性越强。铁氰化钾法测定原理为:亚铁氰化钾被样品还原为铁氰化钾,铁氰化钾与Fe3+形成普鲁士蓝,在700nm处有最大吸收峰,吸光度越大,则样品的还原力越强。在50~250μg/mL的质量浓度范围内,斑玉蕈多糖的还原力随着浓度的增加而增加,当浓度为250μg/mL时,吸光度最大为0.382±0.01。
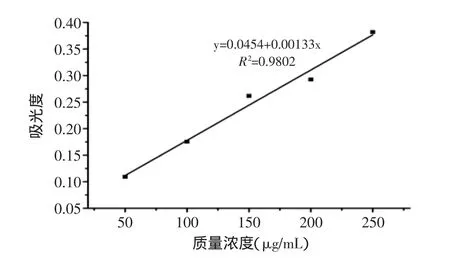
图7 斑玉蕈多糖的还原力Fig.7 Reducing power of polysaccharides from Hypsizigus marmoreus
2.3.3 清除羟基自由基的能力 羟基自由基是已知活性最强的活性氧自由基,可夺取蛋白质、核酸等生物大分子的氧原子,引起机体损伤,清除羟基自由基可能是生物体抵御疾病的最有效方式之一。斑玉蕈多糖对羟基自由基的清除作用如图8所示,在50~250μg/mL的质量浓度范围内,斑玉蕈多糖对羟基自由基的清除能力随质量浓度增大而增大,且呈线性正相关,线性方程为:y=-8.4173+0.3427x,R2=0.9802,IC50值为170.5μg/mL。
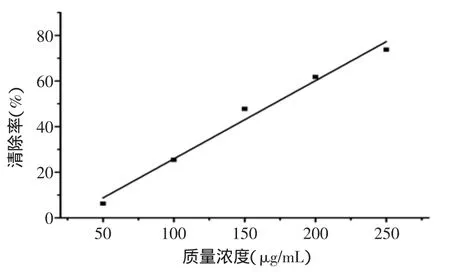
图8 斑玉蕈多糖对羟基自由基的清除作用Fig.8 Scavenging effects of polysaccharides from Hypsizigus marmoreus against hydroxyl radicals
3 结论
本研究建立了酶辅助提取斑玉蕈多糖的最佳工艺条件,即复合酶(木瓜蛋白酶和纤维素酶按1∶1质量比例配合)添加量0.9%、酶解pH5.4、酶解温度55.6℃、提取时间2.8h,在此条件下多糖得率的最大理论值为4.68%。对此优化条件进行验证,重复3次,实测平均得率为4.70%,从实测多糖得率看,酶辅助提取优于传统的热水浸提法,比热水浸提得率3.38%(由本实验室测得)高1.32%。
斑玉蕈多糖具有较好的抗氧化活性,在一定范围内,其抗氧化能力与多糖质量浓度呈线性正相关,清除DPPH和羟基自由基的IC50值分别为78.5μg/mL和170.5μg/mL。
[1]Ikekawa T,Saitoh H,Feng W J,et al.Antitumor activity of Hypsizigus marmoreusⅠ:Antitumor activity of extracts and polysaccharides[J].Chem Pharm Bull,1992,40(7):1954-1957.
[2]Saitoh H,Feng W J,Matsuzawa T.Antitumor activity of Hypsizigus marmoreusⅡ:Effect against Lung Metastasis of Lewis Lung Carcinoma[J].Yakugaku Zasshi,1997,117(12):1006-1010.
[3]Mizutani S.Natural Products:Terpene compound isolated from Buna-shimeji mushroom showed antitumor activity[J].Biotech Business Week,2006,27:243.
[4]Chang J S,Son J K,Li G,et al.Inhibition of cell cycle rogression on HepG2 cells by hypsiziprenol A9,isolated from Hypsizigus marmoreus[J].Cancer Letters,2004,212:7-14.
[5]Lee Y,Yen M,Mau J.Antioxidant properties of various extracts from Hypsizigus marmoreus[J].Food Chemistry,2007,104:1-9.
[6]Ikeda M,Mori K,Kobayashi C,et al.A mushroom,white bunashimeji(Hypsizigus marmoreus)prevents the development of atherosclerosis in apolipoprotein E-deficient mice[J].Poster Session,2006,21:436.
[7]李顺峰,刘兴华,张丽华,等.真姬菇子实体多糖的提取工艺优化[J].农业工程学报,2008,24(2):281-284.
[8]付娟妮,刘兴华,蔡福带,等.真姬菇菌丝体多糖碱提取工艺优化[J].农业机械学报,2008,39(6):98-101.
[9]陈栋,周永传.酶法在中药提取中的应用和进展[J].中国中药杂志,2007,32(2):99-101.
[10]张惟杰.糖复合物生化研究技术[M].杭州:浙江大学出版社,1998:10-12.
[11]Wu H C,Chen H M,Shiau C Y.Free amino acids and peptides as related to antioxidant properties in protein hydrolysates of mackerel(Scomber austriasicus)[J].Journal Food and Nutrition Research,2003,36:949-957.
[12]Oyaizu M.Antioxidative activities of browning products of glucosamine fractionated by organic solvent and thin-layer chromatography[J].Nippon Shokuhin Kogyo Gakkaishi,1988,35:771-775.
[13]YEN G C,Hsieh P P.Antioxidative activity and scavenging effects on active oxygen of xylose-lysine maillard reaction products[J].Journal of the Science of Food and Agriculture,1995,67(3):415-420.
[14]袁志发,周静芋.实验设计与分析[M].北京:高等教育出版社,2000:381.
