大枣中环磷酸腺苷的提取及体外抗过敏活性研究
2013-09-04王维有曹晨晨马秋月任迪峰
王维有,曹晨晨,欧 赟,马秋月,王 宇,周 婕,任迪峰,* ,鲁 军
(1.北京林业大学生物科学与技术学院,北京林业大学林业食品加工与安全北京市重点实验室,北京100083;2.中国食品发酵工业研究院,北京市蛋白功能肽工程技术研究中心,北京100027)
大枣(Fructus jujubae)为鼠李科植物,我国枣树种植面积占世界的98%以上[1],资源相当丰富。环磷腺苷酸(cyclic adenosine monophosphate,cAMP)是一种重要的生物活性物质,广泛存在于植物细胞中[2],具有重要的生理调节作用[3-4],可用于调节免疫[5-6]、抑制哮喘[7],并能有效治疗心肌梗塞、冠心病、牛皮癣等疾病。目前,国内外研究者对cAMP的应用表示出极大兴趣,正积极寻找获取这种天然药物的手段。针对枣中cAMP的提取,目前已建立了微波辅助萃取[8]、水提[9]等方法,但这些方法存在能耗大、时间长等不足。闪式提取是一种依靠高速机械剪切力和超动力分子渗滤的技术[10],其通过强大的剪切力加速细胞破碎,以使其中的小分子溶出,因此具有操作简单、快速高效的特点。目前,还未有利用闪式提取技术分离大枣中cAMP的报道。另外,尽管国内外有不少关于cAMP的研究,但鲜有关于其抗过敏活性的报道。为了充分开发利用枣中的cAMP,本研究利用闪式提取法,通过正交实验确定大枣cAMP的最优提取工艺。在对提取液粗品进行纯化的基础上,进一步采用透明质酸酶体外抑制实验,对cAMP抗过敏活性进行初步探讨,旨在为大枣cAMP的深入开发和抗过敏应用打下基础。
1 材料与方法
1.1 材料与仪器
大枣 早脆王枣(充分成熟),采自北京林业大学沧州枣园基地;cAMP标准品(纯度99%)、甲醇(色谱纯)、无水乙醇(分析纯)、磷酸二氢钾(色谱纯)北京化学试剂公司;D101型大孔树脂 天津南开大学化工厂;透明质酸酶(分析纯)、透明质酸钾(分析纯)德国Sigma公司;对-二甲氨基苯甲醛、盐酸、硼酸、乙酰丙酮、碳酸钠等 均为分析纯,北京化工厂。
岛津LC-10A高效液相色谱仪 含LC-10ATvp泵,SPD-10A紫外检测器,C-R8A色谱数据处理仪,日本岛津;Venusil MP C18色谱柱 天津博纳艾杰尔科技有限公司;冷冻离心机 Sigma公司;KQ-500E型超声清洗器 昆山市超声仪器有限公司;RE-5203旋转蒸发仪 上海亚荣生化仪器厂;SHZ-88A往复式水浴恒温震荡器 太仓市实验设备厂;SHB-Ⅲ循环式多用真空泵 郑州长城科工贸有限公司;PL403仪器电子天平 梅特勒-托利多;DZF-6050真空干燥机 深圳市三诺仪表有限公司;FA1604N电子分析天平 上海精密仪器厂。
1.2 实验方法
1.2.1 制作标准曲线 将准确称取的标准品配成浓度分别为 1、3、5、10、15μg/mL 的溶液。分别取上述溶液各15μL注入高效液相色谱仪进行分析,色谱条件:色谱柱采用Venusil MP C18;流动相:20mmol/L磷酸二酸钾-乙醇(80∶20);流速1mL/min;温度为室温;检测波长256nm;进样量为15μL。按照色谱峰面积作出标准曲线。
1.2.2 提取大枣cAMP单因素实验 将早脆王枣清洗,去核,切片后真空干燥(70℃,95kPa),粉碎过60目筛。准确称取早脆王枣粉10.0g,加入适量体积、适当浓度的乙醇混匀,按照料液比、乙醇体积分数、提取时间、提取次数等条件进行闪式提取,提取液以8000r/min离心两次,合并上清液后过0.45μm滤膜,采用高效液相色谱法测定cAMP含量,cAMP提取率计算公式如下:
cAMP提取率(μg/g)=提取液中cAMP质量(μg)/早脆王枣枣粉质量(g)式(1)
1.2.2.1 提取溶剂浓度的影响 10.0g枣粉加入150mL乙醇中,设定料液比1∶15,提取10s,提取2次,乙醇体积分数分别为0、15%、30%、45%、60%、75%、90%,按照1.2.2的操作方法测定cAMP含量。
1.2.2.2 料液比的影响 10.0g枣粉分别按1∶5、1∶10、1∶15、1∶20、1∶25、1∶30 加入乙醇,设定乙醇体积分数60%、提取10s、提取2次,按照1.2.2的操作方法测定cAMP含量。
1.2.2.3 提取时间的影响 10.0g枣粉加入150mL乙醇中,设定料液比1∶15、乙醇体积分数60%、提取2次,提取时间分别为20、40、60s,按照1.2.2的操作方法测定cAMP含量。
1.2.2.4 提取次数的影响 10.0g枣粉加入150mL乙醇中,设定料液比1∶15、乙醇体积分数60%、提取10s,提取次数分别为 1、2、3、4 次,按照1.2.2 的操作方法测定cAMP含量。
1.2.3 正交实验 在单因素实验的基础上,选定乙醇体积分数、提取时间、料液比和提取次数做正交实验(表1),以cAMP提取率为指标,获得cAMP的最优提取工艺。

表1 正交实验设计表Table 1 Design of the orthogonal experiment
1.2.4 大枣cAMP粗提物的纯化 研究表明,D101型大孔树脂适合大枣cAMP提取液的纯化[11]。取适量D101型大孔吸附树脂,用95%乙醇浸泡12h后水洗至中性;继续用5%HCl浸泡6h,水洗至中性;再用5%NaOH浸泡6h,水洗至中性;最后用蒸馏水洗至中性。将处理好的树脂用乙醇湿法装柱,随后,分别对最大上样体积、洗脱液浓度、洗脱流速进行考察。
首先将 cAMP提取液浓缩至 20μg/mL,以1.5BV/h的流速上样,每1h收集一管,每管9mL,收集各时期洗脱液,过0.45μm微孔滤膜,进行cAMP含量测定并绘制泄露曲线。
再取过量cAMP提取液,上样后静置吸附12h。以10%乙醇洗脱样品,流速分别采用0.5、1、1.5BV/h,收集各时期洗脱液,过0.45μm微孔滤膜,进行cAMP含量测定。
最后,取适量cAMP提取液上样6h后静置吸附12h,改变乙醇体积分数分别为20%、30%、40%和50%,以1BV/h的流速洗脱样品,收集各时期洗脱液,过0.45μm微孔滤膜,进行cAMP含量测定。
1.2.5 大枣cAMP提取物抗过敏活性的测定
1.2.5.1 透明质酸酶体外抑制率的测定 采用透明质酸酶体外抑制实验法(E1son-Morgan法)测定提纯后的cAMP提取物的抗过敏活性。将2.5mmol/L的CaCl20.1mL加入0.5mL透明质酸酶(500U/mL)中,37℃保温20min;加入待测液0.5mL,37℃保温20min;加入0.4mg/mL透明质酸钠液0.5mL,37℃保温40min后常温放置5min,加入0.4mol/L NaOH溶液0.1mL,水浴10min,加入乙酰丙酮碳酸钠溶液0.5mL,沸水浴15min,用水冷却;加入3mL无水乙醇10mL,再加入埃尔利试剂1.0mL,混匀,常温放置20min后,于530nm处测定吸光值。
透明质酸酶抑制率计算公式为:
透明质酸酶抑制率(%)=[(a-b)-(c-d)]/(a-b)×100 式(2)
其中,a为透明质酸酶+样品+透明质酸酶钾的吸光度值,b为醋酸缓冲液+样品+醋酸缓冲液的吸光度值,c为透明质酸酶+蒸馏水+透明质酸酶钾的吸光度值,d为醋酸缓冲液+蒸馏水+醋酸缓冲液的吸光度值。
1.2.6 数据分析 所有实验均至少重复三次,结果以“平均值±标准偏差”表示。利用 Excel和SPSS 16.0软件对获得的数据进行统计分析。
2 结果与讨论
2.1 单因素实验
乙醇体积分数对cAMP提取率的影响如图1(a)所示。该图表明,在0~60%范围内,cAMP提取率随着乙醇体积分数的增大而增加,但当乙醇体积分数大于60%时,提取率不但没有增加,反而有所下降。王立霞[12]等人也得出类似结论。这可能是由于在某一特定浓度下,cAMP分子与乙醇分子间相互吸引力最大,排斥力最小;当乙醇浓度继续增加时,cAMP溶解处于过饱和状态,有少量分子结晶析出而使溶解度下降。选乙醇体积分数45%、60%和75%作为正交实验的一组因素。
料液比对cAMP提取率的影响如图1(b)所示。如图所示,cAMP提取率随料液比从1∶5到1∶30逐渐增大。料液比在1∶5至1∶20范围内,cAMP提取率增长明显;而当料液比继续增加时,提取率增长则十分缓慢。选料液比1∶10、1∶15 和1∶20 作为正交实验的一组因素。
提取时间对cAMP提取率的影响如图1(c)所示。由该图可以看出,cAMP提取率在提取时间0~40s范围内逐渐增大;在40s后,提取率增加趋于平缓。出于节约能源与提高效率的考虑,40s即可定为最佳提取时间。选提取时间20、40、60s作为正交实验的一组因素。
提取次数对cAMP提取率的影响如图1(d)所示。由该图可以看出,cAMP提取率随着提取次数的增加而逐渐提高,但增加趋势不明显。当提取次数为4次时,提取率仅比提取3次时高1.6μg/g。综合考虑,选择提取次数1,2,3三个水平作为正交实验的一组因素。
2.2 正交实验结果及最优提取工艺
提取大枣中cAMP的正交实验按L9(34)的正交实验表进行,共9组,其结果见表2,方差分析见表3。从表2实验结果及极差分析可以看出:极差大小依次为RA>RC>RB>RD,四个因素对cAMP提取率影响的主次顺序是A>C>B>D,大枣cAMP的最佳提取工艺为A2B2C2D3,即60%乙醇、料液比1∶20、提取时间40s和提取次数3次。表3方差分析表明,乙醇体积分数、料液比对cAMP提取率的影响极显著,提取时间对cAMP提取率的影响显著,而提取次数对cAMP提取率的影响不显著。

图1 单因素实验结果Fig.1 The results of single factor experiments
对优化提取工艺条件(60%乙醇、料液比1∶20、提取次数3次、提取时间40s)进行验证实验,重复三次,此条件下cAMP的提取率为(149.5±3.6)μg/g。
2.3 纯化结果
2.3.1 泄露曲线 图2为cAMP提取液泄露曲线,从图中可以看出,当收集流份数大于9时,cAMP含量明显升高,故确定其为漏点。因此对于D101型大孔吸附树脂来说,20μg/mL的cAMP提取液最大上样体积为70mL。
2.3.2 洗脱流速的影响 图3显示出洗脱液流速对cAMP纯化结果的影响。从图3(a)中可以看到,洗脱流速为0.5BV/h时洗脱时间最长,而与其他两个流速相对应的洗脱时间基本相等;从图3(b)中可以看到,树脂中cAMP提取物在洗脱流速为1BV/h洗脱效果最好。综合考虑,选择1BV/h作为洗脱流速。

表2 正交实验结果表Table 2 Result of the orthogonal experiment

表3 正交实验方差分析Table 3 Analysis of variance of the orthogonal experiment

图2 cAMP提取液泄露曲线Fig.2 The leaking curve of cAMP extracts
2.3.3 乙醇浓度的影响 图4显示出洗脱液浓度对cAMP提取物纯化结果的影响。由图可知,在20%~40%范围内,乙醇浓度越大,洗脱液中cAMP含量越高,分离效果越明显。而乙醇浓度高于40%时,洗脱液中cAMP的含量有所下降,洗脱效果变差。这可能是由于乙醇为介于极性和非极性之间的溶剂[13],当乙醇浓度增大到一定程度时,越来越多的羟基与H2O形成氢键,导致溶液极性增大,不利于cAMP这种弱极性物质的洗脱。由此可知,乙醇浓度为40%时分离纯化效果最佳。

图3 洗脱液流速的影响Fig.3 Effect of the elution rate

图4 乙醇浓度的影响Fig.4 Effect of the ethanol concentration
2.3.4 纯化结果 依照上述确定的cAMP最优纯化条件,将20μg/mL的大枣 cAMP提取液70mL,上样于D101型大孔树脂,控制流速1.5BV/h;上样完毕后,用40%乙醇以1BV/h流速洗脱180min。将洗脱液真空冷冻干燥,最终可获得纯度为68.5% ±3.4%的cAMP提取物样品。与王荔[14]等人的研究相比,此纯化方法可得到纯度更高的cAMP提取物,为将来的实际应用奠定了基础。
2.4 抗过敏实验结果
对1.2.4中纯化得到的cAMP提取物进行透明质酸酶抑制实验,结果如图5所示。
图5表明,cAMP提取物对透明质酸酶活性的抑制随前者浓度的提高而逐渐增大,最大抑制率达96.2% ±4.1%。用SPSS Statistic软件分析数据,建立回归方程:y=-2.156x2+26.667x+19.716,R2=0.9871,回归方程p<0.01。此方程可靠性较高,计算透明质酸酶抑制率为50%时所需的cAMP提取物质量浓度IC50=0.91mg/mL。大枣cAMP的抗过敏活性检测结果与黄皮叶不同溶剂提取物[15]的抗过敏相比还要高,说明cAMP也是一种具有较强抗过敏活性的天然物质,具有很好的应用前景。
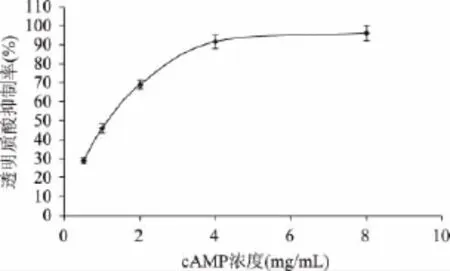
图5 cAMP提取物对透明质酸酶活性的抑制作用Fig.5 The inhibitory effect of cAMP extracts on the activity of hyaluronidase
3 结论
本研究通过单因素和正交实验获得了应用闪提法获取大枣中cAMP的最优工艺:以60%乙醇为溶剂,料液比1∶20,提取3次,每次提取40s,在该工艺条件下 cAMP提取率达(149.5±3.6)μg/g。利用D101型大孔树脂纯化cAMP提取物的结果表明:20μg/mL cAMP提取液以1.5BV/h流速上样70mL,用40%乙醇以1BV/h流速洗脱,此手段纯化cAMP提取物纯度可达68.5%±3.4%。
利用Elson-Morgan法对纯化后的cAMP提取物进行抗过敏性测定,其透明质酸酶抑制率最大可达96.2% ±4.1%,显示出良好的抗过敏活性,说明具有潜在的功能应用价值。
[1]高续春.枣渣中有效成分的提取分离研究[D].西安:西北大学,2007.
[2]Nikolaus A.The current status of cyclic AMP in high plants[J].Annual Review of Plant Physiology,1977,2(8):123-132.
[3]Schwede F,Maronde E,Genieser H,et al.Cyclic nucleotide analogs as biochemical tools and prospective drugs[J].Pharmacol& Therapeutics,2000,87(2-3):199-226.
[4]Marin D,Dunphy G B,Mandato C A.Cyclic AMP affects the haemocyte responses of larval Galleria mellonella to selected antigens[J].Journal of Insect Pysiology,2005,51(5):575-586.
[5]Yuen L P,Wong A S T,Auersperg N.Gonadotropins Regulate N-cadherin-mediated Human Ovarian Surface Epithelial Cell Survival at Both Post-translational and Transcriptional Levels through a Cyclic AMP/Protein Kinase A Pathway[J].Journal of Biological Chemistry,2005,280(15):15438-15448.
[6]Fabiana S,Giorgio F,Cecilia F,et al.Bordetella pertussis Inhibition of Interleukin-12(IL-12)p70 in Human Monocyte-Derived Dendritic Cells Blocks IL-12 p35 through Adenylate Cyclase Toxin- Dependent Cyclic AMP Induction[J].Infection and Immunity,2006,74(5):2831-2838.
[7]Fedyk E R,Adawi A,Looney R J,et al.Regulation of IgE and Cytokine Production by cAMP:Implication for Extrinsic Asthma[J].Clinical Immunology and Immunopathology,1996,81(2):101-113.
[8]崔志强,孟宪军.微波辅助萃取冬枣环磷酸腺苷工艺研究[J].食品科学,2007,28(4):163-166.
[9]Wang H H,Lin Y L,Liao J F,et al.The anti-amnesic effects of the water extract of Jujubae Fructus[J].The Chinese Pharmaceutical Journal(Taipei),2003,55(5):361-369.
[10]林琎,杜磊,罗万春.几种常用分离提取设备的分离提取技术[J].实验科学与技术,2010,8(3):4-6.
[11]尤妍.哈密大枣环磷酸腺昔提取纯化工艺研究[D].乌鲁木齐:新疆农业大学,2011.
[12]王立霞,陈锦屏,张娜,等.和田玉枣中cAMP提取工艺的研究[J].食品工业科技,2009,30(10):234-236.
[13]尤逢惠.大枣cAMP的分离纯化工艺研究[D].合肥:合肥工业大学,2007.
[14]王荔,亓树艳,莫晓燕.大枣环磷酸腺苷提取纯初步研究[J].食品科技,2012,37(4):191-194.
[15]赵丰丽,李洁荣,健秀.黄皮叶不同溶剂提取物抗过敏活性研究[J].食品工业科技,2009,30(1):110-112,115.
