应用PCR-DGGE技术研究宰后羊肉经不同处理后的微生物动态变化
2013-09-04贾文婷蒋彩虹李开雄卢士玲
贾文婷,蒋彩虹,李开雄,卢士玲
(新疆石河子大学食品学院,新疆石河子832000)
新疆羊肉味道鲜美,富含蛋白质、脂肪、人体所需氨基酸等多种营养成分以及钙和铁等微量元素[1]。肉制品腐败变质的主要原因是微生物作用和酶的催化作用[2]。了解肉制品中微生物的群落结构和特定腐败菌有利于控制微生物的生长繁殖,预测产品的保质期以及采用正确的保鲜措施确保产品的安全性[3]。然而,仅运用传统的微生物研究方法对于准确了解羊肉贮藏期的腐败微生物还存在很多困难,因为微生物种和属之间的显性特征往往会因为环境差异而出现交叉表象[4],选择性培养基也不能完全模仿肉质品的特定营养条件[5]。变性梯度凝胶电泳(DGGE)为研究微生物菌群的动态变化开辟了新的途径。目前,PCR-DGGE技术已被广泛应用于食品微生物的种群群落研究,但是,应用该技术研究宰后不同处理的冷却羊肉中腐败微生物的动态变化情况还尚未见报道。本实验将不同处理的羊肉置于相同温度下贮藏,通过对其细菌总数的测定以及PCR-DGGE图谱分析,来研究冷却羊肉中主要的微生物,揭示它们在低温条件下贮藏的动态变化,探讨不同处理方式的羊肉在贮藏期间微生物的变化情况,为延长低温肉制品的保质期和确保产品质量安全提供理论参考。
1 材料与方法
1.1 材料与仪器
羊肉 取自新疆石河子市中心农贸市场,为当日清晨宰杀后2h的羊肉。电刺激组处理条件为畜体的通电电压为50V(方波),频率为13.8Hz,电刺激时间为60s;吊挂组将羊肉样品下方悬挂重物吊挂放至于4℃冰箱;空白处理为未经任何处理的羊肉样品。处理后放入 4℃冷库贮藏。于 0、2、4、6、8、10、12、14、16d 取样(2 个重复),测细菌总数;另外,于 0、2、4、6、8、10、12、14、16d 取样品(2 个重复)10g 直接用于提取总细菌DNA。
JL-C2电刺激器 上海中胜科教设备有限公司;Neofuge台式高速冷冻离心机 方康发展有限公司;PCR仪 美国Bio-Rad公司;DGGE电泳仪Biorad Dcode apparatus美国Bio-Rad公司;水平电泳仪 美国Bio-Rad公司;凝胶成像仪GelDoc 2000 system Bio-Rad,美国;电子天平;高速冷冻离心机;Anke TLG-16G小型离心机;Lx-100掌上离心机;Baygene水平电泳仪;SW-CF-1F超净工作台;GKYS洁净工作台;微型震荡器;海尔控温冰箱;高低温恒温震荡培养箱;Eppendorp 移液枪 (1~10μL、1~20μL、20~200μL、10~1000μL);细菌总 DNA 提取试剂盒QIAGEN,德国;溶菌酶 sigma;PCR相关试剂盒;Mark III;去离子水 实验室自制;丙烯酰胺、双丙烯酰胺、尿素、Tris、EDTA、甲酰胺、TE、过硫酸胺Sunshine。
1.2 测定方法
1.2.1 细菌总数的测定 无菌条件下取25g样品(2个重复)加入225mL灭菌生理盐水摇床振摇30min。取1mL上清液依次进行10倍递增稀释,选3个合适的稀释度,每个稀释度2个重复,倾注平板。采用PCA培养基于37℃培养48h[6],计算菌落总数。每个样品菌落总数取平均值后的对数值(N)。
1.2.2 细菌总DNA的提取 参照 Ampe等方法[7],略有修改。无菌操作取样品10g(2个重复)于90mL生理盐水中,摇床振摇30min。4℃,2000×g离心5min,取上清液于10000×g,4℃条件下离心15min,取沉淀置于1.5mL离心管,参照 DNA Tissue Kit(QIAGEN,Germany)说明,用该试剂盒提取总的细菌DNA。所提取DNA溶于TE缓冲液,经1.0%琼脂糖凝胶电泳检测后,于-20℃条件贮藏。
1.2.3 PCR扩增 第一轮用采用引物参考文献[8],上游引物为带GC夹子的U968,下游引物为L1401。对细菌16S rDNA的V6~V8区段进行PCR扩增,扩增出的片段为400bp。
U968-GC 夹子为:5'-CGC CCG GGG CGC GCC CCG GGC GGG GCGGGG GCA CGG GGG GAA CGC GAA GAA CCTTAC-3';
下游引物L1401为:5'-CGG TGT GTACAA GAC CC-3'。
上述引物均由上海生物工程有限公司合成。
PCR反应体系为25μL,其中包括DNA稀释液1μL,引物 U968-GC 和 L1401 各 1μL,PCR Mix 12.5μL,ddH2O10.5μL。
PCR反应程序:94℃预变性5min,35个循环(94℃,1min,56℃,30s,72℃,1min),最终 72℃ 延伸7min。
PCR产物经1.0%琼脂糖电泳检测后于-20℃条件下贮藏备用。
1.2.4 变性梯度凝胶电泳(DGGE)DGGE采用Biorad Dcode apparatus电泳仪,聚丙烯酰胺凝胶浓度为8%(丙烯酰胺:甲叉双丙烯酰胺37.5∶1)。变性梯度从35%~55%(100%变性剂含有7mol/尿素和40%甲酰胺),在 TAE缓冲液中,先 200V电泳10min,后100V恒压下电泳14h。
1.2.5 EB染色 电泳结束后,小心取下DGGE胶片,放入 SARB GREEN中染色 30min,之后再将DGGE胶片放入dd H2O中漂洗3次。
1.2.6 成像及分析 将用EB染好的DGGE胶片置于凝胶成像系统下照相。图像用Quantity one(BIORAD)分析软件进行分析。
1.2.7 DNA的回收与纯化 将EB染色的DGGE胶片置于紫外灯下,用无菌手术刀切下DGGE胶上相应位置的条带,分别放入1.5mL已灭菌的离心管里,再加入20μL无菌的TE溶液,置于4℃过夜,备用。
1.2.8 DNA的测序 以回收的DNA为模板,取1.5μL为模板DNA进行16s rDNA V6~V8区域的扩增,细菌引物为U968(5'-AAC GCG AAG AAC CTT AC-3'),L1401(5'-CGG TGT GTA CAA GAC CC-3'),PCR扩增程序同1.2.3。扩增后的PCR产物在1.0%琼脂糖上检验,条带位置在400bp即可证明该回收DNA的存在,之后将剩余PCR产物送于北京三博远志测序部进行测序。登陆NCBI,将所得序列与数据库中的已知序列进行相似性比对[9]。
2 结果与分析
2.1 菌落总数
经Spass 18.0软件分析,三个处理组在相同的天数菌落总数差异不显著(p≥0.05)。由表1可见,在4℃贮藏1~15d,吊挂组和电刺激组菌落总数从103CFU·g-1增至 107CFU·g-1。贮藏 15d,菌落总数显著增高,说明贮藏15d以后,由于细菌的生长繁殖加速,产品开始腐败变质。

表1 不同处理组在贮藏期间的菌落总数变化lg(CFU/g)Table 1 Changes of microbial counts for different samples during storage(lgCFU/g)
2.2 细菌总DNA提取结果
选取不同处理方式的样品,分别在第0、2、4、6、8、10、12、14、16d 采集样品,对样品进行无菌操作后,用细菌总DNA提取试剂盒提取样品中细菌的总DNA,后用16S rDNA的V6~V8可变区引物(含GC夹子)进行PCR扩增,扩增产物经1.0%琼脂糖电泳检测,获得约400bp的特异性片段,所有样品均有较亮的扩增条带,说明本实验中样品的细菌总DNA提取效果较好,PCR扩增条件合适,可以满足后续DGGE电泳分析实验的需要。
2.3 细菌DNA的DGGE图谱及谱带测序结果
DGGE图谱上同一泳道上不同位置的条带代表不同的微生物种类[10]。对DGGE图谱上分离的条带1~12进行割胶、扩增、测序,在NCBI上用BLAST软件在GenBank中与参考序列进行相似性比对,分析结果如表2所示,条带1~12为嗜冷杆菌、葡萄球菌、克雷伯氏菌、假单胞菌、寡养单胞菌、肠杆菌、乳酸杆菌、热死环丝菌。其细菌相似性均达96%以上。通过采用传统的微生物培养技术,从新疆塔城区冷却羊肉中分离和初步鉴定出典型菌株12株,其中乳杆菌2株、热死环丝菌2株、假单胞菌属和肠杆菌科各3株,葡萄球菌属和酵母菌各1株[11]。本人经过实验,采用分子生物学技术,即PCR-DGGE技术得到了14个条带,也就是说存在至少14种优势细菌,但是由于有些条带较暗,也可能因为实验技术手段问题,通过多次的实验,对条带进行割胶测序,14个条带只测出12个,还不能证明于见亮所检测的12种细菌全部包含在本人所检测的细菌之内。
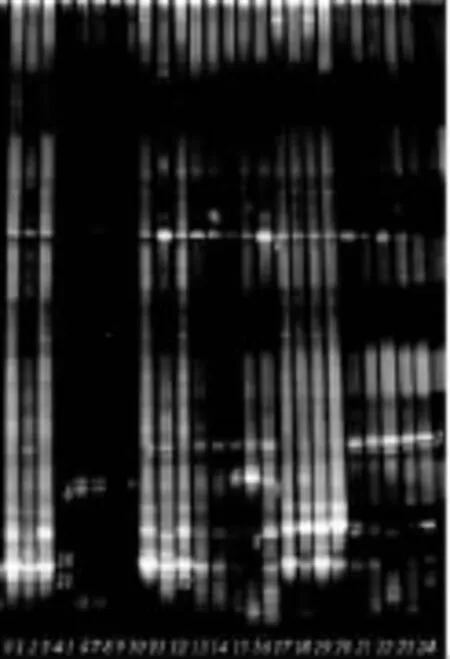
图1 不同处理组在贮藏期间细菌的DGGE图谱Fig.1 DGGE profiles of the bacterial from different groups during storage
图1和表2表明:样品在低温贮藏过程中,微生物具有显著差异性和动态演替过程。贮藏2d时,电刺激组具有较高的多样性:假单胞菌,嗜冷菌,葡萄球菌,克雷伯氏菌等不同种属的细菌均被检测出来。在贮藏14d时,电刺激组微生物菌群发生变化,第2、3、8条带消失或减弱,出现了条带4、5,它们代表了假单胞菌种的细菌。吊挂组在贮藏第8d时出现了条带7、8、9、10 变暗,出现了条带 2、3,它们代表葡萄球菌和克雷伯氏菌属。空白组在贮藏第8d时条带7、8、9、10、11 减弱,出现了条带4、5、6,它们代表了假单胞菌。肉制品的贮藏过程亦是产品的腐败过程,随着贮藏时间延长,大多数细菌逐渐受到抑制,主要有4条浓度最高的条带5、6、7和8存在,它们代表嗜冷菌和假单胞菌,表明它们的主导优势地位;8d时才观察到条带2即葡萄球菌,并呈现极高的浓度,说明它是羊肉腐败时的主要腐败菌之一。综上所述,吊挂组与电刺激组在贮藏初期菌群差异不大,主要的腐败菌均为嗜冷杆菌。在贮藏的后期,假单胞菌成为电刺激组的主导腐败菌,而吊挂组的主导腐败菌群为葡萄球菌。出现这种后期差异性的可能原因是电刺激组的羊肉成熟时间比吊挂组要短。在贮藏过程中腐败的时间比吊挂组要早,所以在贮藏后期出现了较多的条带。而吊挂组相对成熟时间延长,在贮藏的后期微生物污染较少,只有较少的条带出现,葡萄球菌占主导地位。

表2 DGGE条带分离的主要细菌16S rDNA部分序列相似性比较Table 2 Comparison of partial 16S rDNA sequencing fragments of dominating microbe similarity from DGGE bands
通过图2表明:不同处理方式的羊肉在低温贮藏过程中污染的微生物也存在差异性。由图2系统发育树可以看出,菌2和10的亲缘关系比较近,菌2是在吊挂组贮藏后期出现的细菌,菌10是空白组贮藏初期出现的细菌;菌1和7,8是同一属的菌群,它们分别在电刺激组和吊挂组的贮藏初期出现,菌8在电刺激组的贮藏后期仍然存在;菌4和5,6是同一属的菌群,菌4和5属于电刺激组后期出现的特有菌群,菌6是在空白组贮藏后期出现的菌群,它们均未在吊挂组检测到,具体原因尚未清楚,需要进一步的研究。由于DNA测序只能精确到属,所以要想更加准确的确定这些细菌到底隶属于哪一种还要进行后续实验。
本实验证明了不同处理方式羊肉贮藏过程中微生物的动态变化,无论是吊挂处理还是电刺激处理,都有其相应的变化规律,电刺激组在贮藏后期微生物菌群以假单胞菌为主要腐败菌,吊挂组以葡萄球菌为主要腐败菌。并且在最初的时期也是存在多样性的。而产生这些菌群变化差别的具体原因尚不清楚,未见国内外研究报道。

图2 冷却羊肉贮藏一定时间后经DGGE分析后所分离纯化细菌的微生物进化树Fig.2 Dendrogram of the DGGE profiles obtained directly from the cooling mutton at some days of ripening
3 结论
本文应用PCR-DGGE指纹技术,研究了不同处理方式冷却羊肉中微生物的多样性及其贮藏过程中的菌群动态变化。变性梯度凝胶电泳技术能有效地应用于低温肉制品中微生物的研究,直观地反映肉制品中主要微生物群落及其动态变化过程。
结果表明,冷却羊肉贮藏初期污染微生物就已经具有较高多样性,但是随着贮藏时间的增加,其优势逐渐被少数腐败菌所代替,这些腐败菌具有很强的竞争优势,从而抑制了其他微生物的生长,造成了冷却羊肉的腐败变质。两个处理组在储藏初期微生物菌群差异不大,但吊挂组在第10d后以葡萄球菌为主导菌群。电刺激组在贮藏过程后期才凸显的腐败菌为假单胞菌。
[1]秦瑞升,谷雪莲,刘宝林.不同贮藏温度对速冻羊肉品质影响的实验研究[J].食品科学,2007,28(8):495.
[2]Laduda T P.Shelf-life dating of foods[M].Westport CT:Food and Nutrition Press,1982.
[3]Hansen L T,HussH H.Comparison of the microflora isolated from spoiled cold2smoked salmon from three smokehouses[J].Food Res Int,1998,31:703-711.
[4]Holley R A.Impact of slicing hygiene upon shelf life and distribution of spoilage bacteria in vacuum packaged cured meats[J].Food Microbiol,1997,14:201-211.
[5]Muyzer G,deWall E C,Uitterlinden A G.Profiling of comp lexmicrobial populations by denaturing gradient gel electrophoresis analysis of polymerase chain reaction-amplified genes coding for 16S rRNA[J].Appl EnvironMicrobiol,1993,59:695-700.
[6]白艳红.低温熏煮香肠腐败机理及生物抑菌研究[D].杨凌:西北农林科技大学,2005:42-52.
[7]Giraffa G,Neviani,E.DNA- based,culture- independent strategies for evaluating microbial communities in food-associated ecosystems[J].International Journal of Food Microbiology,2001,67:19-34.
[8]M Y Li,G H.Zhou,X L Xu,et al.Changes of bacteria diversity and main flora in chilled pork during storage using PCR-DGGE[J].Food Microbiology,2006,23:607-611.
[9]Altschul S F,Madden TL,Schaffer AA,et al.Gapped blast and psiblast:a new generation of protein database search programs[J].Nucleic Acids Research,1997,25:3389-3402.
[10]Ercolini G.PCR-DGGE fingerprinting:novel strategies for detection of microbes in food review[J].Journal of Microbiological Methods,2004,56:297-341.
[11]于见亮,李开雄,蒲菊霜,等.冷却羊肉中腐败菌的分离、初步鉴定与初始菌相分析[J].肉类工业,2007(11):27-29.
