海南蒲桃果色素的提取及理化性质的研究
2013-09-04植中强
植中强
(肇庆学院化学化工学院,广东肇庆526061)
合成色素色泽鲜艳,稳定性好,着色力强,曾经被大量使用。但随着人们对人工合成色素毒性的认识,越来越多的国家限制在食品中使用合成色素,从而为食用天然色素的发展提供了空间。天然色素大多数安全无毒,不仅可以作为食品着色剂,还具有医疗保健的功效。因此,天然色素正逐渐取代合成色素被广泛地应用于食品工业中。海南蒲桃[syzzgium cumini(Linn).Skeels][1]属桃金娘科的常绿大乔木,广泛分布在我国热带、南亚热带地区,在云南、广东、福建等省均有野生和栽培。夏末果熟,浆果有呈椭圆形、矩圆形、橄榄形,紫色至黑色,嚼后口腔及唾液皆染成紫色。生食鲜果,对慢性咳嗽和哮喘有治疗效果。干果研末,肉汤送服,还可治寒性哮喘和过敏性哮喘[2-3]。海南蒲桃果色素的研究在国内尚未见文献报道。为此,本实验对海南蒲桃果色素的提取及理化性质进行了初步的研究,旨在为开发利用这一廉价、无毒的天然色素提供一定的理论依据。
1 材料与方法
1.1 材料与仪器
新鲜海南蒲桃果实 采自广东肇庆北岭山,选用无霉烂变质的新鲜熟透海南蒲桃果,洗净、晾干,冰箱冷藏备用;氢氧化钠、盐酸、无水乙醇、甲醇、乙醚、丙酮、柠檬酸、苯甲酸钠、可溶性淀粉、葡萄糖、果糖、蔗糖、无水三氯化铝、无水氯化钙、氯化钠、氯化镁、氯化钾、六水三氯化铁、五水硫酸铜、七水硫酸锌、过氧化氢、亚硫酸钠、维生素C等 均为国产分析纯。
S22PC可见分光光度计 上海棱光技术有限公司;UV/VIS916紫外可见分光光度计 澳大利亚GBC科学仪器公司;pHS29A数字酸度计 上海大普仪器有限公司;CS501超级恒温器 重庆实验设备制造厂;AUY120电子天平 日本岛津公司。
1.2 实验方法
1.2.1 海南蒲桃果色素的提取工艺流程 新鲜海南蒲桃果→清洗晾干→破碎去核→称量→加入最佳提取剂浸提→抽滤→滤渣→第二次浸提→抽滤→滤渣(弃去)→合并二次浸提滤液→提纯→真空浓缩干燥→成品
1.2.2 提取剂的选择 经初步研究发现海南蒲桃果色素容易溶于水和乙醇,在酸性条件下比较稳定[4]。为此本实验选择含0.3%盐酸的不同浓度的乙醇溶液作为提取剂。
1.2.3 海南蒲桃果色素的提取条件选择 采用正交实验,对提取温度、提取时间、提取剂浓度、原料与提取剂配比4个因子在5个不同的水平上进行优选实验。根据极差大小确定四因子对海南蒲桃果色素提取的影响大小,确定最佳提取条件。正交实验因素水平见表1。

表1 正交实验因素水平表Table 1 Factors and levels of orthogonal test
1.2.4 海南蒲桃果色素的提纯 一定量海南蒲桃果肉,用溶剂浸提,滤液用石油醚、氯仿去除脂溶性杂质[5-7],可得红色透明的色素液。
1.2.5 海南蒲桃果色素理化性质的测试方法 在海南蒲桃果色素溶液中,添加各种不同浓度的试剂,让其分别在不同的实验条件下作用,再以同等浓度的空白溶液作对比,用S22PC型可见分光光度计测定其吸光度,以此测定出不同的试剂、不同的环境条件对海南蒲桃果色素稳定性的影响。
1.2.5.1 海南蒲桃果色素的热稳定性 量取海南蒲桃果色素原液5.00mL移入100mL容量瓶中,用0.3%盐酸溶液稀释定容至100mL。取其稀释液适量,分别置于不同温度的水浴中加热1h,于波长532nm处测其吸光度,并观察色素的颜色。
1.2.5.2 氧化剂和还原剂对海南蒲桃果色素的影响在室温下,量取海南蒲桃果色素原液5.00mL移入100mL容量瓶中,用0.3%盐酸溶液稀释定容100 mL。再取其稀释液各15.00mL,分别加入5%的H2O2(氧化剂),5%的 Na2SO3(还原剂),5%的 VC(还原剂)各15.00mL,对照组中加入15.00mL蒸馏水,置于黑暗处,每隔1h在532nm处测其吸光度。
1.2.5.3 pH对海南蒲桃果色素的影响 在室温下,取海南蒲桃果色素原液5.00mL,稀释定容至100mL,再用0.1mol/L的盐酸和0.1、0.01、0.001mol/L氢氧化钠溶液调配成pH为1~12的一系列溶液。将各pH色素溶液在常温下放置黑暗处1、2h,每隔1h,分别在波长532nm处测其吸光度。
1.2.5.4 强烈太阳光对色素稳定性的影响 取海南蒲桃果色素原液5.00mL,稀释定容至100mL。取其稀释液分别在强光下照射0、1、2、3、4、5、6h,每隔1h,在波长532nm处测其吸光度,并观察其颜色变化。
1.2.5.5 室内光对色素稳定性的影响 在室温下,取海南蒲桃果色素原液5.00mL,稀释定容至100mL。取其稀释液置于室内靠窗口的光亮处,放置不同时间,每隔一天,在波长532nm处测其吸光度。
1.2.5.6 金属离子对海南蒲桃果色素稳定性的影响配制含各种金属离子的溶液,浓度分别为0.005、0.05、0.10mol/L。在室温下,取海南蒲桃果色素原液5.00mL,稀释定容至 100mL。再取其稀释液各15.00mL,分别加入15.00mL各种金属离子溶液,在相同条件下放置黑暗处1、2、3h,每隔1h,在波长532nm处测其吸光度。
1.2.5.7 淀粉和柠檬酸对色素稳定性的影响 在室温下,取海南蒲桃果色素原液5.00mL,稀释定容至100mL。再取其稀释液各15.00mL,分别加入不同质量分数的淀粉溶液和不同浓度的柠檬酸溶液各15.00mL后置于黑暗处,每隔1h,在波长532nm处测其吸光度,并比较它们对色素的影响。
1.2.5.8 糖对色素的影响 在室温下,取海南蒲桃果色素原液5.00mL,稀释定容至100mL。再取其稀释液各15.00mL,分别加入不同质量分数的葡萄糖、蔗糖和果糖溶液,置于黑暗处1h后,在波长532nm处测其吸光度。比较这三种糖对色素的影响。
1.2.5.9 苯甲酸钠对色素稳定性的影响 在室温下,取海南蒲桃果色素原液5mL,稀释定容至100mL。再取其稀释液各15.00mL,加入不同浓度的苯甲酸钠溶液后置于黑暗处,每隔1h,在波长532nm处测其吸光度,并比较它们对色素的影响。
1.2.6 海南蒲桃果色素的光谱性质 取通过提纯的海南蒲桃果色素原液2.00mL,用0.3%盐酸溶液稀释定容至100mL,再用紫外-可见分光光度计对其溶液进行光谱扫描。
2 结果与讨论
2.1 海南蒲桃果色素提取条件的选择
采用L25(54)正交实验组合表,对提取温度、提取时间、提取剂的浓度、原料与提取剂配比等4个因素在5个不同的水平上进行优选实验。正交实验结果见表2。
由表2可知,提取温度、提取时间、提取剂浓度、原料与提取剂配比的极差R值分别为0.179、0.145、0.278、0.459,故此,4个因素对海南蒲桃果色素提取的影响主次是:原料与提取剂配比>提取剂浓度>提取温度>提取时间。正交实验结果表明,海南蒲桃果色素提取的最佳工艺条件为A4B4C5D1,即以体积分数为0.3%盐酸-90%乙醇溶液作为海南蒲桃果色素的提取剂,原料与提取剂配比为1∶4(g/mL),提取温度为60℃,提取时间为4h,提取效果最好。
选择上述实验中最佳的工艺条件进行重复实验。结果见表3。
由表3可知,最佳提取条件下做的重复实验其重现性极好,吸光度A532可以达到1.630以上。
2.2 海南蒲桃果色素的光谱性质
用紫外-可见分光光度计对海南蒲桃果色素溶液进行光谱扫描,结果见图1。
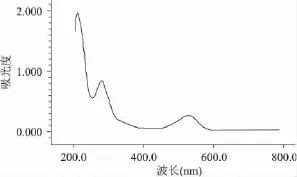
图1 海南蒲桃果色素的吸收光谱Fig.1 Absorption spectrum of syzygium cumini fruit pigment
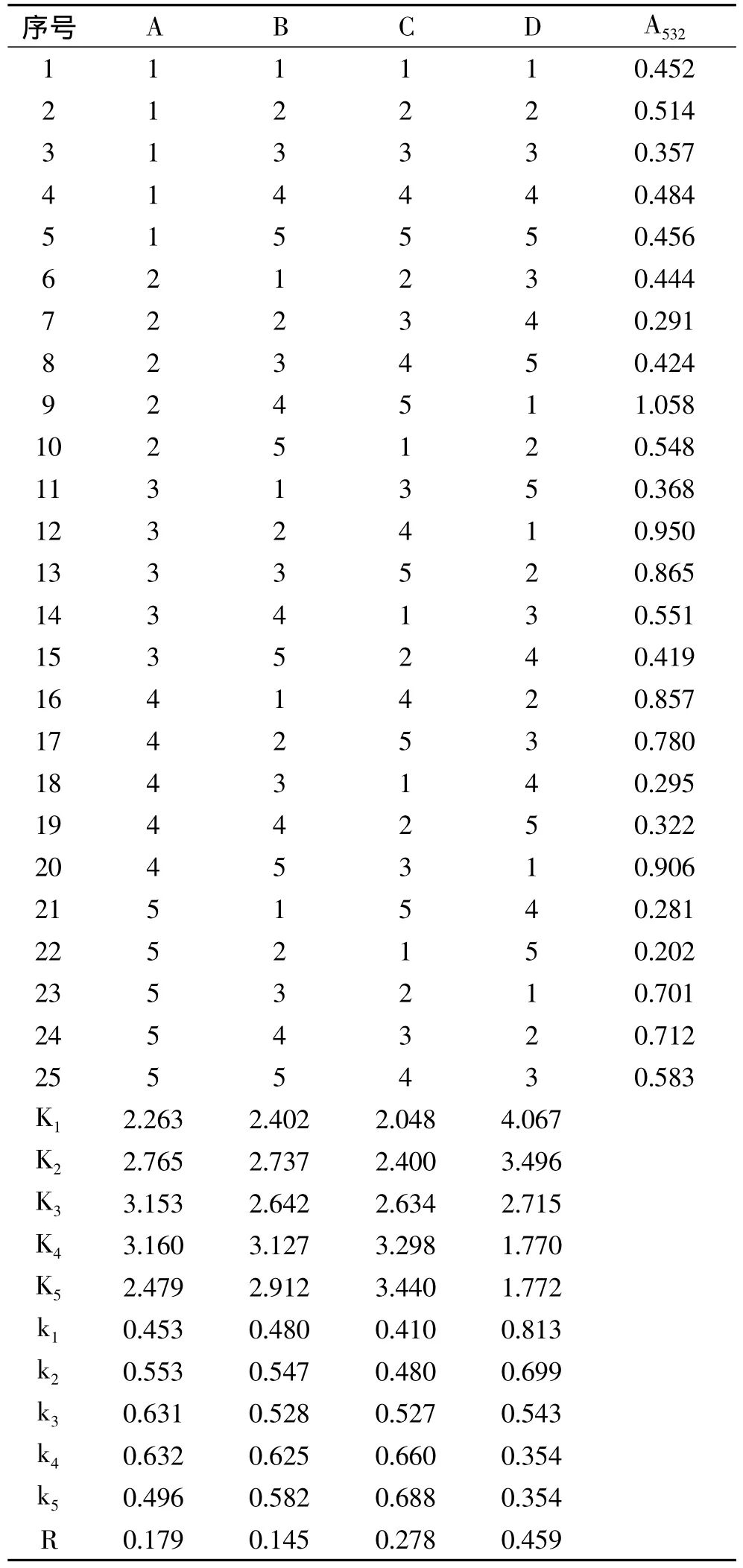
表2 正交实验结果与分析Table 2 Results and analysis of orthogonal test

表3 最佳提取条件的吸光度Table 3 The optimum extraction condition of absorbance

表4 温度对色素的影响Table 4 Influence of temperature on the pigment
由图1可知,海南蒲桃果色素在350和530nm附近有强吸收峰。与有关文献对比[8-14],可以初步确定海南蒲桃果色素主要是花色苷类色素。
2.3 海南蒲桃果色素的理化性质
2.3.1 海南蒲桃果色素的溶解性 在室温下,将海南蒲桃果色素粉末分别用水、无水乙醇、丙酮、稀盐酸、乙醚、柠檬酸溶液等进行溶解。结果表明,该色素易溶于水、无水乙醇、丙酮,稀盐酸、柠檬酸溶液,不溶于乙醚。
2.3.2 海南蒲桃果色素的热稳定性[15]不同温度对色素的影响结果见表4。
由表4可知,海南蒲桃果色素耐热性较好,而且颜色变化不大,在70℃以下都比较稳定。
2.3.3 氧化剂和还原剂对海南蒲桃果色素的影响氧化剂和还原剂对色素的影响结果见表5。

表5 氧化剂和还原剂对色素的影响Table 5 Influence of oxidant and reducer dosage on the pigment
由表5可知,H2O2和Na2SO3使海南蒲桃果色素的颜色由红色变成茶色,而且色素的吸光度与对照组相比,明显下降。这说明了海南蒲桃果色素极易被 Na2SO3还原,也易被 H2O2氧化,即 H2O2和Na2SO3对色素有较强的降解作用。但VC却对色素有护色的作用,即海南蒲桃果色素不易被VC还原,在食品加工中可以添加适量的VC而不影响色素的色泽。
2.3.4 pH对海南蒲桃果色素的影响[16]pH对色素的影响结果见表6。
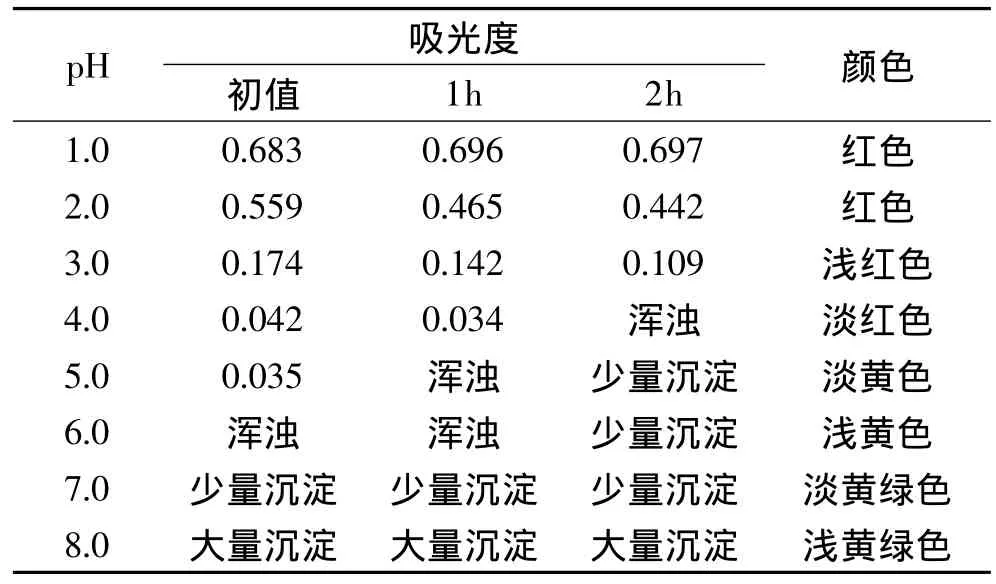
表6 pH对色素的影响Table 6 Influence of pH value on the pigment
由表6可知,海南蒲桃果色素在酸性越强的条件下越稳定。当pH=1、2时,色素基本上没有降解,且色泽鲜艳透明;当pH≥3时,色素大量降解,颜色大幅度改变,甚至还出现浑浊或沉淀现象。
2.3.5 光线对海南蒲桃果色素稳定性的影响[17]
2.3.5.1 强烈太阳光对色素稳定性的影响 室外光对色素的影响结果见图2。
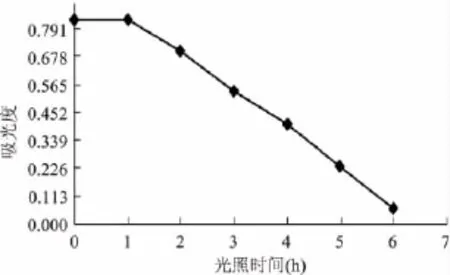
图2 室外光对色素的影响Fig.2 Influence of outdoor light on the pigment
由图2可知,强烈的太阳光对海南蒲桃果色素有降解作用,随着光照时间的延长,吸光度明显减小。除此以外,色素的颜色也产生明显的变化:1~3h,色素呈红色;4、5h,色素呈浅红色,且出现浑浊;6h,色素呈茶色,有沉淀。
2.3.5.2 室内光对色素稳定性的影响 室内光对色素的影响结果见图3。
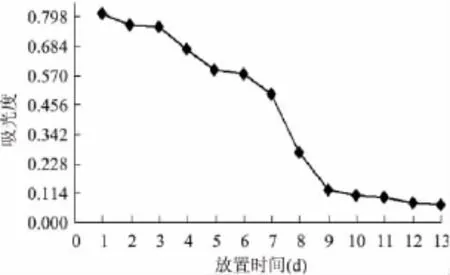
图3 室内光对色素的影响Fig.3 Influence of indoor light on the pigment
由图3可知,海南蒲桃果色素对光线比较敏感,1~6d,色素呈红色;7~8d,色素呈浅红色,有沉淀产生;10~11d,色素呈橙红色,有沉淀;12d,色素呈茶色,有沉淀;13d,色素呈淡黄色,有沉淀。
2.3.6 金属离子对海南蒲桃果色素稳定性的影响金属离子对色素的影响结果见表7。
由表 7 可知,当加入 Cu2+、Fe3+、Zn2+、K+和 Al3+时,较高的离子浓度和较长的接触时间会导致色素降解,使色素的吸光度下降。这说明了以上5种离子都会降低色素的稳定性。而有Ca2+、Na+和Mg2+这3种离子存在的条件下,色素非常稳定,且色泽鲜艳。
2.3.7 食品添加剂对海南蒲桃果色素稳定性的影响
2.3.7.1 淀粉和柠檬酸对色素稳定性的影响 淀粉和柠檬酸对色素的影响结果见表8、表9。
由表8的数据和观察色素与淀粉溶液混合的现象可知,淀粉溶液能使色素产生白色沉淀,并使其颜色褪减,即淀粉对海南蒲桃果色素有一定的降解作用。

表7 金属离子对色素的影响Table 7 Influence of metal ions on the pigment
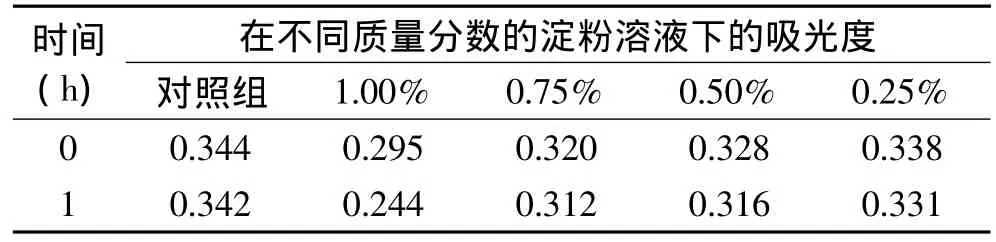
表8 淀粉对色素的影响Table 8 Influence of starch dosage on the pigment
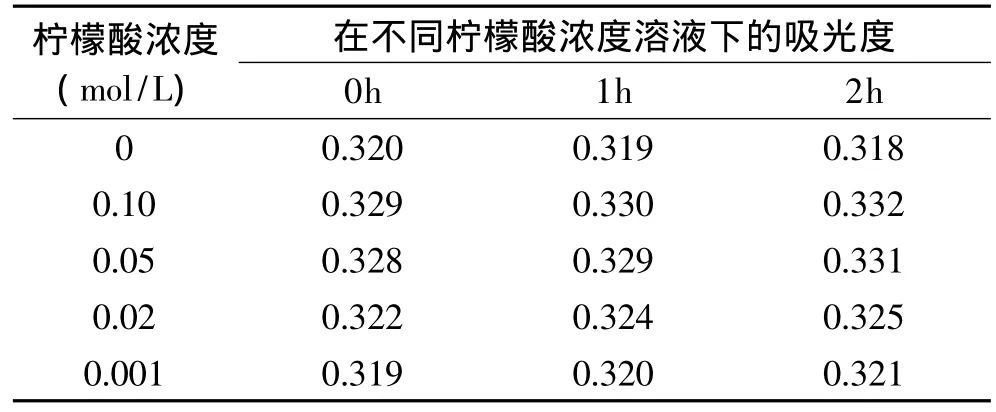
表9 柠檬酸对色素的影响Table 9 Influence of citric acid dosage on the pigment
由表9可知,柠檬酸对色素的稳定性无不良影响,且有一定的增色作用。
为了探讨柠檬酸对色素的增色效果,需对实验数据进行差异性分析,结果见表10。
由表10可知,通过SPPS软件进行差异性分析发现:当柠檬酸浓度分别增加到0.02、0.05、0.10mol/L时各显著性水平p都小于0.05,即柠檬酸对色素的增色效果显著。
2.3.7.2 糖对色素的影响 糖对色素的影响结果见表11。

表10 差异性分析结果Table 10 The difference analysis results

表11 糖对色素的影响Table 11 Influence of sugar dosage on the pigment
由表11可知,低浓度的葡萄糖和蔗糖对色素的影响不大,但高浓度的葡萄糖和蔗糖对色素有一定的降解作用,而果糖则对海南蒲桃果色素有一定的增色作用。
2.3.7.3 苯甲酸钠对色素稳定性的影响 苯甲酸钠对色素的影响结果见表12。
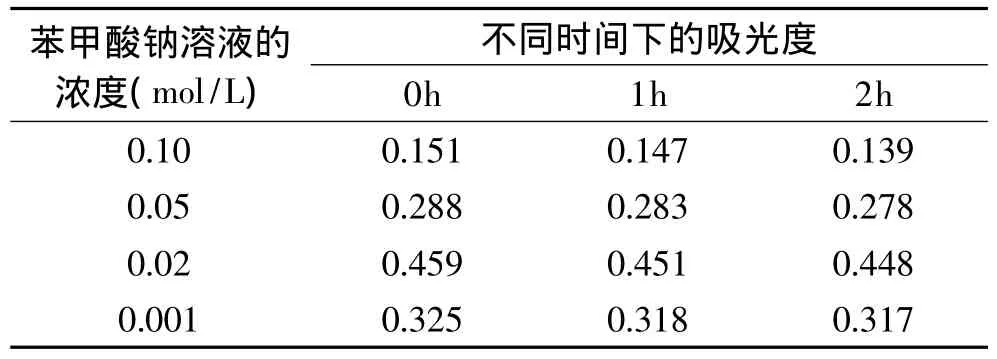
表12 防腐剂对色素的影响Table 12 Influence of preservative dosage on the pigment
由表12可知,高浓度的苯甲酸钠溶液(0.10、0.05mol/L)对海南蒲桃果色素有较大的降解作用,同时也影响色素的颜色,使其颜色由红色变成粉红色;而浓度为0.02mol/L的苯甲酸钠溶液对海南蒲桃果色素的降解作用极微,即该色素在此浓度的苯甲酸钠溶液中较稳定;在0.001mol/L苯甲酸钠溶液中,则色素有微量降解。故防腐剂的用量要适中,才能起保持色素的稳定性的作用。
3 结论
3.1 海南蒲桃果色素的最佳提取条件为:以体积分数为0.3%盐酸-90%乙醇溶液作为提取剂,原料与提取剂配比为1∶4(g/mL),提取温度为60℃,提取时间为4h。
3.2 海南蒲桃果色素在pH≤2的酸性溶液中稳定,其色泽呈清澈透明的鲜红色,可以用作酸性饮料(如碳酸饮料、乳酸饮料等)、果酒、冰淇淋、糖果等的着色剂,在pH≥3的溶液中不稳定,颜色发生变化,故色素的使用或加工应在酸性介质中进行。
3.3 海南蒲桃果色素的耐氧化剂和还原剂的能力较差,使用时应注意避免与氧化还原性强的物质共存。
3.4 Cu2+、Fe3+、Zn2+、K+、Al3+和淀粉明显降低了海南蒲桃果色素的稳定性,而果糖和其它常见离子对色素的稳定性的影响不大,故使用时应注意避免添加以上对色素稳定性有影响的物质或与它们接触。
3.5 适量的柠檬酸、苯甲酸钠、葡萄糖和蔗糖对海南蒲桃果色素的稳定性无不良影响,但高浓度的苯甲酸钠、葡萄糖和蔗糖对色素有一定的降解作用,使用时应避免大量添加。
3.6 海南蒲桃果色素在70℃以下耐热性较好,但阳光对色素的稳定性影响较大,故储存和运输时,应避免阳光照射。
[1]中国科学学院植物研究所.中国高等植物图鉴(第二册)[M].北京:科学出版社,2002:994.
[2]菊珍,杜铃,林榕庚.海南蒲桃的栽培技术周[J].广西林业科学,2001,30(2):99-100.
[3]吴坚,何和明.海南蒲桃植株花粉形(生)态特征及元素含量研究[J].中国野生植物资源,2004,23(4):59-60.
[4]常丽新,贾长虹,赵永光,等.超声波辅助法提取月季花红色素的最佳工艺研究[J].食品工业科技,2009,30(4):279-281.
[5]杨万政,陈慧英,李道远.玫瑰花红色素的提取和稳定性的研究[J].中央民族大学学报:自然科学版,2003,12(1):64-68.
[6]原春兰,李宗孝,杨佩云.地榆中熊果酸的提取[J].中国医药工业杂志,2002,33(10):478-479.
[7]刘小芬,刘剑秋,陈炳华,等.轮叶蒲桃果实红色素提取与基本性质分析[J].热带植物科学,2003,32(4):15-18.
[8]Harborne J B,Williams C A.Flavonoid advances in research science[M].London:Chapman and Hall,1982:1-18.
[9]Gross J.Pigments in fruits,Harcourt Brace Jovanovich,London Orlando San Diego[M].New York Austin Boston Sydney Tokyo Toronto,1987:59-71.
[10]张力.落葵色素的的提取组分分离及性质研究[J].广西民族学院学报,1994(2):85-91.
[11]杨佩荣,康建彪.草莓色素的提取及稳定性的研究[J].冷饮与速冻食品工业,2003,9(1):24-28.
[12]王双明.爬山虎果实色素的的提取及其性质的初步研究[J].食品科技,2005(2):52-54.
[13]王常青.黄刺玫色素的的提取及其性质的探讨[J].食品与发酵工业,1996(6):36-38.
[14]陈小婕,阴文娅.植物中花青素提取方法探讨[J].食品工业科技,2013,34(2):395-399.
[15]邸翔,刘长涛,高莉,等.红果小檗色素的提取及其稳定性研究[J].食品与发酵工业,2010,36(6):184-189.
[16]马丹雅,赵晶,姚晶,等.仙人掌果红色素提取工艺及其稳定性研究[J].食品工业科技,2012,33(23):214-217.
[17]杨希娟,党斌,张国权.黑小麦色素提取工艺优化及其稳定性研究[J].食品工业科技,2011,32(7):353-357.
