构建酿酒酵母工程菌合成香紫苏醇
2013-09-04杨薇周雍进刘武军沈宏伟赵宗保
杨薇,周雍进,刘武军,沈宏伟,赵宗保,3
1中国科学院大连化学物理研究所生物技术部,辽宁 大连 116023
2营口理工学院化学工程系,辽宁 营口 115000
3中国科学院大连化学物理研究所 催化基础研究国家重点实验室,辽宁 大连 116023
萜类化合物广泛存在于植物、动物和微生物中,至今已分离出40余万种。许多萜类化合物是植物生长、发育和一般代谢必不可少的化学物质[1]。萜类化合物可应用于医药、保健品、香精、香料或农药领域[2]。然而,大多萜类化合物在其天然生产物种中的含量极低,成为制约它们规模化应用的瓶颈。近年来,合成生物学和代谢工程技术迅速发展,为改造目标分子的天然生产物种或设计异源生产途径提供了可能[3]。例如,构建微生物“细胞工厂”合成紫穗槐二烯 (青蒿素前体)[4]、紫杉烯 (红豆杉醇前体)[5]和番茄红素[6]等萜类化合物,取得了令人振奋的结果。
酿酒酵母Saccharomyces cerevisiae的遗传背景相对清晰,遗传操作平台成熟,生物安全性好。由于其甲羟戊酸 (MVA)途径和异戊二烯(PDP)通路活性高,S.cerevisiae是构建萜类化合物异源合成途径的理想宿主之一。例如,经过途径改造的S.cerevisiae工程菌,合成 (E,E,E)-香叶基香叶醇、(E,E)-法尼醇和丹参酮生物合成前体次丹参酮二烯,产量分别达到3.31 g/L、145.7 mg/L和488 mg/L[7-10]。此外,异戊二烯合酶亚细胞定位能增加萜类化合物的合成量[11]。
香紫苏醇是一种半日花烷型二萜二叔醇,首次在南欧丹参鼠尾草 (Clary sageSalvia sclarea)中发现,常用于化妆品和香水的香料成分及食品调味材料。由于其具有很强的抗菌活性及对真菌生长和植物生长具有调节作用,香紫苏醇也可应用于农药领域。此外,香紫苏醇对人类白血病细胞[12]、结肠癌细胞[13]及异种移植物[13-14]具有细胞毒性。目前,大多以植物香紫苏花序及茎叶为原料提取香紫苏浸膏,进一步纯化得到香紫苏醇。由于香紫苏生长周期长,且受土地、环境及气候因素影响,不能满足工业生产需求。瑞典科研人员发现了香紫苏醇合成的两个关键酶,焦磷酸赖百当烯二醇酯 (LPP)合酶 (SsLPPS)和香紫苏醇合酶 (SsTPS),分别催化香叶基香叶基焦磷酸(GGPP)生成LPP及LPP生成香紫苏醇的反应[15](图1)。以大肠杆菌为宿主,重组真核生物PDP、MVA途径及香紫苏醇的生物合成途径,结合高
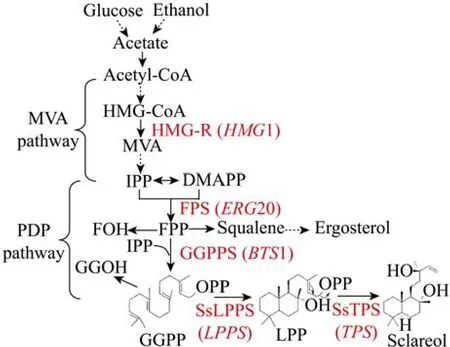
图1 酿酒酵母中香紫苏醇合成策略Fig.1 Schematic diagram of sclareol biosynthesis in S.cerevisiae.Each solid arrow represents one reaction step,and the dashed arrow indicates several reaction steps. Abbreviations: HMG-CoA: 3-hydroxy-3-methylglutaryl coenzyme A;MVA:mevalonate;IPP,isopentenyl pyrophosphate; DMAPP: dimethylallyl diphosphate;FPP:(E,E)-farnesyl diphosphate;FOH:(E,E)-farnesol; GGPP: (E,E,E)-geranylgeranyl diphosphate; GGOH: (E,E,E)-geranylgeraniol; LPP:labdenedioldiphosphate;PDP:prenyldiphosphate;HMG-R:HMG-CoA reductase(HMG1 encoded);FPS:FPP synthase(ERG20 encoded);GGPPS:GGPP synthase(BTS1 encoded);SsLPPS:LPP synthase of S.sclarea(LPPS encoded);SsTPS:terpene synthase of S.sclarea(TPS encoded).Heterologous genes(LPPS and TPS)were derived from S.sclarea and other genes were cloned from S.cerevisiae.
密度发酵技术,香紫苏醇产量达到约1.5 g/L[16]。本实验室最近采用模块化的途径工程策略,快速有效地在S.cerevisiae中组装预先设计好的人工生物合成途径[7]。本文拟利用香紫苏醇合成关键酶的生物学信息,采用模块途径工程策略,构建香紫苏醇人工生物合成途径,探讨过表达代谢关键酶、蛋白质融合及异源蛋白信号肽等因素对S.cerevisiae工程菌合成香紫苏醇的影响,为进一步设计萜类化合物高产菌株提供科学参考。
1 材料与方法
1.1 材料
本文所用菌株列于表1。香紫苏醇、GOH、FOH和GGOH购自Sigma-Aldrich(St.Louis,MO,USA)。PrimeSTAR HS DNA聚合酶购自大连宝生物公司。引物由北京鼎国昌盛生物技术公司合成。全基因合成及测序由大连宝生物公司完成。DNA胶回收试剂盒和质粒提取试剂盒购自江苏碧云天生物技术研究所。其他试剂购自当地供应商。

表1 本文所用菌株及质粒Table 1 Strains and plasmids used in this study
1.2 方法
1.2.1 菌株培养
S.cerevisiae在30℃、200 r/min下培养。营养缺陷型菌株筛选采用SD培养基 (2%葡萄糖,0.67%含(NH4)2SO4的酵母氮源,不添加氨基酸)。摇瓶培养采用YPD培养基 (2%葡萄糖,2%蛋白胨和1%酵母浸膏)。
E.coli在37℃、200 r/min下培养。重组菌株筛选采用LB培养基 (1%NaCl,1%胰蛋白胨,0.5%酵母浸膏,100µg/mL氨苄青霉素添)。
所有培养基均经120℃、20 min灭菌处理。
1.2.2 S.cerevisiae对香紫苏醇的耐受性分析
将S.cerevisiae菌株分别在添加了0 mg/L、30.9 mg/L、308.5 mg/L和925.5 mg/L香紫苏醇的YPD培养基中培养,通过监测细胞密度分析其生长情况。
1.2.3 全基因合成
SsLPPS和SsTPS基因序列经过密码子优化网站 (http://www.jcat.de/Start.jsp)优化,使密码子更适合在S.cerevisiae中表达。优化后的序列由大连宝生物公司合成,分别克隆到pMD19-T载体上,得到重组质粒pMD19-T-LPPS和pMD19-T-TPS。全合成的基因用测序引物pMD18-F(5′-GCCTCTTCGCTATTACGCCA-3′)和pMD18-R(5′-CACTCATTAGGCACCCCAG G-3′)进行测序验证。
1.2.4 重组质粒构建
本文所用质粒列于表1。重组质粒构建均采用模块途径工程策略的方法[7]。具体步骤为:第一步,用高保真聚合酶进行PCR(反应条件:95℃5 min;98℃ 10 s,68℃ 4 min,35个循环;68℃10 min)克隆各模块的不同DNA片段,包括启动子、功能基因、终止子和用于重组的重叠序列;第二步,通过高效的多片段融合PCR(共两轮:前一轮反应条件:95℃5 min;98℃10 s,68℃6 min,15个循环;72℃10 min;后一轮反应条件:95℃5 min;98℃10 s,68℃6 min,35个循环;72℃10 min)方法在体外将模块的不同片段融合连接[17];第三步,利用S.cerevisiae高效地重组性能,将不同模块的DNA片段及线性化的表达载体pYX212(EcoRⅠ和XhoⅠ双酶切)转化到胞内进行同源重组,并在相应营养缺陷型平板上筛选。从表型正确的克隆中提取重组质粒,进一步测序验证各模块间拼接的准确性。
1.2.5 香紫苏醇的提取与检测
将测序正确的载体分别转化S.cerevisiaeBY4741ML,得到工程菌株 S1-S6(图2)。
将S.cerevisiae工程菌株发酵醪液与等体积正己烷混和,在30℃下处理30 min。室温下在玻璃瓶离心 (1 800 r/min)处理8 min,取上层有机相,浓缩后重悬于正己烷中,待测。
香紫苏醇含量利用气相色谱 (GC7890F)系统分析。采用SE-54型毛细管色谱柱 (0.25 mm×30 m),分析条件为:柱温250℃,进样口温度270℃,检测器温度290℃,载气流速1.6 mL/min。在此分析条件下,香紫苏醇的保留时间为8.3 min。
2 结果
2.1 S.cerevisiae的香紫苏醇耐受性
文献报道,香紫苏醇具有植物病原真菌灰葡萄孢菌Botrytis cinerea的抗菌活性[18]。为验证香紫苏醇对真菌酿酒酵母的抗菌活性,考察S.cerevisiaeBY4741ML对香紫苏醇的耐受性。与对照相比,S.cerevisiae在外加925.5 mg/L香紫苏醇的培养基中生长受到抑制,但抑制率仅为14.3%。可见,菌株耐受性应不会成为香紫苏醇异源合成途径功能体现的制约因素。
2.2 PDP通路的影响
增加前体供给是一种常用且有效的促进目标产物合成的策略。以往实验证实,过表达PDP通路的关键酶法尼基焦磷酸 (FPP)合酶(FPPS,ERG20编码)或 GGPP合酶 (GGPPS,BTS1编码)(图1),或同时过表达上述两个酶,均有利于工程菌株产生二萜化合物次丹参酮二烯[7]。菌株S2,过表达FPPS和 GGPPS融合蛋白 (两蛋白之间用柔性连接肽GGGS连接)及过表达异源的SsLPPS和SsTPS蛋白,而对照株菌株S1仅过表达SsLPPS和SsTPS(图 2)。实验中未检测到菌株S1合成香紫苏醇 (GC检测限约0.1 mg/L),而菌株S2香紫苏醇产量达到(2.05±0.46)mg/L。

图2 不同酿酒酵母菌株的重组质粒 (A)和香紫苏醇产量 (B)Fig.2 Recombinant plasmids(A)and sclareol production(B)of different S.cerevisiae strains.(A)Genes(arrows with white gene name):BTS1:encoding for GGPP synthase;ERG20:encoding for FPP synthase;LPPS:encoding for LPP synthase;TPS:encoding for terpene synthase;tLPPS:encoding for truncated LPP synthase;and tTPS:encoding for truncated terpene synthase;tHMG1:encoding for HMG-CoA reductase;promoters(green arrows):TPIp,TEF1p and TDH3p;terminators(red rectangles):FBA1t,TDH2t,pYX212t and TDH3t;linker peptide(yellow rectangles):glycine-glycine-glycine-serine(GGGS).Heterologous genes(LPPS,TPS,tLPPS and tTPS)were derived from S.sclarea;other genes,promoters and terminators were cloned from S.cerevisiae.(B)S.cerevisiae cells at 30℃,200 r/min for 48 h,and the culture broth was used for extraction of sclareol.Each result represents the average of three independent clones.
2.3 异源蛋白信号肽对香紫苏醇合成的影响
通过网站TargetP1.1(http://www.cbs.dtu.dk/services/TargetP/)和ChloroP1.1(http://www.cbs.dtu.dk/services/ChloroP/)对SsLPPS和SsTPS进行信号肽预测,并结合过去的实验结果[15],推测N-末端分别含有63个氨基酸和50个氨基酸组成的信号肽。菌株S3,过表达去除信号肽的SsLPPS(tSsLPPS)和SsTPS(tSsTPS)及融合蛋白GGPPS-FPPS(图2)。实验发现,菌株S3香紫苏醇产量达到 (5.00±0.66)mg/L,是携带信号肽表达菌株S2产量的2.4倍。可见,去除异源酶的信号肽,有利于其在S.cerevisiae中发挥功能。
2.4 异源酶融合
将代谢途径中催化相邻的两个或两个以上反应的酶融合表达,可增加代谢途径通量[7,19]。进一步融合异源酶或去除信号肽的截短异源酶,以确定其对香紫苏醇合成的影响。菌株S4和S5在过表达融合蛋白GGPPS-FPPS的基础上,分别过表达融合蛋白LPPS-TPS和tLPPS-tTPS(图2)。实验发现,菌株S4香紫苏醇产量达到(6.05±0.59)mg/L,是菌株S3的1.21倍。然而,菌株S5仅获得 (0.81±0.15)mg/L香紫苏醇,明显低于菌株S3。
2.5 MVA途径对香紫苏醇合成的影响
羟基-3-甲基戊二酰辅酶A还原酶 (HMGR,HMG1编码)是MVA途径的限速酶。相对于完整的 HMGR,去除了 N-端 529 aa调控序列的HMGR(tHMGR,tHMG1编码)更有利于促进人工生物合成途径的活性[7,20]。因此,在菌株S4的基础上进一步过表达tHMGR,得到菌株S6(图2)。实验发现,菌株S6香紫苏醇产量达到(8.96±0.96)mg/L,是菌株S4的1.48倍,是当前香紫苏醇产量较高的S.cerevisiae工程菌。
3 讨论
本文以S.cerevisiaeBY4741ML为宿主,构建香紫苏醇的人工生物合成途径。共构建了6株重组菌株S1至S6,经过摇瓶发酵后,对其香紫苏醇的产量进行比较,结果如图2所示。可见,仅引入异源的香紫苏醇合成两个关键酶LPPS和TPS的菌株S1,未见香紫苏醇产生 (检测限0.1 mg/L);然而,增加二萜化合物前体合成的PDP通路中相应关键酶,即FPPS和GGPPS,使菌株S2的香紫苏醇产量达到 (2.05±0.46)mg/L,说明前体代谢流的加强,可为人工生物合成途径提供更多前体,并且过表达融合蛋白GGPPS-FPPS更有利于代谢流流向GGPP。实验还发现,菌株S1中可检测到 (0.08±0.02)mg/L的FPP水解副产物FOH,而菌株S2则未检测到FOH。通过去除异源酶的N-端信号肽,即过表达tLPPS和tTPS,菌株S3的产量相对菌株S2提高144%,可能因为信号肽去除后更有利于蛋白表达,或它们在S.cerevisiae中的活性更高。菌株S4和S5分别表达融合的全长和融合的去除N-端信号肽的异源酶,即分别为LPPS-TPS和tLPPS-tTPS,经过香紫苏醇的产量比较,相对菌株S3,菌株S4的产量提高21%,而菌株S5反而降低84%。其中,菌株S4产量提高可能是由于蛋白质融合拉近了反应活性中心的距离,使前一步反应的产物易于到达下一步反应的活性中心,从而减少底物扩散。文献报道,将双酶催化的反应转化为一个双功能蛋白催化后,产量可增加30%以上[21]。奇怪的是,菌株S5却没有取得很好的结果,推测可能由于截短N端序列的两蛋白融合后,导致C-端蛋白 (TPS)的空间构型发生变化,降低了催化活性。为进一步提高产量,构建了菌株S6,即在前面较高产量的菌株S4中进一步过表达MVA途径的关键酶HMGR的催化部分(tHMGR),相对菌株S4,香紫苏醇的产量提高48%。文献构建了香紫苏醇大肠杆菌工程菌株,结合高密度发酵技术,产量已达到约1.5 g/L[16]。因此,尚需要进一步改造相关途径或采用发酵工程技术,以提高S.cerevisiae工程菌株香紫苏醇产量。
[1]Bohlmann J,Keeling CI.Terpenoid biomaterials.Plant J,2008,54(4):656−669.
[2]Misawa N.Pathway engineering for functional isoprenoids.Curr Opin Biotechnol,2011,22(5):627−633.
[3]Ajikumar PK,Tyo K,Carlsen S,et al.Terpenoids:opportunities for biosynthesis of natural product drugs using engineered microorganisms. Mol Pharm,2008,5(2):167−190.
[4]Martin VJ,Pitera DJ,Withers ST,et al.Engineering a mevalonate pathway inEscherichia colifor production of terpenoids.Nat Biotechnol,2003,21(7):796−802.
[5]Ajikumar PK,Xiao WH,Tyo KE,et al.Isoprenoid pathway optimization for taxol precursor overproduction inEscherichia coli.Science,2010,330(6000):70−74.
[6]Alper H, Miyaoku K, Stephanopoulos G.Construction of lycopene-overproducingE.colistrains by combining systematic and combinatorial gene knockout targets.Nat Biotechnol,2005,23(5):612−616.
[7]Zhou YJ,Gao W,Rong Q,et al.Modular pathway engineering ofditerpenoid synthases and the mevalonic acid pathway for miltiradiene production.JAm Chem Soc,2012,134(6):3234−3241.
[8]Tokuhiro K,Muramatsu M,Ohto C,etal.Overproduction of geranylgeraniol by metabolically engineeredSaccharomycescerevisiae. Appl Environ Microbiol,2009,75(17):5536−5543.
[9]Ohto C, Muramatsu M, Obata S, et al.Overexpression of the gene encoding HMG-CoA reductase inSaccharomycescerevisiaefor production of prenyl alcohols.Appl Microbiol Biotechnol,2009,82(5):837−845.
[10]Dai Z,Liu Y,Huang L,et al.Production of miltiradiene by metabolically engineeredSaccharomycescerevisiae. Biotechnol Bioeng,2012,109(11):2845−2853.
[11]Farhi M,Marhevka E,Masci T,et al.Harnessing yeast subcellular compartments for the production of plantterpenoids.Metab Eng,2011,13(5):474−481.
[12]Dimas K,Kokkinopoulos D,Demetzos C,et al.The effectofsclareolon growth and cellcycle progression of human leukemic cell lines.Leuk Res,1999,23(3):217−234.
[13]Dimas K,Hatziantoniou S,Tseleni S,et al.Sclareol induces apoptosis in human HCT116 colon cancer cellsin vitroand suppression of HCT116 tumor growth in immunodeficient mice.Apoptosis,2007,12(4):685−694.
[14]Mahaira LG,Tsimplouli C,Sakellaridis N,et al.The labdanediterpene sclareol(labd-14-ene-8,13-diol)induces apoptosis in human tumor cell lines and suppression of tumor growthin vivovia a p53-independentmechanism ofaction.Eur J Pharmacol,2011,666(1/3):173−182.
[15]Schalk M.Method for producing sclareol.WO,2009101126.2009-08-20.
[16]Schalk M,Pastore L,Mirata MA,et al.Toward a biosynthetic route to sclareol and amber odorants.J Am Chem Soc,2012,134(46):18900−18903.
[17]Yu JH,Hamari Z,Han KH,et al.Double-joint PCR:a PCR-based moleculartoolforgene manipulations in filamentous fungi.Fungal Genet Biol,2004,41(11):973−981.
[18]Stukkens Y,Bultreys A,Grec S,et al.NpPDR1,a pleiotropic drug resistance-type ATP-binding cassette transporter fromNicotiana plumbaginifolia,plays a major role in plant pathogen defense.Plant Physiol,2005,139(1):341−352.
[19]Dueber JE,Wu GC,Malmirchegini GR,et al.Synthetic protein scaffolds provide modular control over metabolic flux.Nat Biotechnol,2009,27(8):753−759.
[20]Donald KA,Hampton RY,Fritz IB.Effects of overproduction of the catalytic domain of 3-hydroxy-3-methylglutaryl coenzyme A reductase on squalene synthesis inSaccharomyces cerevisiae.Appl Environ Microbiol,1997,63(9):3341−3344.
[21]Varman AM, Xiao Y, Leonard E, et al.Statistics-based model for prediction of chemical biosynthesis yield fromSaccharomyces cerevisiae.Microb Cell Fact,2011,10:45.
