微生物木糖代谢途径改造制备生物基化学品
2013-09-04刘维喜付晶章博陈涛
刘维喜,付晶,章博,陈涛
天津大学化工学院 系统生物工程教育部重点实验室,天津 300072
随着20世纪两次石油危机的发生以及当前越来越严重的环境污染问题,资源和能源供给以及环境保护成为人类在21世纪生存发展过程中所面临的最严峻挑战,也是未来制约我国社会经济发展的主要因素。为了人类的生存和持久的发展,开发安全、环保、可持续利用的替代资源已经成为世界各国面临的紧迫任务[1]。
在木质纤维素原料中,木糖的含量为18%~30%,是自然界中第二大的糖类物质[2]。研究显示,木糖的充分利用和转化约占木质纤维资源生物炼制体系总生产成本的25%,因此木糖的高效率生物转化研究成为木质纤维素原料开发利用的基础,也是影响其工业化利用前景的关键因素之一[2-4]。
当前,合成生物学技术日新月异的快速发展,极大地丰富了微生物的改造方法和技术,已经成为现代生物科学领域最富生机的学科之一。本文重点关注了近几年间国内外研究人员对不同微生物木糖代谢途径的认识,以及合成生物技术在微生物改造方面的应用,包括木糖运输过程改造和代谢途径重组所取得的最新研究成果,重点分析了微生物代谢木糖生产清洁燃料乙醇、大宗化学品乳酸和高附加值产品木糖醇等方面的研究进展,并展望合成生物学技术在改造木糖代谢菌株生产重要生物基化学品方面的应用前景。
1 木糖生物转化途径
构建木糖高效代谢工程菌的一个关键问题就是要了解微生物代谢利用木糖的途径,进而为构建高效的木糖代谢工程菌株提供理论指导。
当前,从自然界分离的可以天然代谢利用木糖的微生物主要包括细菌、酵母菌和丝状真菌。为了充分利用生存环境中的木糖来满足生长的需求,这些微生物经过长期的进化产生了截然不同的木糖利用途径。如图1所示,在自然界可以天然代谢木糖的酵母及某些真菌内,存在着一条由几种不同的酶促反应组成的代谢途径:进入细胞内的木糖首先在依赖NADPH的木糖还原酶(Xylose reductase,XR)的作用下转化为木糖醇,随后通过NAD+依赖型木糖醇脱氢酶 (Xylitol dehydrogenase,XDH)形成木酮糖,最后再经过木酮糖激酶 (Xylulokinase)催化形成木酮糖-5-磷酸,由此进入戊糖磷酸途径[3,5]。然而,在一些常见的细菌如大肠杆菌中,木糖可以直接经过木糖异构酶 (Xylose isomerase,XI)作用形成木酮糖而不需要辅酶参与,并随后经过木酮糖激酶的催化作用形成木酮糖-5-磷酸进入戊糖磷酸途径。除了这两种典型的木糖代谢途径以外,在丙酮丁醇梭菌Clostridium acetobutylicum[6]、乳酸乳球菌Lactococcus lactis[7]中还存在磷酸转酮酶途径 (Phosphoketolase pathway,PK)。在该代谢途径中,木酮糖-5-磷酸被催化裂解形成乙酰磷酸和甘油醛-3-磷酸而进入糖酵解途径。最近,研究人员在新月柄杆菌Caulobacter crescentus中鉴定了一条木糖代谢产生α-酮戊二酸 (α-ketoglutarate)的代谢途径[8]。木糖进入细胞后经过木糖脱氢酶(Xylose dehydrogenase)、木糖酸内酯酶(Xylonolactonase)以及木糖酸脱水酶 (Xylonate dehydratase)催化生成 2-酮-3-脱氧-木糖酸(2-keto-3-deoxy-xylonate),然后再依次经过脱水及脱氢反应生成α-酮戊二酸进入三羧酸循环(Tricarboxylic acid cycle,TCA)。
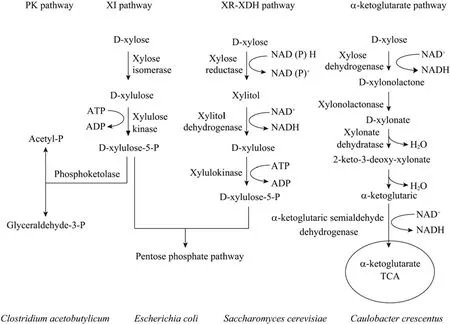
图1 不同微生物的木糖代谢途径Fig.1 Metabolic pathways of xylose in various microorganisms.
2 木糖代谢工程菌的构建
目前,木糖代谢工程菌的构建工作已在多种微生物中进行 (表1),包括酿酒酵母Saccharomyces cerevisiae[9-10]、运动发酵单胞菌Zymomonas mobilis[11-12]、大肠杆菌Escherichia coli[13-14]等。合成生物学技术强调对已知代谢途径的重组和再设计以及生物功能模块的组装,因此运用基因重组技术获得高效的木糖代谢途径成为研究人员关注的重点。
2.1 木糖代谢途径的重组
“后基因组时代”的到来使人们获得了大量的基因、蛋白及代谢物数据信息,研究人员利用生物信息学技术在细菌中鉴定一些与木糖代谢相关的基因,酶活力得到了测定和分析。因此,通过分析木糖代谢途径中所缺乏的酶促反应,在宿主细胞中引入异源的酶从而构建一条完整的木糖代谢途径成为可能。
运动发酵单胞菌通过Entner-Doudoroff途径将葡萄糖转化为乙醇,是一种乙醇生产能力非常突出的微生物。由于Z.mobilis缺乏代谢利用五碳糖的能力,限制了其在纤维素生物质领域进一步的开发利用。研究发现,Z.mobilis缺乏戊糖磷酸途径中的4个关键酶——木糖异构酶 (Xylose isomerase)、木酮糖激酶 (Xylulokinase)、转醛醇酶 (Transaldolase)和转酮醇酶 (Transketolase),Zhang等[11]通过引入来自大肠杆菌的基因xylAB、talB、tktA并将其构建成合成生物学中最简单最原始的生物装置——操纵子结构Pgap-xylA-xylB和Peno-tal-tktA,在Z.mobilis中成功组建了一条木糖代谢途径。发酵条件下,工程菌株CP4(pZB5)能够在50 h内完全利用25 g/L木糖,为后续Z.mobilis木糖代谢的相关研究提供了借鉴[15]。同样,2012年,Xiong等[16]通过在红球菌Rhodococcus jostiiRHA1中异源表达变铅青链霉菌Streptomyces lividansTK23的xylAB基因从而构建了一条木糖代谢途径。
与此同时,生物信息学的不断发展为科研人员提供了更加便捷的研究手段。2006年,Kawaguchi等[4]运用生物信息学技术分析了谷氨酸棒杆菌Corynebacterium glutamicumR菌株的基因序列,通过基因序列对比发现了一个编码木酮糖激酶的基因xylB,然后通过引入来自大肠杆菌编码木糖异构酶的基因xylA实现了谷氨酸棒杆菌木糖的代谢利用,拓宽了其底物利用范围。随后,Sasaki等[17]通过在C.glutamicumR菌株基因组中非必需基因位点整合多个拷贝的xylAB基因以提高异源木糖异构酶和木酮糖激酶的表达水平,发现菌体的生长和木糖消耗速率也得到改善。由此可见,针对不能够天然代谢木糖的微生物,通过异源表达木糖代谢所需的酶从而对宿主细胞的代谢途径进行定向改造,对实现微生物的木糖利用是至关重要的。
2.2 木糖代谢辅酶工程
在酵母菌及真菌的木糖代谢网络中,木糖到木酮糖的生物转化是由木糖还原酶和木糖醇脱氢酶所组成的酶促反应来实现的,由于两者之间辅酶的不同,导致菌体氧化还原失衡,严重阻碍了木糖的代谢利用[9]。随着蛋白质工程和生物信息学技术的快速发展,利用定点突变等方法与计算机辅助模拟相结合以改造酶蛋白的辅酶专一性而减弱氧化还原不平衡引起众多的关注。
Watanabe等[27]通过对木糖醇脱氢酶进行点突变,引入能够增加热稳定性的锌指结构,使其由NAD+依赖型变成倾向于NADP+依赖型,并在S.cerevisiae中表达突变的木糖醇脱氢酶,工程菌Y-ARSdR木糖发酵副产物木糖醇减少了86%,而目标产物乙醇的产量提高了41%[28]。2011年,Khattab等[29]对木糖还原酶进行定点基因改造,改造后的木糖还原酶对NADPH的专一性提高了27%,而对NADH的活性可以忽略不计。2012年,Lee等[30]通过在S.cerevisiaeD452-2中引入木糖醇脱氢酶和依赖NADH的木糖还原酶,工程菌SX2MUT消耗22.9 g/L的木糖仅产生了0.24 g/L的木糖醇,而表达木糖醇脱氢酶和依赖NADPH的木糖还原酶的对照菌株SX2WT消耗32.1 g/L的木糖却产生了10.6 g/L的木糖醇,数据显示经过辅酶改造后的工程菌显著减少了发酵副产物的累积。从这些工作中可以看出,蛋白质工程在改造酶的专一性、降低副产物的积累等方面具有光明前景,有助于提高木糖的利用效率、改善菌体生长。
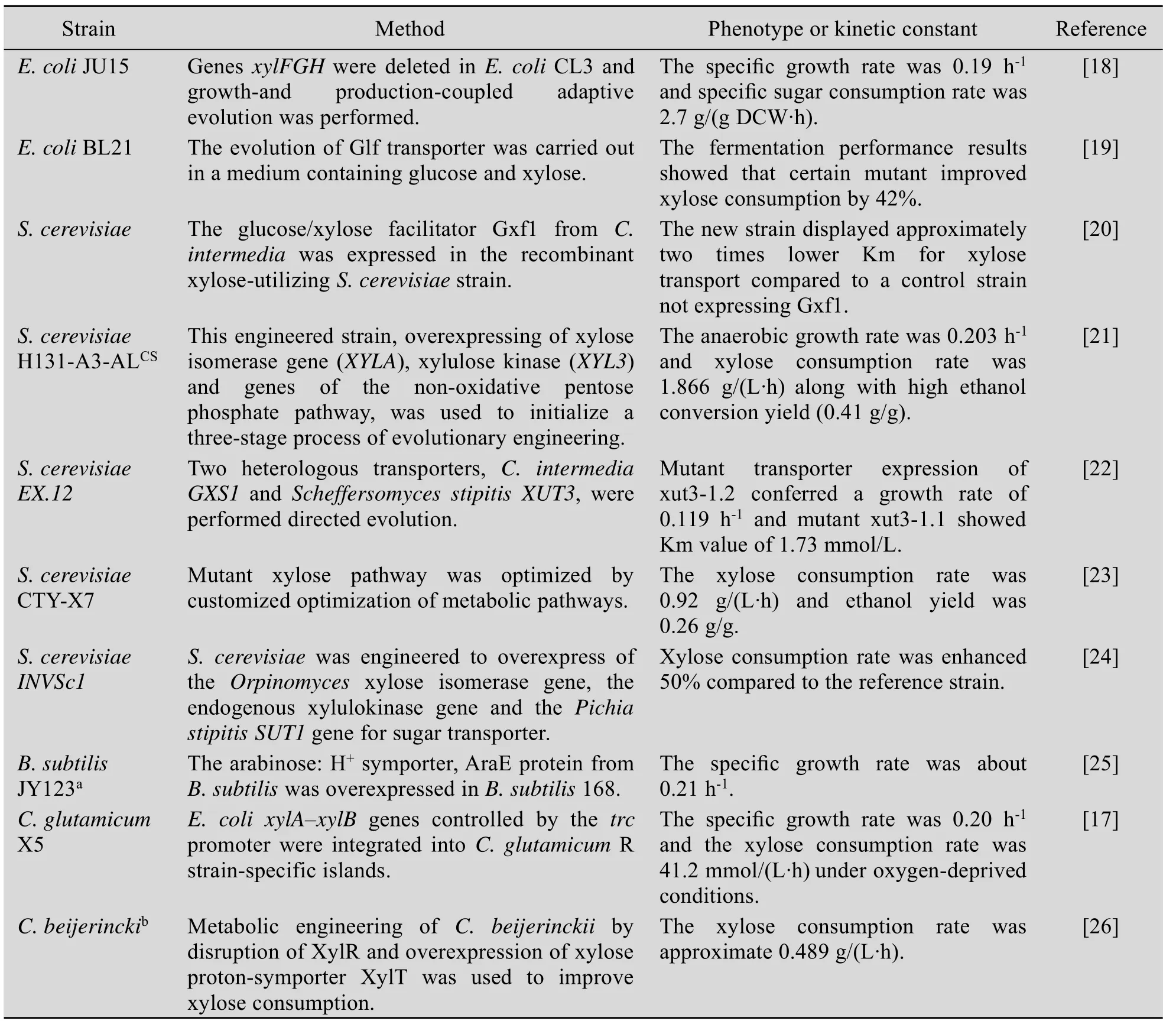
表1 微生物木糖代谢工程菌的研究Table 1 Summary of the studies on engineering microorganism for xylose metabolism.
2.3 木糖代谢途径的模块化组装
合成生物学技术关注于根据人类的意愿从头设计新的生物体以及对现有生物进行重新设计和改造,这就为在宿主细胞中组装异源代谢途径而获得期望的基因线路提供了更加有力的分子生物学工具,进而获得性能优良的工业菌株、建立高效的生物转化细胞工厂。美国伊利诺伊大学赵惠民研究组通过在酿酒酵母中对不同的基因元件进行快速组装,建立了一种高效的代谢途径组装工具DNA assembler[31],并利用这种工具对不同的基因和启动子进行组装,提出了一种称为COMPACTER(Customized optimization of metabolic pathways by combinatorial transcriptional engineering)的微生物改造方法[23]。在S.cerevisiae中,通过对不同的基因元件进行从头组装设计,他们搭建了不同转录强度的木糖代谢途径,然后通过筛选获得了木糖代谢性状优良的目标工程菌株。经验证,该菌株的木糖消耗速率接近当时已经报道的最高水平,为构建高效代谢木糖的微生物菌株提供了一种新型、快捷、有效的理论和方法。
3 木糖运输途径改造
木糖等底物能够被微生物细胞迅速代谢的前提是糖类必须通过微生物的膜转运蛋白高效地运输到细胞内部。在传统代谢工程技术背景下,一般认为细胞内生物酶促反应是限制细胞代谢的决定性因素,仅通过过量表达催化相应限速反应的酶就可以增加代谢途径的通量,提高糖的代谢效率,而对细胞膜蛋白的分子运输功能并没有给予过多的关注[22]。随着近年来研究不断深入,研究人员发现在某些条件下糖类底物的分子运输速率常常决定了细胞代谢的快慢[32],所以,对微生物分子运输途径进行改造成为了代谢途径工程一个新的研究内容和研究热点[26,33]。
2009年,Runquist等[20]在S.cerevisiaeTMB 3057中表达来自间型假丝酵母Candida intermedia的葡萄糖/木糖协助运输蛋白Glf1,工程菌TMB 3411对木糖的亲和力提高了2倍。Madhavan等[24]在过表达木糖异构酶和木酮糖激酶的基础上进一步引入毕赤酵母Scheffersomyces stipitis的运输蛋白SUT1,S.cerevisiae木糖消耗速率提高了50%。2012年,Young等[22]首次利用定向进化技术对C.intermedia的GXS1运输蛋白和S.stipitis的XUT3运输蛋白进行研究,通过对分子运输蛋白进行少量的点突变解除了S.cerevisiae木糖代谢过程中存在的戊糖运输瓶颈,其中某些进化菌株比生长速率可以提高70%。
Ren等[19]在E.coliBL21中通过对Z.mobilis的葡萄糖协助运输蛋白Glf进行高通量的突变筛选,获得了一个木糖运输速率提高42%的运输蛋白。由于木糖运输蛋白的转录和表达解除了葡萄糖的抑制,为大肠杆菌同时利用葡萄糖和木糖的相关研究提供了参考。2012年,Utrilla等[18]将代谢工程和适应性进化技术相结合,通过对敲除xylFGH的菌株JU01进化培养,使半乳糖PTS运输蛋白进化为一个高效的木糖运输蛋白。结合微生物“组学”研究手段,通过对进化菌株的多尺度和多层次解析为今后微生物进一步的改造工作提供指导。
在革兰氏阳性菌株枯草芽胞杆菌Bacillus subtilis中,尽管其具有木糖代谢所必需的木糖异构酶和木酮糖激酶的编码基因xylAB,以及编码木糖同向运输蛋白的基因araE,但是由于araE的转录受到严格的调控,木糖运输能力非常有限[34]。2012年,Park等[25]利用启动子PxylA、基因araE和终止子fba构建了一个木糖运输蛋白AraE的表达序列,获得了工程菌株JY123。发酵数据显示,工程菌株JY123在完全好氧的条件下25 h可以耗尽5.4 g/L的木糖,比生长速率达到0.21 h−1,菌株代谢木糖的能力得到了显著改善。
木糖运输对代谢过程的重要性为木糖代谢工程菌株的改造提供了一个借鉴。由于S.cerevisiae、E.coli、B.subtilis均是安全的微生物模式菌株,基因操作技术丰富,结合合成生物学技术对这些模式菌株进行快速、高效的改造以改善微生物木糖代谢必将引起更多的关注。
4 木糖生物转化制备生物基化学品
作为一种基于可再生资源木糖的绿色可持续发展方式,利用代谢工程、合成生物学等技术改造微生物,使其能够以木糖为底物进行高效的生物炼制生产重要的生物基化学品 (表2),如清洁燃料乙醇、生物基础材料乳酸、功能性甜味剂木糖醇等,引起了广泛的关注。
4.1 木糖生物转化制备乙醇
全球石油储备的减少以及能源价格的持续上涨促进了世界各国人员对清洁燃料乙醇进行研究[35]。近年来,S.cerevisiae由于其优良的工业生产性状引起了广泛的关注。利用合成生物学原理,Du等[23]在S.cerevisiae中组装异源的木糖代谢途径,通过代谢途径重组优化基因的表达水平和代谢通量,仅一轮重组后即筛选到乙醇产率接近当时已报道最高水平的重组菌株,说明了合成生物学技术在改造S.cerevisiae生产乙醇领域具有巨大的优势。区别于传统的代谢工程改造,合成生物学可以通过模块的快速搭建配置生命机器以实现生物燃料的微生物生产,而不受宿主细胞原有代谢路径的限制。不过,传统的代谢工程和进化手段也在推动着木糖代谢乙醇研究的发展。2011年,Agrawal等[15]在对Z.mobilis进行基因改造的基础上,通过30次转接进化培养,获得了一株能够在100 g/L的木糖培养基上生长良好的菌株。在46 h内该进化菌株能够完全利用100 g/L的木糖,并且乙醇的得率达到理论得率的88%,具有较好的工业应用前景。2012年,Zhou等[21]运用代谢工程对S.cerevisiae进行改造使其能够代谢木糖,再利用进化工程提高菌体生长速率和乙醇产率。厌氧发酵显示,工程菌株H131-A3-ALCS的木糖消耗速率为 1.866 g/(L·h),乙醇转化率达到0.41 g/g,这是目前运用酿酒酵母为宿主菌代谢木糖生产乙醇所取得的最高水平,具有较好的工业应用价值。
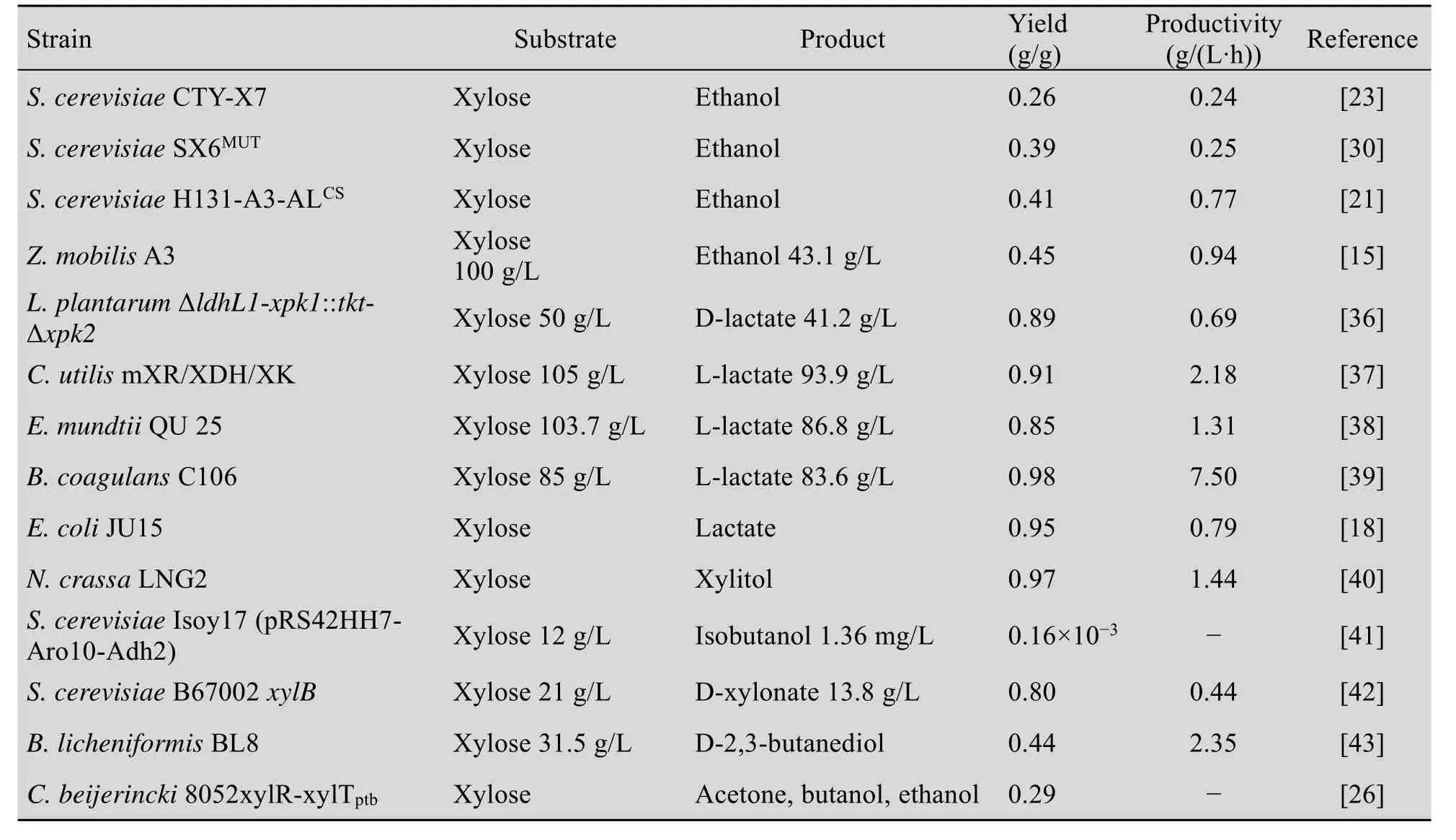
表2 不同微生物代谢木糖生产生物基化学品Table 2 List of xylose utilizing recombinant microorganisms for bio-based chemicals production
4.2 乳酸、木糖醇等化学品的制备
近年来,乳酸作为可降解树脂的生产原料而备受关注[13],被美国能源部下属的可再生能源实验室 (National Renewable Energy Laboratory)和西北太平洋国家实验室 (Pacific Northwest National Laboratory)列为生物质炼制最具发展前景的30种生物基础材料之一[44]。2011年,Abdel-Rahman等[38]分离了一种能够有效代谢木糖生产乳酸的蒙氏肠球菌Enterococcus mundtiiQU25。在分批发酵情况下,该菌能够利用691 mmol/L的木糖生产964 mmol/L纯度高于99.9%的L-lactate,发酵得率为1.41 mol/mol木糖。2012年,Tamakawa等[37]对产朊假丝酵母C.utilis进行基因工程改造,敲除了丙酮酸脱羧酶编码基因并过表达了乳酸脱氢酶、木糖还原酶、木糖醇脱氢酶和木酮糖激酶。在发酵条件下,工程菌mXR/XDH/XK能够在43 h内消耗105 g/L的木糖生产93.9 g/L的L-lactate。Okano等[36]敲除了植物乳杆菌Lactobacillus plantarum中与L-lactate形成有关的乳酸脱氢酶基因,并用外源的转酮醇酶基因tkt替代细菌自身的磷酸转酮酶基因xpk1,实现了菌株由异型乳酸发酵到同型乳酸发酵的转变,在60 h内,工程菌消耗50 g/L的木糖产生了41.2 g/L的D-lactate。
木糖醇是一种有甜味的五碳糖醇,在人体代谢时不需要消耗胰岛素,可以作为糖尿病人的营养剂及功能性甜味剂,广泛用于医药保健品和化工等行业。利用微生物发酵生产木糖醇污染小,过程易于操作,可有效降低木糖醇的生产成本,具有良好的社会和经济效益。2012年,Ahmad等[45]敲除热带假丝酵母C.tropicalis中编码木糖醇脱氢酶的基因xyl2,并过表达zwf、gnd基因增加戊糖磷酸途径的代谢通量,以木糖与甘油作为底物进行发酵,工程菌PP的木糖醇产量比出发菌株BSXDH-3提高了21%。Jeon等[40]对粗糙脉孢菌Neurospora crassa中编码木糖还原酶的基因进行密码子优化,并将优化后的基因NXRG在缺失了木糖醇脱氢酶基因的C.tropicalis中表达,以葡萄糖和木糖为底物进行发酵,工程菌LNG2的木糖醇得率达到了96%,生产率为1.44 g/(L·h)。
除了乙醇、乳酸和木糖醇外,一些新型产品的木糖生物炼制研究也引起了广泛的关注,如异丁醇[41]、木糖酸[42]、2,3-丁二醇[43]、丙酮:丁醇:乙醇[26]等。近期,本课题组利用不同的基因元件构建了一个高效利用木糖的基因模块(P43
-araE,P43-xylAB),将其导入B.subtilis后可在微氧发酵条件下代谢木糖生产化学品3-羟基丁酮和单一构型2,3-丁二醇,显示了重要的应用潜力。随着木糖代谢研究的蓬勃发展,利用生物炼制技术生产生物基化学品将进入发展的快车道。
5 结论与展望
利用微生物转化木糖生产生物基化学品具有光明的应用前景,但是为了降低生产成本,实现工业化应用的目标,还需要对微生物的木糖运输过程、代谢途径等方面进一步改造,获得遗传性状和发酵性能优良的微生物木糖代谢菌株[46]。
提高微生物的木糖运输速率是改善木糖代谢的关键环节之一。研究显示,在多种微生物体内,木糖的运输是通过MFC家族 (Major facilitator superfamily)的同向运输膜蛋白来完成的[33]。由于这些运输蛋白对底物木糖的亲和力较低 (高Km值),并且运输过程不消耗ATP,导致木糖不能够被高效的运输到胞内。随着全基因组测序技术的进步和多种木糖代谢微生物测序工作的完成[47-48],结合适应性进化技术的运用[18],为筛选鉴定高效专一的木糖运输蛋白提供了可能。
运用合成生物学技术协调木糖代谢途径的表达。当前,对于多数不能天然代谢木糖的微生物改造工作基本都是通过在宿主细胞中表达异源的木糖代谢酶来完成的。然而,异源基因的引入通常会引起宿主细胞氧化还原不平衡从而产生代谢负担、毒性副产物的积累或者其他抑制生长的瓶颈,这时对于细胞代谢途径进行通量的调节就显得格外重要。合成生物学技术的快速发展为代谢途径的改造提供了更有力的分子生物学工具,通过在宿主细胞中组装异源的酶功能模块获得最适宜的基因元件组合或者利用合成生物学理论定向设计全新的代谢途径,从而产生高效代谢木糖的工程菌株。另外,微生物“组学”技术的不断发展为利用合成生物学技术定向设计和构建高效菌株的工作提供更多的改造靶点参考。
生物基化学品的木糖生物炼制研究。工业生物技术的快速发展使得以生物能源、生物基化学品和生物材料为代表的现代新兴工业迅速兴起,利用可再生资源木糖以清洁高效的生物炼制方式替代传统化学合成方式是社会发展的必然趋势。目前,开发高效代谢木糖的产乙醇重组菌成为全球关注的重点。通过基因工程、进化培养等技术选育耐高乙醇浓度和耐高渗能力的产乙醇菌株和基因工程重组菌株,以及利用先进的发酵生产工艺[49]是缩短发酵周期、提高乙醇产量、降低成本的关键。可以预见,关于这些方面的研究将成为未来研究的重点之一。
当前,合成生物学技术在微生物代谢途径改造领域广泛的应用使传统的代谢工程和基因工程焕发出新的生命力,使构建高效木糖代谢生物有机体成为可能,结合先进的发酵工艺进行生物转化生产重要的工业化学品,不但可以弥补化石燃料的不足,缓解我国严重依赖进口石油的被动局面,而且可以达到保护生态环境的目的,促进我国工业的健康、可持续发展。
[1]Rubin EM.Genomics of cellulosic biofuels.Nature,2008,454(7206):841−845.
[2]Xu Y,Wang Y,Zhu JJ,et al.A new way for bioconversion of xylose in high efficiency.China Biotechnol,2012,32(5):113−119(in Chinese).
徐勇,王荥,朱均均,等.木糖高效生物转化的新出路.中国生物工程杂志,2012,32(5):113−119.
[3]Kuhad RC,Gupta R,Khasa YP,et al.Bioethanol production from pentose sugars:current status and future prospects.Renew Sust Energ Rev,2011,15(9):4950−4962.
[4]KawaguchiH,Vertes AA,Okino S,etal.Engineering of a xylose metabolic pathway inCorynebacteriumglutamicum. Appl Environ Microbiol,2006,72(5):3418−3428.
[5]Scalcinati G,Otero JM,Van Vleet JR,et al.Evolutionary engineering ofSaccharomyces cerevisiaefor efficient aerobic xylose consumption.FEMS Yeast Res,2012,12(5):582−597.
[6]Liu L,Zhang L,Tang W,et al.Phosphoketolase pathway forxylose catabolism inClostridium acetobutylicumrevealed by13C metabolic flux analysis.J Bacteriol,2012,194(19):5413−5422.
[7]Tanaka K,Komiyama A,Sonomoto K,et al.Two different pathways for D-xylose metabolism and the effect of xylose concentration on the yield coefficient of L-lactate in mixed-acid fermentation by the lactic acid bacteriumLactococcus lactisIO-1.Appl Microbiol Biotechnol,2002,60(1):160−167.
[8]Stephens C,Christen B,Fuchs T,et al.Genetic analysis of a novel pathway for D-xylose metabolism inCaulobacter crescentus.J Bacteriol,2007,189(5):2181−2185.
[9]Hector RE,Mertens JA,Bowman MJ,et al.Saccharomyces cerevisiaeengineered for xylose metabolism requires gluconeogenesis and the oxidative branch of the pentose phosphate pathway for aerobic xylose assimilation.Yeast,2011,28(9):645−660.
[10]Ma TY,Lin TH,Hsu TC,et al.An improved method ofxylose utilization by recombinantSaccharomycescerevisiae. J Ind Microbiol Biotechnol,2012,39(10):1477−1486.
[11]Zhang M,Eddy C,Deanda K,et al.Metabolic Engineering of a Pentose Metabolism Pathway in EthanologenicZymomonas mobilis.Science,1995,267(5195):240−243.
[12]Ma Y,Dong H,Zou S,et al.Comparison of glucose/xylose co-fermentation by recombinantZymomonas mobilisunder different genetic and environmental conditions.Biotechnol Lett,2012,34(7):1297−1304.
[13]Nduko JM, Matsumoto K, Ooi T, et al.Effectiveness of xylose utilization for high yield production of lactate-enriched P(lactate-co-3-hydroxybutyrate)using a lactate-overproducing strain ofEscherichiacoliand an evolved lactate-polymerizing enzyme.Metab Eng,2013,15:159−166.
[14]Manow R,Wang J,Wang Y,et al.Partial deletion ofrng(RNase G)-enhanced homoethanol fermentation ofxylose by the non-transgenicEscherichiacoliRM10. J Ind Microbiol Biotechnol,2012,39(7):977−985.
[15]Agrawal M,Mao Z,Chen RR.Adaptation yields a highly efficient xylose‐fermentingZymomonas mobilisstrain.Biotechnol Bioeng,2011,108(4):777−7785.
[16]Xiong X,Wang X,Chen S.Engineering of a xylose metabolic pathway inRhodococcusstrains.Appl Environ Microbiol,2012,78(16):5483−5491.
[17]Sasaki M,Jojima T,Inui M,et al.Simultaneous utilization of D-cellobiose, D-glucose, and D-xylose by recombinantCorynebacterium glutamicumunder oxygen-deprived conditions.Appl Microbiol Biotechnol,2008,81(4):691−699.
[18]Utrilla J,Licona-Cassani C,Marcellin E,et al.Engineering and adaptive evolution ofEscherichia colifor D-lactate fermentation reveals GatC as a xylose transporter.Metab Eng,2012,14(5):469−476.
[19]Ren C,Chen T,Zhang J,et al.An evolved xylose transporterfromZymomonasmobilisenhances sugar transport inEscherichia coli.Microb Cell Fact,2009,8(1):66.
[20]RunquistD,Fonseca C,Rådström P,etal.Expression of the Gxf1 transporter fromCandida intermediaimproves fermentation performance in recombinant xylose-utilizingSaccharomyces cerevisiae.Appl Microbiol Biotechnol,2009,82(1):123−130.
[21]Zhou H,Cheng JS,Wang BL,et al.Xylose isomerase overexpression along with engineering of the pentose phosphate pathway and evolutionary engineering enable rapid xylose utilization and ethanol production bySaccharomyces cerevisiae.Metab Eng,2012,14(6):611−622.
[22]YoungEM,Comer AD,HuangH,etal.A moleculartransporterengineering approach to improving xylose catabolism inSaccharomyces cerevisiae.Metab Eng,2012,14(4):401−411.
[23]Du J,Yuan Y,Si T,et al.Customized optimization of metabolic pathways by combinatorial transcriptional engineering.Nucleic Acids Res,2012,40(18):e142.
[24]Madhavan A,Tamalampudi S,Ushida K,et al.Xylose isomerase from polycentric fungusOrpinomyces: gene sequencing, cloning, and expression inSaccharomycescerevisiaefor bioconversion of xylose to ethanol.Appl Microbiol Biotechnol,2009,82(6):1067−1078.
[25]Park YC,Jun SY,Seo JH.Construction and characterization of recombinantBacillus subtilisJY123 able to transportxylose efficiently.J Biotechnol,2012,161(4):402−406.
[26]Xiao H,Li Z,Jiang Y,et al.Metabolic engineering of D-xylose pathway inClostridium beijerinckiito optimize solvent production from xylose mother liquid.Metab Eng,2012,14(5):569−578.
[27]Watanabe S,Kodaki T,Makino K.Complete reversal of coenzyme specificity of xylitol dehydrogenase and increase of thermostability by the introduction of structural zinc.J Biol Chem,2005,280(11):10340−10349.
[28]Watanabe S,Saleh AA,Pack SP,et al.Ethanol production from xylose by recombinantSaccharomycescerevisiaeexpressing protein engineered NADP+-dependent xylitol dehydrogenase. J Biotechnol, 2007, 130(3):316−319.
[29]Khattab SMR,Watanabe S,Saimura M,et al.A novel strictly NADPH-dependentPichia stipitisxylose reductase constructed by site-directed mutagenesis.Biochem BiophysResCommun,2011,404(2):634−637.
[30]Lee SH,Kodaki T,Park YC,et al.Effects of NADH-preferring xylose reductase expression on ethanol production from xylose in xylose-metabolizing recombinantSaccharomyces cerevisiae.J Biotechnol,2012,158(4):184−191.
[31]Shao Z,Zhao H.DNA assembler,anin vivogenetic method for rapid construction of biochemical pathways.Nucleic Acids Res,2008,37(2):e16.
[32]Young E,Lee SM,Alper H.Optimizing pentose utilization in yeast:the need for novel tools and approaches.Biotechnol Biofuels,2010,3:24.
[33]Jojima T,Omumasaba CA,Inui M,et al.Sugar transporters in efficient utilization of mixed sugar substrates:current knowledge and outlook.Appl Microbiol Biotechnol,2010,85(3):471−480.
[34]Mota LJ,Tavares P,Sá-Nogueira I.Mode of action of AraR, the key regulator of L-arabinose metabolism inBacillus subtilis.Mol Microbiol,2002,33(3):476−489.
[35]Hong KK,Nielsen J.Metabolic engineering ofSaccharomycescerevisiae:a key cellfactory platform for future biorefineries.Cell Mol Life Sci,2012,69(16):2671−2690.
[36]Okano K,Yoshida S,Yamada R,et al.Improved production of homo-d-lactic acid via xylose fermentation by introduction of xylose assimilation genes and redirection ofthe phosphoketolase pathway to the pentose phosphate pathway in l-lactate dehydrogenase gene-deficientLactobacillus plantarum.Appl Environ Microbiol,2009,75(24):7858−7861.
[37]Tamakawa H,Ikushima S,Yoshida S.Efficient production of L-lactic acid from xylose by a recombinantCandida utilisstrain.J Biosci Bioeng,2012,113(1):73−75.
[38]Abdel-Rahman MA,Tashiro Y,Zendo T,et al.Efficient homofermentative L-(+)-lactic acid production from xylose by a novel lactic acid bacterium,Enterococcus mundtiiQU 25.Appl Environ Microbiol,2011,77(5):1892−1895.
[39]Ye L,Zhou X,Hudari MS,et al.Highly efficient production of L-lactic acid from xylose by newly isolatedBacilluscoagulansC106. Bioresour Technol,2013,132:38−44.
[40]Jeon WY,Yoon BH,Ko BS,etal.Xylitol production is increased by expression of codon-optimizedNeurosporacrassaxylose reductase gene inCandida tropicalis.Bioprocess Biosyst Eng,2012,35(1):191−198.
[41]Brat D,BolesE.Isobutanolproduction from D-xylose by recombinantSaccharomyces cerevisiae.FEMS Yeast Res,2013,13:241−244.
[42]Toivari M,Nygard Y,Kumpula EP,et al.Metabolic engineering ofSaccharomycescerevisiaefor bioconversion of D-xylose to D-xylonate.Metab Eng,2012,14(4):427−436.
[43]Wang Q,Chen T,Zhao X,et al.Metabolic engineering of thermophilicBacillus licheniformisfor chiral pure D-2,3-butanediol production.Biotechnol Bioeng,2012,109(7):1610−1621.
[44]Werpy T,Petersen G,Aden A,et al.Top Value Added Chemicals From Biomass.US Department of Energy,2004.
[45]Ahmad I,Shim WY,Jeon WY,et al.Enhancement of xylitol production inCandida tropicalisby co-expression of two genes involved in pentose phosphate pathway.Bioprocess Biosyst Eng,2012,35(1-2):199−204.
[46]Chen GQ.New challenges and opportunities for industrial biotechnology.Microb Cell Fact,2012,11(1):111.
[47]Kato H,Shiwa Y,Oshima K,et al.Complete genome sequence ofLactococcus lactisIO-1,a lactic acid bacterium thatutilizesxylose and produces high levels of L-Lactic acid.J Bacteriol,2012,194(8):2102−2103.
[48]Wohlbach DJ,Kuo A,Sato TK,et al.Comparative genomics of xylose-fermenting fungi for enhanced biofuel production.Proc Natl Acad Sci USA,2011,108(32):13212−13217.
[49]Qureshi N,Dien BS,Liu S,et al.Genetically engineeredEscherichiacoliFBR5: part I.Comparison of high cell density bioreactors for enhanced ethanol production from xylose.Biotechnol Prog,2012,28(5):1167−1178.
