蛋白质预算:合成生物学的成本标尺
2013-09-04刘伟丰陶勇
刘伟丰,陶勇
中国科学院微生物研究所,北京 100101
“蛋白质预算”是指细胞为了维持正常的生理状态对各种蛋白质的“投入”,也即表达量上的分配。这既包括细胞表达的全部蛋白质的总体水平,也包括不同蛋白质表达量之间的相互比例。
正常细胞需要维持“蛋白质预算”的平衡。通过对天然细胞蛋白质组的二维电泳等分析可以看出,在特定生理条件下,无论是某种特定蛋白还是细胞的总蛋白,表达量都是处在一个相对恒定的水平。其中对维持生理状态具有重要作用的蛋白质往往具有更高的表达量。当细胞受到外界胁迫时,各种蛋白的表达量会迅速变化并建立新的平衡。部分蛋白表达量的增加会伴随另一些蛋白表达量的减少。
在合成生物学中,功能模块加载后往往会引起人工细胞发生一系列生理变化,造成模块无法正常运行。一个重要原因就是在设计模块时其中的部分酶、蛋白质为了实现功能要求较高的表达量,从而使细胞的“蛋白质预算”失衡。
1 蛋白质与人工生命体系
天然生物体在长期的进化过程中,获得了稳定的生理遗传状态和极强的适应环境的能力。当周围环境及自身生理情况发生变化时,天然生物体会迅速开启应答机制,如对基因表达进行快速的开启或关闭,从而有针对性地产生特定功能蛋白,并关闭不必要蛋白的表达。这种机制体现出了一种“最经济原则”,可以减少细胞不必要的生理负担,是对自然界长期适应的结果。
在人们对生命现象有了深入的探索和认识后,创建自然界不存在的人工生命体系成为人们对自然改造的目标。在这一目标的驱动下,合成生物学已经成为生命科学中最为活跃、发展最为迅速的研究领域之一[1-3]。2010年,美国科学家J.Craig Venter及其合作者研究将完全由人工设计、改造、组装的一种蕈状支原体Mycoplasma mycoides基因组转入到另一种生物山羊支原体Mycoplasma capricolum的细胞中,最后获得的合成细胞完全在人工基因组的控制下正常生长[4]。这标志着人工创建生命体获得了巨大突破。然而合成生物学的最终目标是使人工生命体系比天然生物体具有明显的优越性,例如具有更强的目标产物的生产能力、转化能力、环境适应与监测能力等,从而使人类获得更优质的生产方式。虽然以合成生物学手段设计、合成的人工元件、模块可以赋予人工生命体系某种特定优势的生物学功能,但如何使人工生命体系在各种生理能力上达到乃至超过经过长期自然进化形成的天然生物,仍然是亟待解决的科学问题。
蛋白质是生物体执行生理功能的核心分子。酶、信号分子、细胞通道以及各种水平的调控因子等绝大部分是由蛋白质组成的。生物体之所以能够有效地对各种环境变化进行精准的应答,根本上还是对细胞中各种功能蛋白质的含量、定位、活性的控制。蛋白质能够在时间上和空间上进行准确地表达,有赖于转录、翻译、折叠、修饰及细胞定位等多层次的精确调控。
蛋白质同样是合成生物学创建的人工生命体系的基础。人工生命体系或称人工细胞,是建立在一系列特定功能生物元件和生物模块的基础上的。相关功能元件、模块包括了各种酶催化反应、调控通路。在这些反应和通路中,执行具体功能的绝大多数是酶、调控蛋白等蛋白质分子。因此,元件、模块功能的实现仍然依赖于蛋白质的精确表达。使元件、模块中功能蛋白质的表达能够在时间上和空间上得到精确控制,不仅是合成生物学研究和核心内容,而且对实现人工生命体系的优越性具有重要意义。
2 合成生物学中的蛋白质预算
生物元件、模块中包括大量的异源基因表达,采用了各种非天然启动子。因此生物元件和模块本质上仍然是建立在各种蛋白质重组表达单元的基础上。但与基因工程中蛋白质重组表达系统相比,合成生物学中的蛋白质重组表达的调控更为复杂,模块中蛋白质重组表达遵循着特殊的规律,并且需要采用不同的研究、优化策略。
2.1 生物元件、模块与蛋白质重组表达系统的区别
合成生物学的研究方式是以工程学理论为依据,把生命系统作为工程系统来处理。与传统生物学从“整体-细胞-分子”的自上而下“分解式”的研究方式不同,合成生物学按“元件 (Part)-模块 (Module)-系统 (System)”的“自下而上”的方式对生命系统进行设计。合成生物学将具有特定功能的调控、代谢途径抽提、模块化,设计标准化和具有通用性特征的基本生物元件,进而组装成大的整合系统。
根据合成生物学的研究过程可以看出,生物元件是合成生物学的基石。合成生物学的首要工作就是对生物元件的挖掘、改造和标准化。生物元件按功能包括启动子、质粒骨架、调控序列、酶等功能蛋白基因编码区等。这些元件本质上都是蛋白质重组表达系统的基本单元。
模块是通过元件有序组装获得的具有特定功能的更高层次的单元,包括合成模块、催化模块、调控模块等。模块的功能最终也是通过对酶、调控蛋白等蛋白质的有序表达实现。为了使模块的功能实现最优化,人们常常需要引入异源基因,例如在合成模块中利用异源基因去获得新的合成途径。在满足通量需求等前提下,这些基因的功能通常需要通过过量表达实现。
蛋白重组表达是合成生物学的重要环节,但元件、模块中的蛋白质表达同以蛋白质获得为目的的重组表达系统还是具有明显的区别。蛋白质重组表达系统以获得高水平蛋白为目的。通过重组表达系统表达目的蛋白,既是科学研究中获得蛋白质的主要手段,也是实现功能性蛋白质产品规模化生产的重要途径。蛋白质重组表达系统通常以目的蛋白表达水平最大化为目标,以适应科学研究及工农业生产中获得足够功能蛋白的要求。重组蛋白在细胞总蛋白的比例往往很高,例如大肠杆菌重组表达系统中的外源蛋白可以超过总蛋白的50%[5]。
蛋白重组表达系统包括载体骨架、启动子、终止子等基本组件。为了提高外源蛋白质的表达水平,通常会强化这些组件的功能以有利于增加细胞中目标蛋白的表达滴度。例如在大肠杆菌表达系统中,商业化的载体质粒绝大多数采用松弛型高拷贝复制起始位点ColE,高拷贝质粒可以通过增加模板的相对数量提高目的蛋白的表达水平[6]。转录方面则通过采用T7等强启动子来增加目标蛋白的模板mRNA水平。针对结构基因编码区,通常是通过对外源蛋白编码序列密码子的优化,将稀有密码子替换为富有密码子以提高翻译效率[7]。
但在合成生物学中,虽然元件设计和模块组装仍然包括大量的重组蛋白表达单元,但其最终的功能并非以获得较高蛋白表达水平为目标。合成生物学中的表达单元需要有精确的调控能力,其最终目标是实现一个或多个生物学功能,这需要保证底盘细胞中多个模块间蛋白表达水平的平衡,而非重组蛋白本身的最大化。
2.2 蛋白质预算 (Protein budget)是合成生物学的“成本标尺”
大量的研究表明,在合成生物学中模块组装时,采用强启动子、高拷贝复制起始位点等蛋白质重组表达常用的元件往往不能实现模块功能的最优状态[8-9]。例如,我们在大肠杆菌底盘细胞中加载了类胡萝卜素合成的功能模块。我们研究了模块中蛋白质表达水平对最终产物的影响。结果表明,当功能模块中多个酶通过强化蛋白表达的调控元件获得较高可溶性表达水平时,类胡萝卜素的合成水平反而明显低于低水平表达相关酶的情况,后者是通过弱化表达的调控元件实现的。
因此,在合成生物学研究中,模块间的不同蛋白质重组表达水平需要处于相对平衡的状态,才能使模块功能以及模块间或模块与底盘细胞间的适配性达到最优的状态。这种情况可以类比于工厂中,一个整体生产计划内部需要对不同环节的投入进行总体预算。良好的预算可以最大限度地降低计划的成本。当计划中某一环节的预算过高时,就会影响计划中其他环节的投入和实施,造成成本过高、工厂负担过重。只有整体计划中的各环节间实现预算的平衡,才有利于计划的实施。“蛋白质预算”则是细胞工厂发挥功能的“成本标尺”。在细胞表达各模块的蛋白时,只有模块中异源蛋白之间,以及模块蛋白与底盘细胞自身蛋白之间的蛋白质预算分配实现最优时,合成生物学构建的人工生命体系 (人造细胞工厂)才能良好地运行。
合成生物学中的模块的简单与复杂常常取决于其功能的复杂程度。在合成模块中,通常需要引入多个乃至十余个异源基因去获得新的合成途径,这些基因编码的酶在原来的系统能够满足细胞的代谢需要,但为了满足合成模块的适配性及最大通量,这些基因必须过量表达。
酶的催化活性与其催化的反应及酶的来源紧密相关,比活的相差倍数可能达到百倍至百万倍,为了保证代谢通量平衡并且最大化,有些代谢合成的酶可能需要表达至细胞总量的20%以上,如果合成途径中存在两个以上的限速酶,如何合理地预算这些蛋白质表达,不影响其他合成模块中基因的表达,以及人工合成细胞的正常生长和维持是蛋白质预算的核心问题。
2.3 蛋白质表达水平对模块的影响机制
蛋白质的表达水平会对模块的功能,以及模块之间、模块与底盘细胞的适配性产生重要影响。蛋白质重组表达系统中的过表达(Overexpression)往往不适用于合成生物学中元件、模块中的蛋白质重组表达。蛋白质表达水平过高对细胞造成的副作用有多种原因,主要会从如下几个方面对细胞产生干扰。
2.3.1 蛋白质过表达增加细胞的负担
碳源、氮源等营养物质进入细胞后,一方面需要维持细胞自身的生长和繁殖,为细胞壁、细胞膜等结构的合成提供前体,另一方面要为细胞的正常代谢提供辅酶、能量等。在这种情况下,蛋白质的过量重组表达会分流原来处于平衡状态的碳代谢、氮代谢以及能量代谢流,从而增加细胞的生理负担。蛋白质高水平表达本身要求有大量的氨基酸前体供应,当培养基没有足够的氨基酸补充时会造成代谢流的比例大量进入到氨基酸前体合成途径。另一方面,正常生长状态下细胞内总蛋白的水平会在一定范围内处于稳定的水平,从而使细胞在最为有利的状态下生长。过量的蛋白质重组表达会打破了胞内蛋白质的平衡,从而影响了其他正常蛋白质的表达,使代谢失衡[10-11]。
2.3.2 多种蛋白表达间的相互干扰
为了实现特定生物学功能,合成生物学构建的人工生命体系通常含有多个模块,而一个功能模块往往涉及多于一个蛋白的表达。如一个代谢物的合成模块往往涉及几种乃至十几种酶。为了模块稳定性以及有利于遗传操作和调控,这些酶往往分布在多个质粒中,并且处于多个启动子控制下。当多个酶蛋白分子同时表达时,会引起多质粒系统的稳定性失衡,以及启动子在多种个诱导物条件下出现相互干扰。例如JD Keasling的研究表明,在多质粒、多启动子系统中,蛋白质表达滴度会受到明显的影响[8]。
2.3.3 异源蛋白质表达的毒性
在合成生物学研究中,元件、模块中往往包含了大量的具有优良性状的异源基因。而异源基因在非天然宿主中进行蛋白表达本身就会对宿主细胞产生影响。因为宿主细胞中分子伴侣体系、密码子偏好性等通常与基因的原始生物具有很大差异,从而造成部分包涵体积累等情况,从而对宿主细胞产生毒性[12-13]。
2.3.4 蛋白质表达代谢网络的影响
在过表达酶等蛋白质时,蛋白质自身的功能往往会对细胞的代谢网络产生影响。蛋白质表达水平过高会造成代谢中间产物积累、影响辅酶循环等,从而使细胞的代谢网络失衡[10-11,14]。
3 蛋白质预算的控制手段
把人工设计的模块加载到底盘细胞后,虽然赋予了细胞新的功能,但所获得的新生命体系往往并非是最优的。人工生命体系的优化和调试(Debugging)是合成生物学研究的关键问题。这涉及到各模块之间以及模块与底盘细胞之间的适配性优化。以蛋白质预算为依据,衡量并指导对人工生命体系的优化,是合成生物学研究的一个有效手段。通过控制模块中各种酶、功能蛋白质的表达水平,可以减少细胞不必要的生理负担,使各种蛋白质功能以及细胞的整体代谢网络处于一个相对平衡的状态,从而为创建具有优势的人工生命体系打下基础。目前已经有各种手段和工具对蛋白质的表达水平进行控制,实现对蛋白质预算进行有效干预。
3.1 蛋白质表达水平的微调控
合成生物学的理想情况是能够实现对蛋白质的表达水平的定量控制。但由于蛋白质表达过程涉及转录、翻译、翻译后折叠等多个环节,蛋白质表达水平受到多种因素的影响,因此完全实现蛋白质表达水平的人为精确控制还很困难。一个常用的办法是采用一系列调控元件库,对蛋白质表达水平进行控制。目前已经报道了多种研究手段,实现对蛋白质表达水平的微调控。
3.1.1 启动子工程
启动子是影响蛋白质表达水平最主要的因素之一。通过人为改变启动子强度,也是对蛋白质表达水平进行微调控的有效方法。目前已经有大量的研究集中在对启动子的改造、优化上,包括获得不同强度的启动子,构建启动子突变库,以及通过高通量手段获得最佳蛋白质表达水平。理论上,保持调控蛋白结合位点序列不变,通过改造启动子−10区和−35区的序列,以及其间的16个碱基即可构建一系列具有不同启动强度的启动子,形成满足不同表达强度需求的启动子库。2005年,Stephanopoulos等通过易错突变获得了具有不同强度的启动子文库。筛选得到近200个不同强度的启动子,mRNA水平启动强度范围相差325倍[15]。利用这一文库研究者对ppc以及dxs两种番茄红素合成途径中关键酶的表达水平进行了优化。结果显示采用适当的启动子强度能够显著提高目标产物的合成水平。张学礼等构建了以启动子为核心的人工调控元件文库,并成功地应用于大肠杆菌葡萄糖转运及胡萝卜素的生产中[16-17]。
3.1.2 mRNA的稳定性的调节
mRNA是影响蛋白质表达水平的另一个关键因素。任何mRNA都有一定的半衰期,延长mRNA半衰期能够增强目的基因的翻译从而提高蛋白质的表达水平。mRNA的半衰期与mRNA的UTR序列、二级结构等因素有关。例如,UTR中的颈环结构可以避免mRNA被细胞中的各种RNA酶 (RNase)降解,从而能够提高mRNA稳定性,加强蛋白质的翻译。JD Keasling利用mRNA中非编码位置的颈环结构设计了具有不同mRNA稳定性的调控元件,即tunable intergenic regions(TIRS)[18-19]。TIRS利用 mRNA稳定性的差异,使功能模块中各酶蛋白的表达得到微调控。JD Keasling成功地将mRNA颈环结构控制蛋白表达的策略应用在青蒿素的人工合成中[19]。
3.1.3 通过RBS人工设计进行调节
核糖体结合位点 (RBS)是原核细胞中翻译起始的控制位点。RBS序列对翻译的起始效率具有重要影响,而翻译起始效率的改变能够进而改变蛋白质的翻译及表达水平。因此,可以通过对RBS的序列进行人为的改造,从而实现进行蛋白质表达水平的控制。目前已经报道的RBS人工设计包括两个方面:一是通过建立突变文库获得不同功能的RBS序列;另一种是通过理性设计获得具有不同翻译起始强度的RBS[20-21]。Salis等以理论预测为基础,成功获得了一系列具有不同翻译起始强度的RBS,并能够对蛋白质表达水平进行精确的控制[21]。
3.1.4 密码子偏好性的作用
遗传信息在由mRNA到蛋白质的传递过程中是以三联体密码子的形式传递的。每种氨基酸至少对应一个密码子,编码同一种氨基酸的密码子称为同义密码子。在蛋白质的合成过程中,同义密码子的使用概率并不相同,这与细胞中tRNA的丰度有关。相应tRNA丰富的密码子,正确的氨基酸会很快连接上,而相应tRNA稀少的密码子,要经过多次相互辨认才能找到正确的tRNA,进而外源蛋白的合成将停顿。如果相同的稀有密码子连续出现,就会抑制蛋白质合成。有报道发现外源蛋白中含有较多的精氨酸密码子AGA/AGG会限制降低蛋白质的表达水平[22]。本研究组从加入稀有密码子降低翻译速度来降低蛋白表达量的角度入手,对稀有密码子在翻译水平的影响进行分析,筛选得到一套可按不同梯度下调蛋白表达量的密码子调控元件。利用密码子调控元件,我们成功地实现了对大肠杆菌中类胡萝卜素合成模块关键酶蛋白表达的微调控,进而显著提高了目标产物的合成水平。
3.2 蛋白质分子的改造和替换
模块中某一个蛋白质过量表达,常常是设计和载体选择不当,可以通过系统优化和选择去解决。而为达到代谢通量平衡并且最大化而人为过量表达某一个或两个基因引起的蛋白质预算问题,则需要酶工程或筛选大量的异源基因。通过酶工程、蛋白质工程等手段获得更优的蛋白质分子,可以在蛋白质表达水平较低的情况下实现功能,从而减少蛋白质预算的投入。因此通过酶基因的替换、酶工程以及蛋白质工程的改造实现蛋白质预算优化,是合成生物学优化中的重要手段。
3.2.1 蛋白质工程
蛋白质分子不仅要能实现生物元件和生物模块的基本催化、调控功能, 而且要使生物元件和模块之间、生物模块与底盘细胞之间具有完善的适配能力,在复杂的代谢和调控网络中充分发挥功能,才能使新生命体系比天然生物体具有更大的功能优势。蛋白质工程以蛋白质的结构为依据,结合生物信息学、生物化学等手段进行设计、改造,从基因水平上改变蛋白质的序列和结构,获得具有新功能的蛋白质分子[23]。
蛋白质工程通常采用理性设计与高通量人工进化与筛选这两种方式获得新功能的蛋白质[24]。这要求在晶体结构、生物信息学等方面要对靶蛋白具有充分的认识,或是需要针对靶蛋白建立高效的进化与筛选平台。蛋白质工程在合成生物学中的应用包括多个方面:如设计改造高效的催化元件;根据代谢网络需求建立具有逻辑门功能的分子开关或新的调控元件;帮助提高元件、模块对极端pH、极端温度、高盐等环境的适应能力等 (抗逆元件)。
3.2.2 人工分子机器
在蛋白质改造过程中,将不同功能的蛋白质或蛋白质的某一部分在空间上组合在一起,可以增强酶催化过程中底物有效浓度,减少蛋白质的用量。天然细胞中最高效的酶催化方式是蛋白质复合体,例如脂肪酸合成过程的复合体可以使脂肪酸的合成代谢以最有序高效的方式进行。人工分子机器模仿了天然蛋白质复合体的组合方式。通过将酶基因与能够介导蛋白质相互作用的结构域进行融合表达。所获得的融合蛋白既具有酶的催化功能,又可以通过融合结构域的介导定位到一起,进而组成大分子量的人工蛋白复合体。
人工分子机器在代谢工程等领域具有特殊的应用价值。将一条代谢途径中相关联的若干酶分子组装到人工蛋白复合体中,可以加快酶分子对代谢中间物的捕捉和识别过程,从而使酶催化反应更为高效。人口分子机器包括两部分,一是分子骨架,作为人工蛋白复合体的核。二是模块中的各个酶,酶蛋白通过融合结构域以不同比例结合到分子骨架上,从而实现模块的最优化。JD Keasling在研究青蒿素前体的人工合成中,成功将人工分子机器用于模块的优化。Kealing分别将青蒿素合成上游模块中的3个酶蛋白AtoB、HMGS、HMGR同GBD、S3H、PDZ三个结构域融合表达,并结合在分子骨架上。通过分子机器的优化,使下游产物的合成水平提高了70倍[25]。
人工纤维小体是一种模仿天然大分子机器-纤维小体 (Cellulosome)的高效降解木质纤维素的人工复合体。人工纤维小体以脚手架蛋白为基础,通过蛋白质相互作用聚集了纤维素底物结合模块以及催化模块,能够显著提高纤维素的降解效率。在人工合成细胞中加载纤维素水解的人工纤维小体已经获得成功[26-27]。但由于CBH催化活力的限制,要真正构建有实用价值的直接利用纤维素的人工合成细胞将是蛋白质预算给合成生物学带来的挑战。
3.2.3 天然基因的筛选和替换
经过酶工程、蛋白质工程改造的酶分子等可以在一定程度上解决因需要过量表达导致的蛋白质预算失衡。但当蛋白分子在结构、功能等方面研究不足,或没有理想的筛选文库时,通过改造蛋白质分子则很难获得理想的优化结果。幸运的是自然界中动物、植物、微生物中蕴含了大量的基因资源。可以从天然生物中获得各种性状优良的蛋白质基因,用于人工生命体系的组建中。这些基因由于具有更高催化活力而降低了蛋白量的需求,在合适的表达调控下就可以解决蛋白质预算失衡的问题。海洋、热泉、盐湖中的微生物往往具有耐热、耐盐等特性,是良好的基因资源库。近年来,人们已经从海洋微生物等资源中获得大量新功能的基因。
以上各种对蛋白质预算进行控制的常用手段总结在表1中。
4 总结与展望
创建具有优势的人工生命体系,是合成生物学研究的最终目标。蛋白质是生物体中起核心作用的分子。如何在蛋白质表达水平上实现生命体系的最优化,对合成生物学的研究具有重要的指导意义。蛋白质预算的概念,将对分析影响人工生命体系功能的关键因素,指导元件设计、模块组装以及适配性优化具有积极作用。
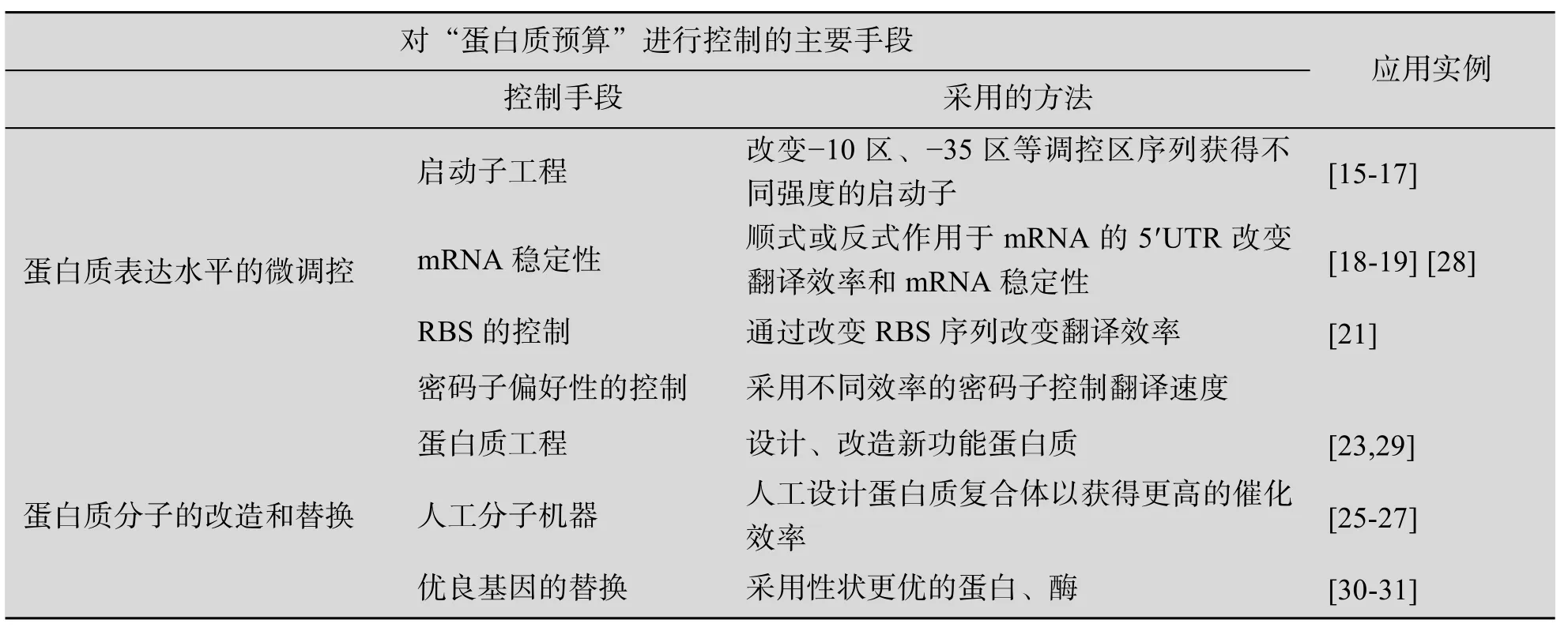
表1 蛋白质预算的控制手段Table 1 Methods for the control of protein budget
致谢:本文内容是作者的个人看法及观点,在国际上尚未有类似的具体描述,作者要感谢过去杜邦公司的同事在工作中的讨论,也感谢金城教授和林章凛教授在酶工程年会中的讨论,并感谢陶勇实验室多位工作人员和学生提供的未发表数据。
[1]Ham TS,Dmytriv Z,Plahar H,et al.Design,implementation and practice of JBEI-ICE:an open source biological part registry platform and tools.Nucleic Acids Res,2012,40:e141.
[2]Mackenzie A.Synthetic biology and the technicity of biofuels.Stud Hist Philos Biol Biomed Sci,2013,44(2):190−198.
[3]Folcher M,Fussenegger M.Synthetic biology advancing clinical applications.Curr Opin Chem Biol,2012,16:345−354.
[4]Gibson DG,Glass JI,Lartigue C,et al.Creation of a bacterial cell controlled by a chemically synthesized genome.Science,2010,329:52−56.
[5]Baneyx F.Recombinantprotein expression inEscherichia coli.Curr Opin Biotechnol,1999,10:411−421.
[6]CampsM.Modulation ofColE1-likeplasmid replication for recombinant gene expression.Recent Pat DNA Gene Seq,2010,4:58−73.
[7]Forster AC.Synthetic biology challenges long-held hypotheses in translation, codon bias and transcription.Biotechnol J,2012,7:835−845.
[8]JonesKL,Kim SW,KeaslingJD.Low-copy plasmids can perform as well as or better than high-copy plasmids for metabolic engineering of bacteria.Metab Eng,2000,2:328−338.
[9]Anthony JR,Anthony LC,Nowroozi F,et al.Optimization of the mevalonate-based isoprenoid biosynthetic pathway in Escherichia colifor production of the anti-malarial drug precursor amorpha-4,11-diene.Metab Eng,2009,11:13−19.
[10]Malakar P,Venkatesh KV.Effect of substrate and IPTG concentrations on the burden to growth ofEscherichia colion glycerol due to the expression of Lac proteins.Appl Microbiol Biotechnol,2012,93:2543−2549.
[11]Glick BR.Metabolic load and heterologous gene expression.Biotechnol Adv,1995,13:247−261.
[12]Wagner S,Klepsch MM,Schlegel S,et al.TuningEscherichiacolifor membrane protein overexpression.Proc Natl Acad Sci USA,2008,105:14371−14376.
[13]Dumon-Seignovert L,Cariot G,Vuillard L.The toxicity of recombinant proteins inEscherichia coli: a comparison of overexpression in BL21(DE3),C41(DE3),and C43(DE3).Protein Expr Purif,2004,37:203−206.
[14]Flores S,de Anda-Herrera R,Gosset G,et al.Growth-rate recovery ofEscherichia colicultures carrying a multicopy plasmid,by engineering of the pentose-phosphate pathway.BiotechnolBioeng,2004,87:485−494.
[15]Alper H,Fischer C,Nevoigt E,Stephanopoulos G.Tuning genetic control through promoter engineering.Proc Natl Acad Sci USA,2005,102:12678−12683.
[16]Lu J,Tang J,Liu Y,et al.Combinatorial modulation of galP and glk gene expression for improved alternative glucose utilization.ApplMicrobiol Biotechnol,2012,93:2455−2462.
[17]Zhao J,Liu Y,Li QY,et al.Modulation of isoprenoid gene expression with multiple regulatory parts for improved β-carotene production.Chin J Biotech,2013,29(1):41–45(in Chinese).
赵婧,刘怡,李清艳,等.多个调控元件调控萜类合成途径基因表达提高 β-胡萝卜素的生产.生物工程学报,2013,29(1):41−45.
[18]Carrier TA,Keasling JD.Controlling messenger RNA stability in bacteria:strategies for engineering gene expression.BiotechnolProg,1997,13:699−708.
[19]Pfleger BF,Pitera DJ,Smolke CD,etal.Combinatorial engineering of intergenic regions in operons tunes expression of multiple genes.Nat Biotechnol,2006,24:1027−1032.
[20]Anderson JC,Voigt CA,Arkin AP.Environmental signal integration by a modular AND gate.Mol Syst Biol,2007,3:133.
[21]Salis HM,Mirsky EA,Voigt CA.Automated design of synthetic ribosome binding sites to control protein expression.NatBiotechnol,2009,27:946−950.
[22]Gurvich OL,Baranov PV,Gesteland RF,et al.Expression levels influence ribosomal frameshifting at the tandem rare arginine codons AGG_AGG and AGA_AGA inEscherichia coli.J Bacteriol,2005,187:4023−4032.
[23]Yoshikuni Y,Dietrich JA,Nowroozi FF,et al.Redesigning enzymes based on adaptive evolution for optimal function in synthetic metabolic pathways.Chem Biol,2008,15:607−618.
[24]Zawaira A,Pooran A,Barichievy S,et al.A discussion of molecular biology methods for protein engineering.Mol Biotechnol,2012,51:67−102.
[25]Dueber JE,Wu GC,Malmirchegini GR,et al.Synthetic protein scaffolds provide modular control over metabolic flux.Nat Biotechnol,2009,27:753−759.
[26]Tsai SL,Goyal G,Chen W.Surface display of a functional minicellulosome by intracellular complementation using a synthetic yeast consortium and its application to cellulose hydrolysis and ethanol production.Appl Environ Microbiol,2010,76:7514−7520.
[27]Wen F,Sun J,Zhao H.Yeast surface display of trifunctionalminicellulosomesforsimultaneous saccharification and fermentation of cellulose to ethanol.Appl Environ Microbiol, 2010, 76:1251−1260.
[28]Sharma V, Yamamura A, Yokobayashi Y.Engineering artificial small RNAs for conditional gene silencing inEscherichia coli.ACS Synth Biol,2012,1:6−13.
[29]Wu YI,Frey D,Lungu OI,et al.A genetically encoded photoactivatable Rac controls the motility of living cells.Nature,2009,461:104−108.
[30]Tsuruta H,Paddon CJ,Eng D,et al.High-level production of amorpha-4,11-diene,a precursor of the antimalarial agent artemisinin,inEscherichia coli.PLoS ONE,2009,4:e4489.
[31]Ma SM,Garcia DE,Redding-Johanson AM et al.Optimization of a heterologous mevalonate pathway through the use of variant HMG-CoA reductases.Metab Eng,2011,13:588−597.
