沙枣黄酮提取工艺、抗氧化及抑菌活性研究
2013-09-04李家寅赵春萌
王 雅,李家寅,赵春萌,赵 萍
(兰州理工大学生命科学与工程学院,甘肃兰州730050)
沙枣(Elaeagnus angustifolia L.)属胡颓子科胡颓子属植物,由于其具有抗旱、抗风沙、保持水土等特性,在我国西北地区广泛生长。沙枣树作为天然野生植物,其果实沙枣不受化肥、农药和工业污染物的污染,富含糖类、蛋白质、维生素等营养成分[1-3],营养丰富。在我国民间医学中,沙枣果实被用来治疗肠炎、腹泻等疾病[4]。尽管沙枣具有较高的药用和食用价值,但尚未被充分开发利用。研究报道,沙枣果实、茎叶、树皮和花中均含有黄酮类化合物[5-8],Si C L[9]从沙枣树皮提取物中分离得到了7种黄酮类化合物,分别为儿茶素、表儿茶酸、没食子儿茶素没食子酸酯、表没食子儿茶素、槲皮素、毛地黄黄酮及3,5,7-三羟基-4’-甲氧基黄酮。沙枣果实原花青素、沙枣花中粗黄酮类物质、沙枣叶粗黄酮类化合物及沙枣果皮提取物等均具有一定的抗氧化活性[10-12]。本文对沙枣黄酮的提取工艺及抗氧化抑菌活性进行了研究,以期为沙枣果实的开发提供依据。
1 材料与方法
1.1 材料与仪器
沙枣 于2009年10月采自甘肃腾格里沙漠,自然风干后去核粉碎过40目筛;芦丁标准品、DPPH sigma;NKA-9大孔树脂 南开大学化工厂;其余试剂 均为国产分析纯;培养基 细菌培养用牛肉膏蛋白胨琼脂培养基,霉菌培养用马铃薯汁葡萄糖琼脂培养基;大肠杆菌(E.coli)、枯草芽孢杆菌(Bacillus spp)、金黄色葡萄球菌(Staphylococcus spp.)、黑曲霉(Aspergillus niger)、毛霉(Mucor racemosus)、青霉(Penicillum)由兰州理工大学生命科学与工程学院实验室提供。
Cary50型分光光度计 美国瓦里安公司;UV-9000型紫外分光光度计 北京瑞丽分析仪器公司;43型Rancimat油脂氧化测定仪、743型Rancimat食用油氧化稳定性测定仪 瑞士万通;JY99-Ⅱ型超声波细胞粉碎机 宁波新芝生物科技股份有限公司。
1.2 实验方法
1.2.1 沙枣黄酮的提取工艺优化 以乙醇为溶剂,按照设定条件(料液比、超声时间、乙醇浓度、超声功率)进行超声波辅助提取,用单因素和正交实验优化沙枣黄酮的提取工艺。1.2.2黄酮得率的测定采用NaNO2-Al(NO3)3-NaOH比色法[13]。准确称取芦丁标准品10mg,置于50mL容量瓶中,加50%的乙醇溶解并稀释至刻度,配制成浓度为0.2mg/mL的芦丁标准液。取配制好的芦丁标准液0.0、0.2、0.5、1.0、2.0、3.0、4.0mL分别装入10mL容量瓶中,加5%亚硝酸钠0.4mL,放置6min,后加入10%硝酸铝0.4mL,放置6min,再加入4%的氢氧化钠溶液4mL,加水至刻度,摇匀,放置15min,在505nm下测定其吸光度,吸光度值Y与芦丁标准溶液浓度X(mg/mL)之间的回归关系为:Y=8.4634X+0.0086,R2=0.9937。

表1 正交实验因素水平表Table 1 Factors and levels of orthogonal test
按标准曲线的制作方法,测定样品吸光度,计算黄酮得率。

1.2.3 沙枣黄酮样品的制备 沙枣粉碎后在最优条件下提取,后经NKA-9大孔树脂纯化,收集黄酮类物质,真空冷冻干燥,测定其黄酮得率。
1.2.4 沙枣黄酮抗氧化活性实验
1.2.4.1 对DPPH自由基清除能力 参考Aruomaoi[14]的方法。准确称取6.3mg DPPH,用60%乙醇溶解定容至250mL,得浓度为0.025mg/mL的DPPH溶液。再将1.2.3制备的样品配制为0.008、0.016、0.024、0.032、0.040、0.048、0.056、0.064mg/mL的溶液。精确吸取DPPH溶液2.5mL,与2.5mL 60%乙醇溶液混合,以60%乙醇为对照,测定溶液在517nm处的吸光度值(A0)。取上述样液各2.5mL,分别与2.5mL DPPH(0.025mg/mL)溶液混合,混合均匀后静置30min。以60%乙醇为对照,测定各溶液在517nm处的吸光度值(Ai)。取上述样液各2.5mL,分别与2.5mL 60%乙醇溶液混合均匀,以60%乙醇为对照,测定各溶液在517nm处的吸光度值(Aj),得到清除率在一定浓度范围内的线性回归方程,计算半数抑制率IC50(清除率达50%时样品的浓度)。IC50值越小,对DPPH的清除效果越好,测试样品的抗氧化活性越强。DPPH自由基清除率计算公式为:

1.2.4.2 Rancimat实验[15]沙枣黄酮的配制:用60%乙醇配制成浓度为50、100、150、200、250mg/L的溶液备用。用油脂氧化仪在温度为100℃、空气流量20L/h下测定诱导时间。诱导时间越长,表明样品的抗油脂氧化稳定性越好,其抗氧化活性越强。
1.2.5 沙枣黄酮抑菌活性研究 抑菌实验采用滤纸片法[16-17]。
2 结果与讨论
2.1 单因素实验
2.1.1 料液比对黄酮提取效果的影响 用60%乙醇溶液,在超声功率200W,超声提取10min,研究料液比对沙枣黄酮提取效果的影响。由图1可知,随料液比的增大,沙枣黄酮得率逐渐增大,当料液比达1∶18时,黄酮得率为4.82%,随后料液比继续增大,黄酮得率基本保持不变,考虑成本,取黄酮提取的最佳料液比为1∶18。
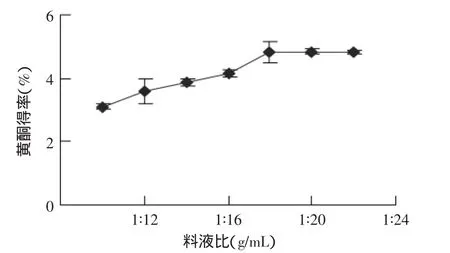
图1 料液比对黄酮得率的影响Fig.1 Effect of ratio of materiel to solvent on flavonoids extraction
2.1.2 超声时间对黄酮提取效果的影响 在乙醇浓度60%、超声功率200W,提取料液比为1∶18条件下研究超声时间对沙枣黄酮提取效果的影响。由图2可知,在0~10min,随着超声时间的延长,沙枣黄酮得率升高,当超声时间在10~15min时,沙枣黄酮得率上升幅度较小,此后,黄酮得率下降,考虑到经济成本,取10min为最优超声时间。

图2 超声时间对黄酮得率的影响Fig.2 Effect of ultrasonic time on flavonoids extraction
2.1.3 乙醇浓度对黄酮提取得率的影响 在超声功率200W、超声时间10min,提取料液比为1∶18条件下研究乙醇浓度对沙枣黄酮得率的影响。由图3可知,在乙醇浓度为30%~60%时,随乙醇浓度增大,黄酮得率增大,当乙醇浓度达60%,沙枣黄酮的提取效果最好,得率达5.15%,因此选择60%乙醇为沙枣黄酮最佳提取浓度。

图3 乙醇浓度对黄酮得率的影响Fig.3 Effect of ethanol concentration on flavonoids extraction
2.1.4 超声功率对黄酮提取率的影响 在超声时间10min,料液比为1∶18,乙醇浓度60%的条件下研究超声功率对沙枣黄酮提取效果的影响。由图4可知,在200~320W范围内,随功率增大,黄酮得率增大,当功率达320W时,黄酮得率达5.27%。功率继续增大,黄酮含量降低,故提取的最佳超声功率为320W。

图4 超声功率对黄酮得率的影响Fig.4 Effect of ultrasonic power on flavonoids extraction
2.2 正交实验设计及结果
由表2中的极差R值可知,四因素对沙枣黄酮得率的影响程度大小依次为:料液比>乙醇浓度>超声功率>超声时间,因素的最佳组合为A2B2C2D2,即料液比1∶18、超声时间10min,乙醇浓度60%,超声功率320W,在此工艺条件下,黄酮得率为5.28%。方差分析结果表明:料液比、超声时间、乙醇浓度、超声功率四个因素对黄酮得率均有显著影响(p<0.05)。
2.3 抗氧化实验
2.3.1 沙枣黄酮样品的制备 测得NKA-9大孔树脂纯化后的沙枣黄酮得率为77%,用于抗氧化活性与抑菌活性的测定。
2.3.2 DPPH自由基清除实验 从图5可以看出,随浓度的增大,沙枣黄酮对DPPH自由基的清除能力增强,在相同浓度下,沙枣黄酮对DPPH自由基的清除率高于VC。表4显示,沙枣黄酮的IC50值小于VC的IC50值,说明沙枣黄酮对DPPH自由基的清除能力强于VC。由此可知,沙枣黄酮的抗氧化活性强于VC。
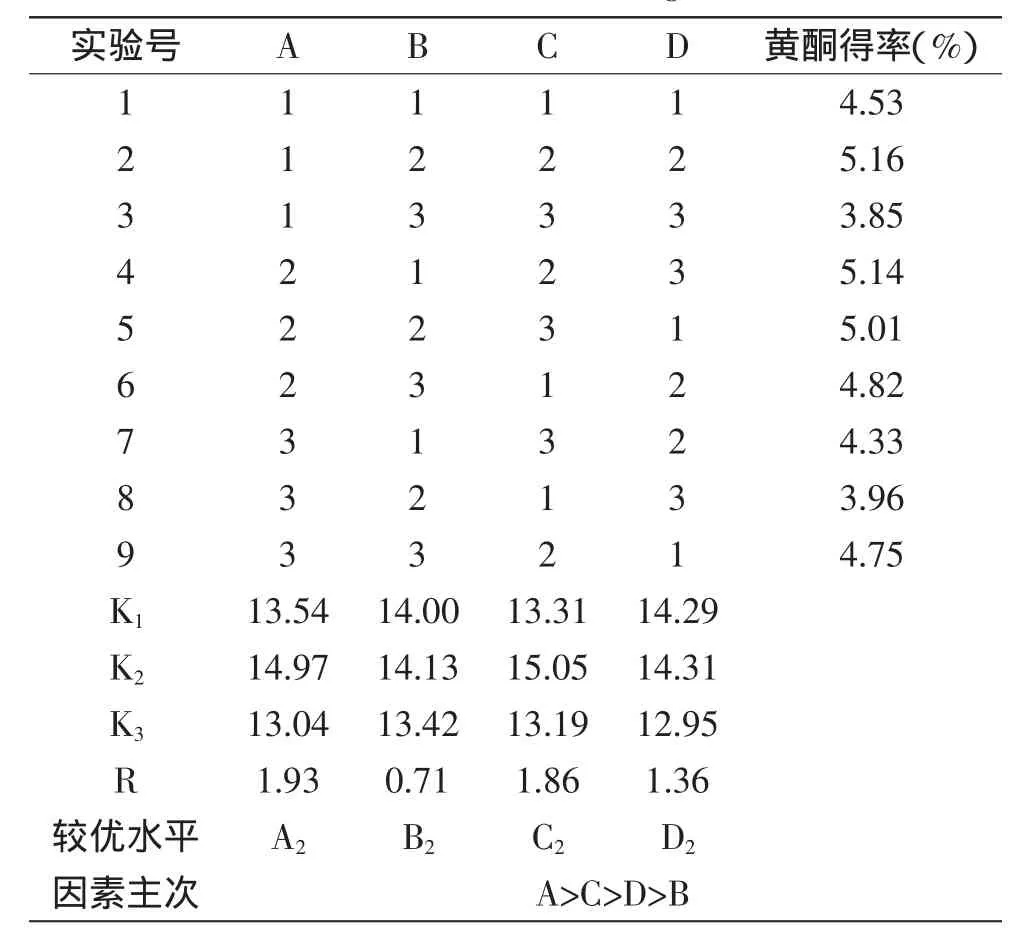
表2 正交实验结果Table 2 The results of orthogonal test

表3 方差分析Table 3 Variance analysis of orthogonal test
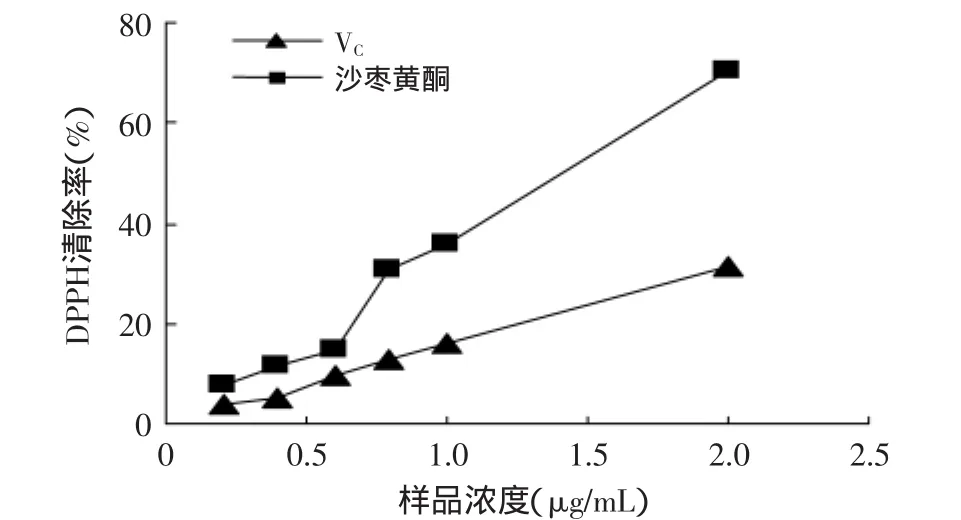
图5 沙枣黄酮对DPPH自由基的清除效果Fig.5 DPPH·scavenging activity of flavonoids

表4 沙枣黄酮和VC对DPPH的IC50值比较Table 4 Comparison of IC50of flavonoids and VC
2.3.3 Rancimat实验结果 由图6可知,随浓度增大,沙枣黄酮的抗油脂氧化能力呈现先增大后减小的趋势,当浓度为150mg/mL时,沙枣黄酮的抗油脂氧化能力最强。由表5可知,在此浓度下,沙枣黄酮抗油脂氧化能力强于VC。
2.4 抑菌实验

图6 沙枣黄酮对油脂抗氧化能力的影响Fig.6 Effects of lard oil of flavonoids on the oxidative stability

表5 沙枣黄酮与VC抗油脂氧化的诱导时间Table 5 Comparison of induction time of flavonoids and VC
由表6可以看出,沙枣黄酮对六种供试菌均有抑制作用,但抑制效果与浓度的依赖关系不明显。黄酮对大肠杆菌、金黄色葡萄球菌的最小抑菌浓度为1.0g/L;对枯草芽孢杆菌、青霉、毛霉、曲霉的最小抑菌浓度为1.5g/L。

表6 沙枣黄酮的抑菌圈直径(cm)Table 6 Diameter of antibacterial circle of flavonoids(cm)
3 结论
沙枣黄酮的最佳提取工艺条件为:料液比1∶18、超声时间10min,乙醇浓度60%,超声功率320W。在此工艺条件下,黄酮得率为5.28%。各因素对黄酮得率影响的主次顺序为:料液比>乙醇浓度>超声功率>超声时间;对DPPH自由基清除效果与Rancimat实验表明,沙枣黄酮具有较强的抗氧化活性;且在同一浓度下,沙枣黄酮的抗氧化能力强于VC;沙枣黄酮对六种供试菌种都有一定的抑制效果,对大肠杆菌、金黄色葡萄球菌的最小抑菌浓度为1.0g/L;对枯草芽孢杆菌、青霉、毛霉、黑曲霉的最小抑菌浓度为1.5g/L。
[1]中国科学院中国植物志编辑委员会.中国植物志[M].北京:科学出版社,1983:41-42.
[2]黄俊华,买买提江.新疆胡颓子属植物(Elaeagnus)分类探讨[J].植物研究,2005,25(3):268-271.
[3]麦合苏木·艾克木,买尔旦·马合术提.新疆沙枣提取物对实验性小鼠腹泻以及小肠推进功能的影响[J].新疆医学,2006,37(3):13.
[4]辛艳伟.沙枣的开发和利用[J].安徽农业科学,2007,35(2):399-400.
[5]胡君萍,杨建华,王晓梅,等.沙枣种子总酚的提取及纯化[J].食品科学,2010,31(12):123-126.
[6]杜瑞芳,王雨梅,刘卫东,等.高效液相色谱法同时测定沙枣中槲皮素和异鼠李素的含量[J].时珍国医国药,2008,19(4):831-832.
[7]马彦芳.沙枣叶中总黄酮的含量测定[J].西南民族大学学报:自然科学版,2006,32(6):l179-1180.
[8]王基云,姚遥,肖旭,等.沙枣花黄酮成分的含量测定及其药理作用的初步研究[J].时珍国医国药,2010,21(4):812-814.
[9]Si C L, Xu J, Wu L.Antioxidant flavonoids from bark of Elaeagnus angustifolia[J].Planta Medica,2009,75(9):943-944.
[10]孙智达,石翠芳,杨尔宁,等.沙枣果肉原花青素的提取、纯化及清除·OH能力初探[J].食品工业科技,2006,27(9):88-90.
[11]阎娥,石玉萍,王永宁,等.沙枣叶中提取的黄酮化合物对羟基自由基的清除作用[J].青海大学学报,2006,24(3):65-67.
[12]Cansev A,Sahan Y,Celik G.Chemical properties and antioxidant capacity of Elaeagnus angustifolia L.fruits[J].Asian journal of chemistry,2011,23(6):2661-2665.
[13]Dewanto V,Wu X,Adom KK.Thermal processing enhances the nutritional value of tomatoes by increasing total antioxidant activity[J].J Agric Food Chem,2002,50(10):3010-3014.
[14]Aruomaoi.Nutrition and health aspects of free radical sand antioxidants[J].Food Chemistry Toxic,1994,32(7):671-683.
[15]胡传荣,谷文英.D-α-高生育酚抗氧化活性研究[J].中国油脂,2003,28(6):37-40.
[16]郁建平,刘兴宽,古练权,等.贵州金丝桃精油成分及抗菌活性研究[J].中国药学杂志,2002,37(12):900-902.
[17]叶萍,何前军,高碧秀,等.川椒精油抗常见细菌及真菌作用实验研究[J].现代预防医学,1997,24(1):17.
