闪式提取法提取枣果皮中多酚的工艺研究
2013-09-04王彦兵刘绣华
张 迪,王 勇,王彦兵,3,刘绣华,2,*
(1.河南大学化学化工学院环境与分析科学研究所,河南开封475004;2.河南大学化学生物学研究所,河南省天然药物与免疫工程重点实验室,河南开封475004;3.河南福森药业有限公司,河南淅川 474405)
枣(Zizyphus jujube dates),又名大枣、华枣,是鼠李科枣属植物枣树的果实[1],在我国已有四千多年的种植历史。红枣作为药食同源食物,不仅具有丰富的营养,还有很强的保健作用[2]。多酚类化合物作为大枣重要的功能性成分之一,主要包括没食子酸、绿原酸、儿茶素、肉桂酸,槲皮素、芦丁等[3],它们具有清除机体自由基、抗病毒、抗肿瘤、消炎、抑制细菌生长等多种生物学活性。因此可以为食品添加剂、药品、化妆品开发、生物材料研制等提供天然的食品防腐剂和天然抗氧化剂,具有广阔的应用前景[4-6]。由于多酚类化合物不稳定,易氧化,因而快速、高效的提取方法是降低枣果皮中多酚损失的关键[7]。目前报道的有关多酚提取方法主要有超声波提取法,回流提取法等。回流提取法是在较高温度下进行,容易导致多酚的氧化,并且超声和回流提取法耗时较长,因而开发一种快速高效的提取方法具有较高的应用价值[8-10]。闪式提取是在适当溶剂条件下,利用高速机械剪切力和超速动态分子渗透作用,使组织细胞内部的有效成分迅速达到组织内外平衡,进而达到快速提取目的的一种方法,具有高效节能、操作简便、利于环保等优点[11-12]。基于此,本实验以乙醇-水为提取溶剂,通过单因素实验和正交实验确定提取枣果皮中多酚的最佳条件,并采用Folin-Ciocalteu分光光度法测定提取物中多酚的含量,以期为红枣深加工过程中产生的枣果皮废弃物进行综合利用提供理论依据。
1 材料与方法
1.1 材料与仪器
枣果皮 河南新郑好想你枣业股份有限公司;没食子酸 遵义市林原化工有限责任公司,纯度>99.0%;乙醇,碳酸钠,所用化学试剂 均为分析纯,使用前未进一步纯化;水 为二次蒸馏水。
JHBE-50S型闪式提取器 河南金鼎科技有限公司;Lab Tech UV-BlueStra型紫外可见分光光度计北京莱伯泰科仪器有限公司;BS210S型电子分析天平 北京赛多利斯公司;DK-98-1型电热恒温水浴锅 天津市泰斯特仪器有限公司;RE52CS型旋转蒸发器 上海亚荣生化仪器厂;TDL-5-A型台式离心机 上海安亭科学仪器厂;KQ-50E型超声波清洗器昆山市超声仪器有限公司。
1.2 实验方法
1.2.1 Folin-Ciocalteu(FCR)试剂 称取5g钼酸钠和20g钨酸钠置于250mL圆底烧瓶中,用150mL蒸馏水溶解,加入85%的磷酸溶液10mL和20mL浓盐酸,加热回流10h,然后加入30g硫酸锂及15mL双氧水,加热沸腾20min至亮黄色,冷却并稀释至0.5L,贮于棕色瓶中于4℃冰箱中保存[13]。
1.2.2 闪式提取枣果皮中多酚的工艺流程 枣果皮→干燥(自然风干至恒重)→粉碎(60目)→闪提→离心→抽滤→浓缩至无醇味→蒸馏水定容至250mL容量瓶中。
1.2.3 超声波法提取枣果皮中的多酚[9]称取2.00g枣果皮,以料液比1∶15(g/mL),加入60%乙醇30mL,超声提取2次,每次提取60min,提取结束后处理同1.2.2。
1.2.4 多酚得率的测定 多酚得率(mg/g)=提取的多酚质量(mg)/原料质量(g)
多酚含量的测定:采用Folin-Ciocalteu分光光度法[13]。准确取提取液1mL于10mL具塞试管中,各加3mL水,摇匀,再加1.5mL福林试剂,充分摇匀。然后加入20%碳酸钠溶液3mL,混匀后定容,在30℃水浴中避光反应30min,水做空白对照,用1cm×1cm的比色皿在760nm处测定吸光度;没食子酸标准曲线的回归方程为y=99.50x+0.00909(R2=0.9992),计算枣果皮中多酚的含量。
1.2.5 提取条件的选择 研究乙醇体积分数、料液比、提取时间、提取次数对枣皮中多酚提取的影响,以多酚得率为评价指标进行研究和分析,首先做单因素实验,考察以上条件对多酚得率的影响,然后采用正交实验法优化最佳工艺条件。
1.2.5.1 乙醇体积分数的选择 准确称取6份粉碎的枣果皮样品各2.0000g置于250mL闪式提取器中,分别加入60mL乙醇溶液作为溶剂,控制乙醇体积分数为30%、40%、50%、60%、70%、80%,设定提取时间为2min,提取1次,进行闪式提取。浸提液经减压抽滤,取一定体积溶液并按1.2.4步骤测定,在760nm处测定吸光度,计算多酚得率。
1.2.5.2 料液比的选择 准确称取6份粉碎的枣果皮样品各2.0000g置于250mL闪式提取器中,分别加入体积分数为60%乙醇溶液40、50、60、70、80、100mL作为溶剂,设定提取时间为2min,提取1次,进行闪式提取。浸提液经减压抽滤,取一定体积溶液并按1.2.4步骤测定,在760nm处测定吸光度,计算多酚得率。
1.2.5.3 提取时间的选择 准确称取6份粉碎的枣果皮样品各2.0000g置于250mL闪式提取器中,加入70mL 60%的乙醇溶液作为溶剂,设定提取1次,分别控制提取时间0.5、1.0、2.0、3.0、4.0、5.0min进行闪式提取。浸提液经减压抽滤,取一定体积溶液并按1.2.4步骤测定,在760nm处测定吸光度,计算多酚得率。
1.2.5.4 提取次数的选择 准确称取5份粉碎的枣果皮样品各2.0000g置于250mL闪式提取器中,加入70mL 60%的乙醇溶液作为溶剂,设定提取时间为2min,分别提取1、2、3、4、5次。浸提液经减压抽滤,取一定体积溶液并按1.2.4步骤测定,在760nm处测定吸光度,计算多酚得率。
1.2.5.5 最佳工艺条件的选择 为获得以乙醇溶液作为溶剂,闪式提取枣果皮中多酚的最佳工艺条件,通过研究乙醇体积分数、料液比、提取时间、提取次数等单因素,确定3个水平进行L9(34)实验如表1所示,以多酚得率为指标,探究闪式提取枣果皮中多酚的最佳工艺条件。

表1 正交实验因素及水平表Table 1 Factors and levels of orthogonal experiments
2 结果与分析
2.1 单因素实验结果与分析

图1 乙醇体积分数对多酚得率的影响Fig.1 Effect of volume fraction of ethanol on extraction rate of polyphenolics
2.1.1 乙醇体积分数对枣果皮中多酚得率的影响 在料液比1∶35(g/mL),提取时间2min,提取1次的条件下,乙醇体积分数对多酚得率的影响如图1所示。结果表明,乙醇体积分数在60%时,得率达到最大值,之后随乙醇体积分数增加多酚得率反而逐渐减小。因多酚类物质在植物中以氢键和疏水键的形式与蛋白质、多糖结合成稳定的化合物存在于植物细胞内,有机溶剂可以破坏细胞壁进入细胞,并具有氢键断裂的作用使多酚大量溶出。但当乙醇浓度高于60%时,由于醇溶性杂质“色素”等亲脂性强的成分溶出量增加,与多酚类化合物竞争同溶剂结合,从而导致多酚的提取得率下降[14]。所以乙醇体积分数为60%时的提取效果好。故选择乙醇体积分数为50%、60%、70%三个水平进行优化。
2.1.2 料液比对枣果皮中多酚得率的影响 在乙醇体积分数60%,提取时间2min,提取1次的条件下,料液比对多酚得率的影响如图2所示。结果表明,多酚的得率随着料液比的增加而逐渐增加且趋于平缓。由于提取液体积的增大会增加蒸发浓缩的能耗和工耗,为降低分离纯化的成本,因此选择料液比1∶30、1∶35、1∶40三个水平进行优化。

图2 料液比对多酚得率的影响Fig.2 Effect of the ratio of water to materials on extraction rate of polyphenolics
2.1.3 提取时间对枣果皮中多酚得率的影响 在料液比1∶35(g/mL),乙醇体积分数60%,提取1次的条件下,提取时间对多酚得率的影响如图3所示。结果表明,在3min时,多酚得率最大,在此之后得率随时间的延长而逐步下降,可能的原因是随着时间的延长,提取过程中发热,由于多酚类物质的热稳定性较差,长时间受热发生氧化或水解反应所致[15]。故选择提取时间2、3、4min三个水平进行优化。

图3 提取时间对多酚得率的影响Fig.3 Effect of extracting time on extraction rate of polyphenolics
2.1.4 提取次数对枣果皮中多酚得率的影响 在料液比1∶35(g/mL),乙醇体积分数60%,提取时间2min的条件下,提取次数对多酚得率的影响如图4所示。结果表明,随着提取次数的增加,多酚的得率逐渐增大且趋于平缓,但溶剂的消耗量增大,考虑到经济效益诸多方面的因素,故选择提取次数为1、2、3次三个水平进行优化。

图4 提取次数对多酚得率的影响Fig.4 Effect of extraction times on extraction rate of polyphenolics
2.2 正交实验结果与分析
根据单因素实验结果,选取影响枣果皮多酚提取因素中有意义的水平做正交实验,对结果进行极差分析,以确定最佳提取工艺条件。设计L9(34)正交实验,实验结果见表2。由表2数据极差分析可知,闪提次数对多酚得率的影响显著,提取时间和乙醇体积分数对多酚得率的影响较小,料液比对多酚得率的影响最小,且都不显著。从正交实验结果极差分析可知,枣果皮中多酚的最佳提取工艺为A2B2C1D3,即乙醇体积分数60%,料液比1∶35(g/mL),提取时间2min,提取3次。
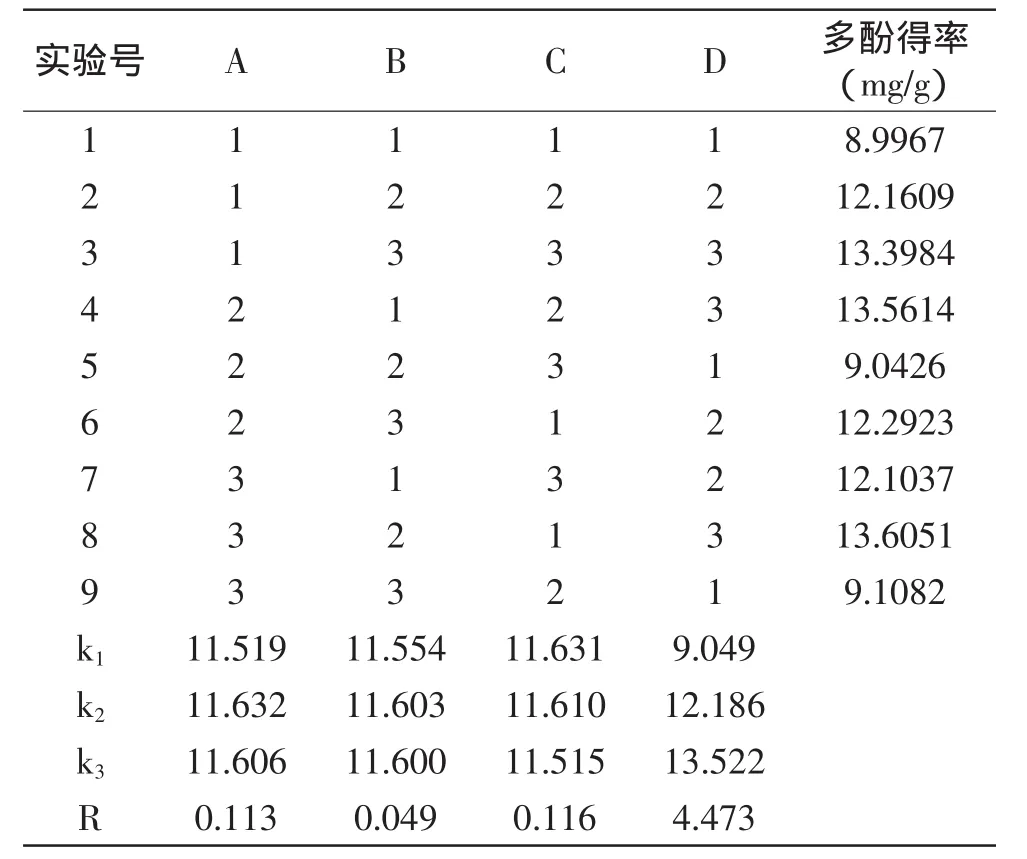
表2 正交实验结果Table 2 Results of orthogonal experiment
2.3 闪式提取枣果皮中多酚的验证实验
按照选定的条件A2B2C1D3重复实验3次,得率分别为13.59、13.64、13.63mg/g,平均值为13.62mg/g,均高于表2中其他组合的多酚得率,说明优化的提取工艺是合理的。
2.4 与超声波提取结果对比
按照实验方法1.2.3提取枣果皮中的多酚,与闪式提取的最佳提取工艺进行比较,结果见表3。由表3可知,闪式提取枣果皮中多酚比超声波法提取的多酚得率高27.53%。方差分析结果表明,闪式提取法多酚得率和超声波提取法多酚得率存在显著性差异。因此闪式提取依靠在提取时间大大缩短的同时又提高了多酚的得率,这为枣果实深加工过程中产生的废弃物综合利用提供了一定的理论依据。

表3 闪式提取与超声波提取比较Table 3 Comparison of the results of flash extraction and ultrasonic extraction
3 结论
采用闪式提取法对枣果皮中的多酚进行提取,由单因素实验得出各因素对多酚得率的影响程度为:提取次数>提取时间>乙醇体积分数>料液比,通过正交实验优化了枣果皮中提取多酚的工艺条件,最佳提取工艺条件为:乙醇体积分数60%,料液比1∶35(g/mL),提取时间2min,提取3次,此条件下多酚的得率为13.62mg/g。该提取工艺与超声波法相比,闪式提取的多酚得率大大提高。因此,闪式提取法是提取枣果皮中多酚的一种快速高效的提取方法,具有较高的应用价值。
[1]国家药典编委会.中国药典[S].一部.北京:中国医药科技出版社,2010:21-22.
[2]刘西建,张艳.大枣药用历史沿革[J].陕西中医,2011,32(3):352-353.
[3]焦中高,刘杰超,周红平,等.枣果中酚类物质的高效液相色谱分析[J].食品与发酵工业,2008,34(3):133-136.
[4]Kim YJ,Son DY.Hot water leaves extracts of Zizyphus jujube exert antioxidative effects in vitro and cytotoxicity in human cancer cell lines[J].Horticulture Environment and Biotechnology,2011,52(6):635-640.
[5]刘丹丹,李炳奇,陈韩英,等.沙枣不同果、叶中多酚类物质抗氧化能力比较的研究[J].食品工业科技,2011,32(12):93-95.
[6]Suk-Hyun Choi, Jun-Bae Ahn, Nobuyuki Kozukue, et al.Distribution of Free Amino Acids,Flavonoids,Total phenolics and Antioxidative Activities of jujube(Zizyphus jujuba)Fruits and Seeds Harvested from Plants Grown in Korea[J].J Agric Food Chem,2011,59:6594-6604.
[7]郑裕国,王远山,薛亚平,等.抗氧化剂的生产及应用[M].北京:化学工业出版社,2004:334-336.
[8]周春权,郭丹,倪峰.超声和回流提取草珊瑚茎中迷迭香酸的比较[J].福建中医药大学学报,2012,22(1):33-35.
[9]郭英,贝玉祥,王雪梅,等.超声波法提取广枣多酚的研究[J].云南中医中药杂志,2008,31(22):36-37.
[10]田成.桂花果实多酚的超声波提取及抗氧化活性研究[J].食品科学,2011,32(24):106-110.
[11]吴冬梅.闪式提取器在中药研究中的应用[J].中国实验方剂学杂志,2006,12(7):34-37.
[12]陈卓君,艾买提·阿曼古力,戴蕴青,等.响应面法优化闪式提取玫瑰黄酮化合物工艺[J].食品工业科技,2011,32(12):387-390.
[13]田树革,魏玉龙,刘宏炳.Folin-Ciocalteu比色法测定石榴不同部位总多酚的含量[J].光谱实验室,2009,26(2):341-344.
[14]李勇,黄昀,陈娜,等.超声辅助提取辣椒叶中多酚的工艺研究[J].食品工业科技,2012,33(13):216-219.
[15]李臻,吴晖,赖富饶,等.溪黄草多酚的超声提取及其抗氧化性的研究[J].食品工业科技,2012,33(12):285-261.
