无载体固定化少根根霉产脂肪酶发酵培养基的优化
2013-09-04冀颐之赵有玺王群群谭天伟
冀颐之,赵有玺,龚 平,王群群,谭天伟
(1.北京联合大学生物化学工程学院,北京 100023;2.北京化工大学教育部生物炼制工程中心,北京100029)
脂肪酶(Lipase,EC 3.1.1.3,甘油三酰酯水解酶)是一类能催化长链脂肪酸甘油酯水解为甘油和长链脂肪酸的酶类(或此反应的逆反应)。除催化水解反应和酯化反应外,脂肪酶还能催化酯交换反应、转酯反应、醇解反应、酸解反应以及氨解反应等多种化学反应。具有严格的底物专一性、催化活性高而副产物少、催化过程不需要辅助因子等特点[1]。根霉属(Rhizopus sp.)脂肪酶具有高度的1、3位置专一性,由于其特别适用于含油脂食品的增香、芳香酯及其他酯类的合成和某些手性化合物的拆分等方面,因此受到了众多研究者和企业研发部门的关注[2]。霉菌深层发酵时菌体形态复杂,而菌体形态又显著的影响着发酵过程中的传质、溶氧,因此发酵过程中对于菌体形态的有效控制是发酵成功的关键因素。研究表明若条件控制不好,根霉菌体易聚集成团块状,引起氧气及其他营养物质的传递困难,导致整体发酵水平较低[3-5]。无载体固定化方法又称为自聚集法,是一种利用细胞自聚集特性形成固定化颗粒的技术,其具有不使用载体材料、技术简便,成本低廉等优点,是固定化细胞技术中的全新概念,有着良好的应用前景[6]。目前,脂肪酶的固定化发酵多采用载体固定化方式[7],无载体固定化根霉的研究仅见于有机酸发酵中[8-9],而在脂肪酶生产中还未见报道。发酵培养基成分对脂肪酶生产有着非常显著的影响[10-12]。研究报道脂肪酶的产生依赖于碳源、氮源、诱导剂、无机盐等多种培养基成分,由于生产菌株及所产脂肪酶的特性不同,因此其最优产酶培养基也不相同。对于无载体固定化少根根霉发酵生产脂肪酶而言,培养基成分不仅影响脂肪酶产量,还影响着菌体形态,因此适宜的培养基配方有利于提高根霉菌体的固定化效果。论文拟通过单因子和正交实验对影响无载体固定化少根根霉生产脂肪酶的培养基成分进行研究,以获得最佳培养基配方,进一步提高脂肪酶的产量。
1 材料与方法
1.1 材料与仪器
少根根霉(Rhizopus arrhizus)N-103 为本实验室保存菌种;斜面种子培养基 PDA培养基;种子培养基 葡萄糖15g/L,酵母粉1g/L,(NH4)2SO41g/L,K2HPO41g/L,MgSO4·7H2O 0.75g/L,NaCl 0.5g/L,去离子水1000mL,pH8,250mL三角瓶装液量为100mL;发酵基础培养基 花生油5mL/L,全脂豆粉15g/L,(NH4)2SO41g/L,K2HPO42.5g/L,MgSO40.5g/L,pH 自然,250mL三角瓶装液量为100mL。
超净工作台 北京君合华科技发展有限公司;霉菌培养箱MJX型 金坛市城东久久实验仪器厂;台式恒温振荡器THZ-D 江苏太仓实验设备厂;数显恒温水浴锅HH-6 金坛市科兴仪器厂;生物传感分析仪SBA-40C型 北京中西远大科技有限公司。
1.2 实验方法
1.2.1 培养方法
1.2.1.1 斜面种子培养 26℃恒温培养箱中培养4d。
1.2.1.2 无载体固定化少根根霉的制备 接入发酵液的孢子终浓度在3×105个/mL,26℃恒温摇床,130r/min,培养24h。
1.2.1.3 摇瓶发酵优化培养条件 接种种龄24h,接种量10%、26℃恒温摇床,130r/min,培养72h。
1.2.2 单孢子悬液的制备 将30mL生理盐水倒入斜面中,用接种钩将斜面上少根根霉孢子全部刮下,经2层无菌擦镜纸过滤至带有10颗玻璃珠的三角瓶中,充分振荡,将孢子打散,再以2层无菌擦镜纸过滤,去除残余菌丝体,获得的孢子悬液,用血球计数板计数,调整孢子浓度为1×106个/mL备用。
1.2.3 脂肪酶活力的测定 采用橄榄油乳化法测定[13]。在37℃,pH7.0下每分钟产生1μmol脂肪酸所需脂肪酶的量,即为1个脂肪酶国际单位,以U表示。聚乙烯醇橄榄油乳化液5mL和0.05mol/L pH7.0磷酸缓冲液4mL,加入1mL经适当稀释的样品,37℃精确反应10min。加入95%乙醇20mL终止反应,以酚酞为指示剂,用50μmol/mL标准NaOH滴定至微红为终点,记录消耗NaOH标准溶液的体积,同时以在酶反应前加入乙醇的实验组作空白对照。同一样品进行3组平行实验,分别计算其脂肪酶活力,实验结果以3组数据平均值表示。
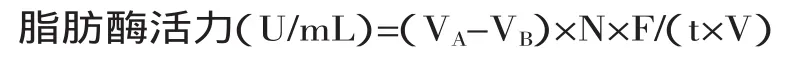
式中:VA—样品消耗NaOH溶液体积(mL);VB—空白样品消耗NaOH溶液体积(mL);N—NaOH溶液浓度(μmol/mL);F—样品稀释倍数;V—参加反应的样品体积(mL);t—反应时间(min)。
1.2.4 培养基优化实验
1.2.4.1 不同种类诱导剂对产酶影响的实验 选择油酸、大豆油、花生油、橄榄油为诱导剂,分别以5ml/L的浓度加入发酵基础培养基中,考察不同种类诱导剂对产酶的影响。
1.2.4.2 不同花生油含量对产酶影响的实验 将花生油分别以2.5、5、10、20、30mL/L的浓度加入发酵基础培养基中,考察不同花生油含量对产酶的影响。
1.2.4.3 不同种类碳源对产酶影响的实验 选择葡萄糖、蔗糖、乳糖、麦芽浸粉、糊精、麸皮多糖水解液、玉米淀粉水解液、碎米水解液、白糠水解液为碳源,以发酵基础培养基为对照组,考察不同碳源对产酶的影响。其中葡萄糖、蔗糖、乳糖、麦芽浸粉、糊精以5g/L的浓度加入已优化的培养基中,麸皮多糖水解液、玉米淀粉水解液、碎米水解液、白糠水解液以其葡萄糖含量5g/L的浓度加入已优化的培养基中。
1.2.4.4 不同麸皮多糖水解液含量对产酶影响的实验 将葡萄糖含量为50g/L的麸皮多糖水解液分别以0、25、50、75、100mL/L的含量加入已优化的培养基中,考察不同麸皮多糖水解液含量对产酶的影响。
1.2.4.5 不同种类有机氮源对产酶影响的实验 选择全脂豆粉、豆粕粉、大豆蛋白、豆饼粉、小麦胚芽蛋白、棉籽蛋白作为有机氮源,分别以15g/L的浓度加入已优化的培养基中,考察不同种类有机氮源对产酶的影响。
1.2.4.6 不同棉籽蛋白含量对产酶影响的实验 将棉籽蛋白分别以10、15、20、25g/L的浓度加入已优化的培养基中,考察不同棉籽蛋白含量对产酶的影响。
1.2.4.7 不同种类无机氮源对产酶影响的实验 选择(NH4)2SO4、NH4CL、(NH4)2HPO4、NH4NO3作为无机氮源,分别以1g/L的浓度加入已优化的培养基中,考察不同无机氮源对产酶的影响。
1.2.4.8 不同(NH4)2SO4浓度对产酶影响的实验 将(NH4)2SO4分别以1、2、3、4g/L的浓度加入已优化的培养基中,考察不同(NH4)2SO4含量对产酶的影响。
1.2.4.9 无机盐对产酶影响的正交实验 经过单因素优化实验,选择MgSO4、KH2PO4、K2HPO4、CaCO34个因素,进行L9(43)正交实验,考察不同浓度盐离子对产酶的影响。
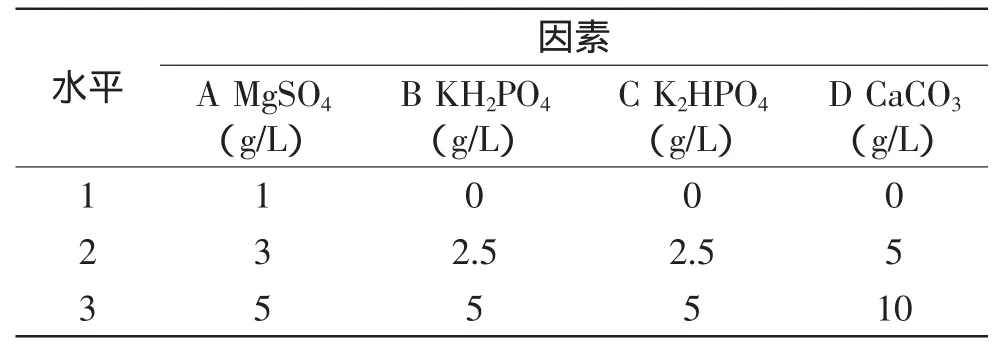
表1 正交实验因素水平表Table 1 The level of four tested factors on salts
2 结果与讨论
2.1 不同种类诱导剂对产酶的影响
多数脂肪酶为诱导型酶,因此诱导剂的添加可显著的增加脂肪酶的产量。研究表明在脂肪酶发酵过程中添加一定量的脂肪酸或脂类物质不仅可以充当碳源,提高菌体生物量,而且还可以起到诱导产酶的作用[7,14-15]。常用的脂肪酶诱导剂主要有:甘油三酯、长链脂肪酸、游离脂肪酸及其结构类似物[16-17]等。本实验考察了油酸、大豆油、花生油、橄榄油为诱导剂时对产酶的影响,实验结果见图1。花生油、橄榄油、大豆油实验组在发酵63h时脂肪酶酶活达到最高值,而油酸实验组达到最高值的发酵时间为65h,较三种天然油脂延长了2h。比较各组脂肪酶酶活,其最高值相差不大,油酸实验组最高为77.5U/mL,大豆油最低为62.5U/mL,而花生油和橄榄油基本接近油酸实验组,分别为75U/mL和72.5U/mL,因此油酸、花生油和橄榄油在发酵中均可充当诱导剂和部分碳源,考虑到花生油成本较低,选择花生油为最佳脂肪酶诱导剂。

图1 不同种类诱导剂对产酶的影响Fig.1 Effects of inducer sources on lipase production
2.2 不同花生油含量对产酶的影响

图2 不同花生油含量对产酶的影响Fig.2 Effects of concentrations of peanut oil on lipase production
如图2所示,随着花生油添加量的增加,脂肪酶酶活呈先升后降趋势。花生油浓度为2.5mL/L的实验组,由于含量较低,并不能满足菌体生长需要,因此脂肪酶酶活较低,仅为60U/mL;当花生油浓度高于10mL/L后,由于花生油添加量过大,碳氮比不均衡,花生油并不能被菌体完全利用,发酵结束后,在发酵液表面会残留大量的团块状脂类物质,代谢不完全的产物一定程度上抑制了酶活,导致酶活较低;花生油浓度为5mL/L时,菌球分散均匀,形态饱满,且酶活最高,因此选择其为最佳花生油浓度。此结果与相关报道中油脂在低浓度时对产酶有利,高浓度时对产酶有一定抑制作用[18]的结论一致。
2.3 不同种类碳源对产酶的影响
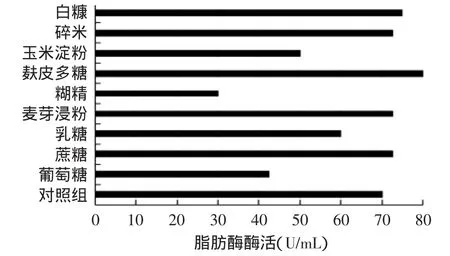
图3 不同种类碳源对产酶的影响Fig.3 Effects of carbon sources on lipase production
由图3可知,加入葡萄糖、乳糖、玉米淀粉和糊精的实验组酶活低于对照组,分析原因,可能是由于5g/L的葡萄糖、乳糖对产酶有阻遏作用,这与多数研究得出的易利用碳源对产酶有抑制作用的结论相一致[19-20]。而玉米淀粉和糊精实验组酶活较低的原因则是由于固定化菌体形态较差引起的。麸皮多糖实验组脂肪酶酶活最高,达到80U/mL,且菌球形态较好,利于发酵液的传质。因此,选择麸皮多糖为最优碳源,并进一步考察其浓度对产酶的影响。
2.4 不同麸皮多糖水解液含量对产酶的影响

图4 不同麸皮多糖水解液含量对产酶的影响Fig.4 Effects of concentrations of bran polysaccharide hydrolyzate on lipase production
随着麸皮多糖水解液添加量的增加,脂肪酶酶活也呈上升趋势,但当麸皮多糖水解液大于75mL/L时,酶活出现下降。由此可知,添加适量的麸皮多糖水解液,起到了增加慢效碳源浓度的作用,有利于脂肪酶产生。但当添加量过高时,菌体过度生长,酶活降低。添加量为75mL/L的实验组酶活最高,脂肪酶酶活可达到85U/mL,因此选择75mL/L为麸皮多糖水解液最适添加量。
2.5 不同种类有机氮源对产酶的影响

图5 不同种类有机氮源对产酶的影响Fig.5 Effects of organic nitrogen sources on lipase production
氮源是培养基的必备成分,培养基中氮源的种类、含量及其配比直接影响菌体生长的速度、菌体的形态控制,以及脂肪酶的产量。如图5所示,在各实验组中,豆粕粉、大豆蛋白、豆饼粉实验组脂肪酶酶活较低,但原因却不相同。前两组是由于菌体过度生长,降低了固定化菌体的使用效果,脂肪酶产量低;而豆饼粉实验组则是由于其含氮量较低,菌体生长缓慢,从而影响了脂肪酶的生成;全脂豆粉实验组脂肪酶活力较高,但菌体过度生长,形态较差;小麦胚芽蛋白和棉籽蛋白实验组,菌球呈饱满的小球状,分散均匀,发酵状态良好,酶活较高,发酵64h,脂肪酶酶活分别达到72.5、90U/mL,其中棉籽蛋白实验组中含有较多的不溶性含氮物质,可作为慢效氮源,缓慢释放,既保证了氮源的充足,又有效的控制了固定化菌体形态,因此选用棉籽蛋白作为最优的有机氮源。
2.6 不同棉籽蛋白含量对产酶的影响
通过实验发现棉籽蛋白含量10、15g/L的实验组菌体的生长状态良好,20、25g/L的实验组菌体形态略成团状,固定化菌体效果较差;其中加入15g/L棉籽蛋白的实验组酶活最高,达到90U/mL,此浓度可完全满足菌体生长和产酶需求,所以选用添加量为15g/L的棉籽蛋白作为最适添加量。
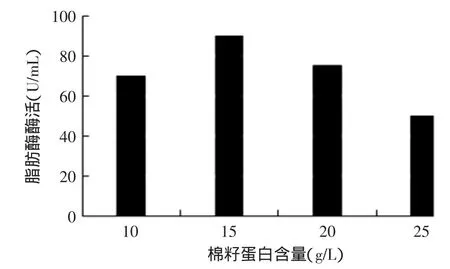
图6 不同棉籽蛋白含量对产酶的影响Fig.6 Effects of concentrations of cottonseed protein on lipase production
2.7 不同种类无机氮源对产酶的影响
在脂肪酶发酵的研究中,一般认为复合氮源对微生物生长及产酶有利[21-22],有机氮源和无机氮源相复合其效果好于有机氮源的复合[23]。分别考察了复合不同无机氮源 (NH4)2SO4、NH4Cl、(NH4)2HPO4、NH4NO3后对产酶的影响。实验发现添加(NH4)2SO4和(NH4)2HPO4的实验组酶活较高,分别为92.5、95U/mL,但由于(NH4)2HPO4实验组中菌球呈絮状生长,无法形成分散均匀的自聚集菌球,因此选择(NH4)2SO4作为最佳无机氮源。
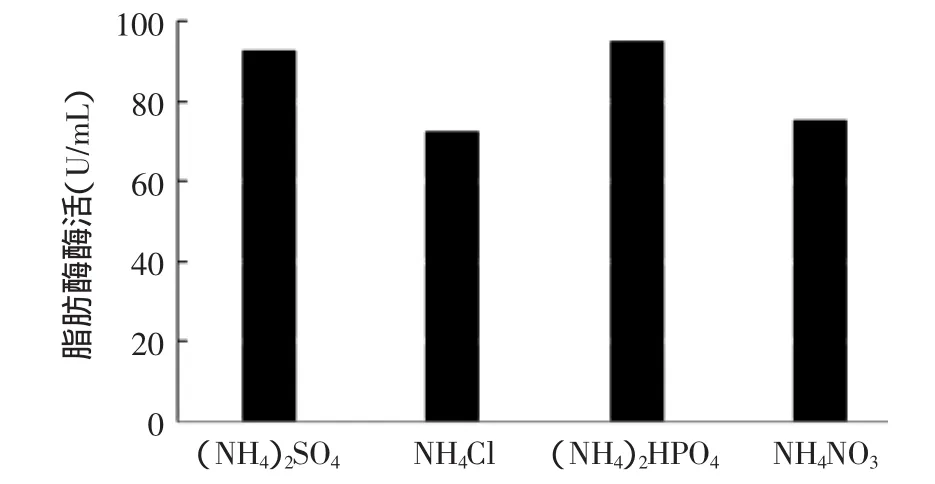
图7 不同无机氮源对产酶的影响Fig.7 Effects of inorganic nitrogen sources on lipase production
2.8 不同(NH4)2SO4浓度对产酶的影响
如图8所示,通过对不同(NH4)2SO4添加量的实验发现,加入(NH4)2SO4浓度为2g/L时脂肪酶酶活最高,达到95U/mL。所以选用2g/L为(NH4)2SO4的最优浓度。
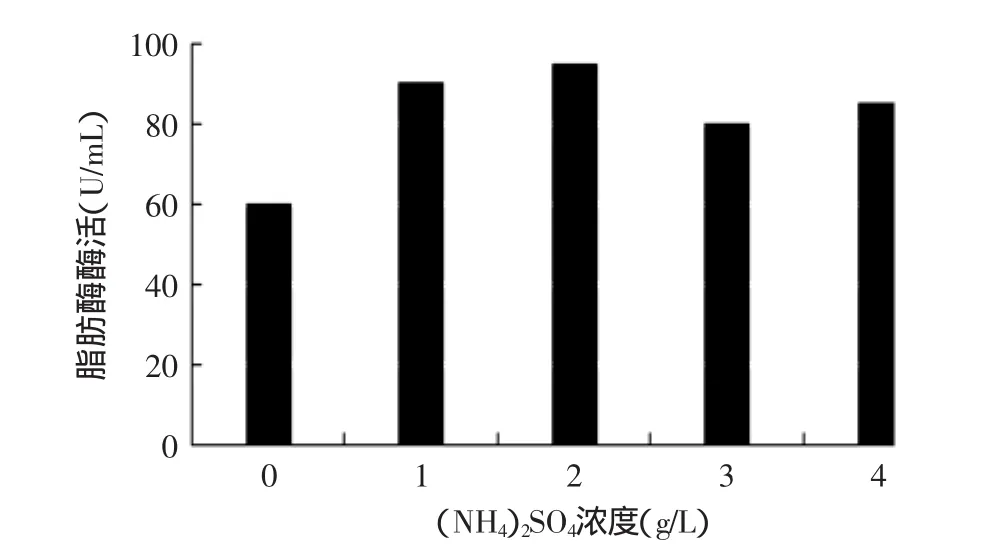
图8 不同(NH4)2SO4浓度对产酶的影响Fig.8 Effects of concentrations of(NH4)2SO4on lipase production
2.9 无机盐对产酶的影响
研究表明无机盐对发酵产酶也有显著影响。通常认为K+、Mg2+、Ca2+等对脂肪酶产生有促进作用,而Mn2+、Ba2+、Zn2+、Fe3+、Co2+、Cu2+等则抑制脂肪酶产生[22],因此选择MgSO4、KH2PO4、K2HPO4、CaCO3考察不同浓度盐离子对少根根霉产脂肪酶的影响。
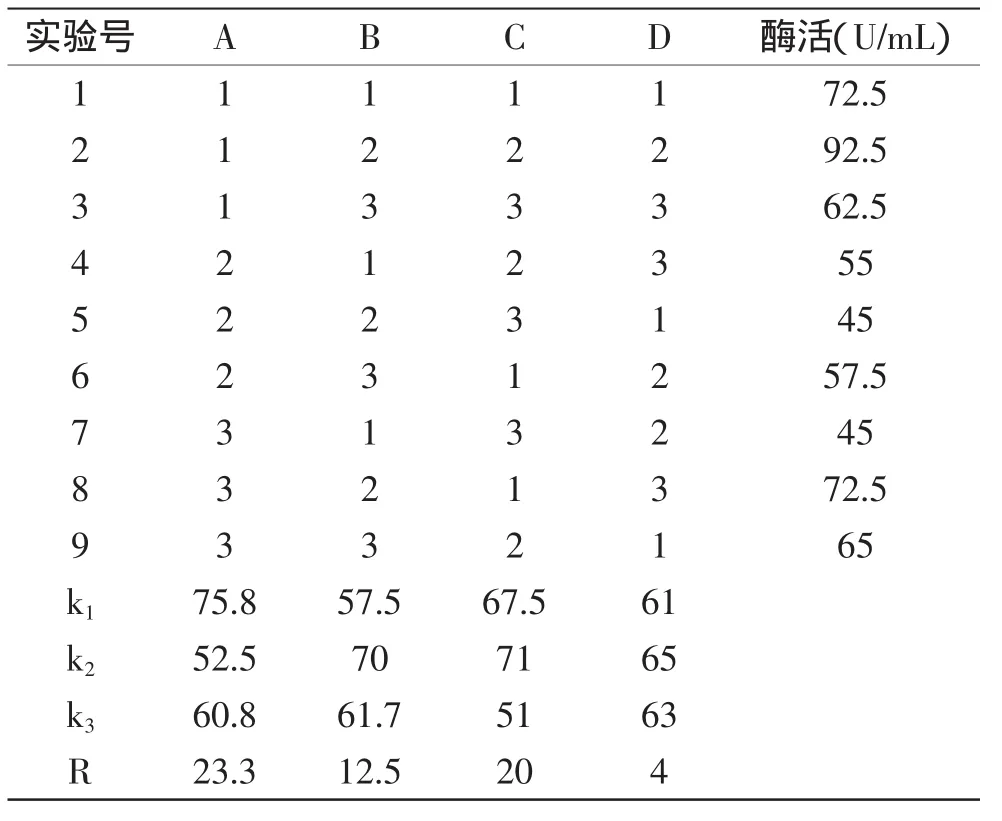
表2 正交实验结果分析Table 2 The analysis of the orthogonal experimental results on salts
正交实验结果如表2所示,通过正交实验发现4种无机盐对产酶的影响大小顺序为:A>C>B>D,即MgSO4>K2HPO4>KH2PO4>CaCO3。选择均方最小的D作为误差,进行方差分析,结果见表3。因素A、C均具有显著性影响,因此确定MgSO4和K2HPO4最优添加量分别为A1、C2,即MgSO41g/L、K2HPO42.5g/L。KH2PO4及CaCO3不具显著性,因此选择不添加。确定少根根霉产脂肪酶的无机盐最优配方为:MgSO41g/L、K2HPO42.5g/L。
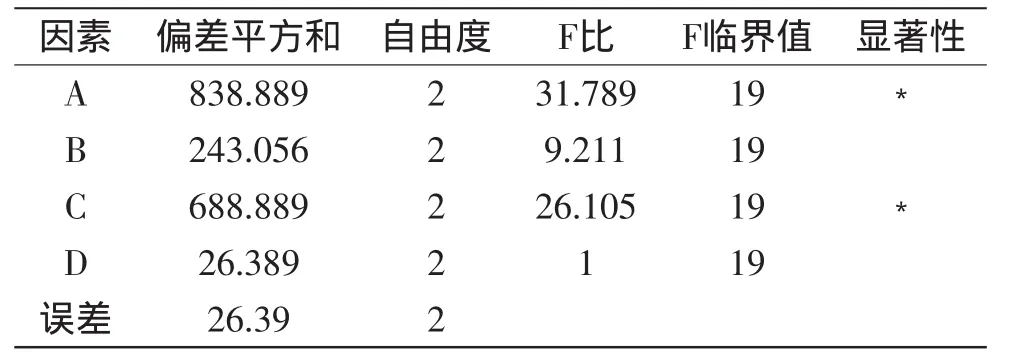
表3 方差分析表Table 3
2.10 最优培养基验证实验
通过上述实验获得少根根霉产脂肪酶最优发酵培养基配方为:花生油5mL/L、麸皮多糖水解液75mL/L、棉籽蛋白15g/L、(NH4)2SO42g/L、MgSO41g/L、K2HPO42.5g/L。对此配方进行摇瓶验证实验,发酵64h,脂肪酶活达到最高,其值为100U/mL,为基础培养基配方对照组的1.33倍。
3 结论
在研究中发现作为诱导剂的花生油在低浓度时对产酶有利,高浓度时对产酶则有一定抑制作用;葡萄糖、乳糖等较易利用碳源对脂肪酶的生成有阻遏作用;棉籽蛋白和(NH4)2SO4组成的复合氮源较单一有机氮源对产酶有利;Mg2+、K+对产酶有显著性影响,而Ca2+对产酶无显著性影响。
通过单因子和正交实验获得了无载体固定化少根根霉产脂肪酶的最优发酵培养基配方为:花生油5mL/L、麸皮多糖水解液75mL/L、棉籽蛋白15g/L、(NH4)2SO42g/L、MgSO41g/L、K2HPO42.5g/L。对所得最优发酵培养基配方进行摇瓶验证实验,在此条件下,少根根霉脂肪酶酶活可达100U/mL,为基础培养基配方对照组的1.33倍。
研究结果为无载体固定化少根根霉发酵生产脂肪酶奠定了实验基础,对进一步规模化培养,实现根霉脂肪酶的工业化生产具有一定的现实意义。
[1]舒正玉,薛龙吟,林瑞凤,等.新型微生物脂肪酶资源开发[J].微生物学通报,2009,36(5):747-752.
[2]颜兴和,王栋,徐岩.根霉脂肪酶的研究进展[J].工业微生物,2005,35(3):45-49.
[3]李丹.少根根霉发酵生产脂肪酶[D].北京:北京化工大学,2007.
[4]滕云.酯合成脂肪酶高产菌的选育及其产酶发酵调控的研究[D].无锡:江南大学,2008.
[5]杨学昊.固定化少根根霉发酵生产脂肪酶[D].北京:北京化工大学,2004.
[6]白风武.无载体固定化细胞的研究进展[J].生物工程进展,2000,20(2):32-34.
[7]Yang Xuehao,Wang Bingwu,Cui Fengnan,et al.Production of lipase by repeated batch fermentation with immobilized Rhizopus arrhizus[J].Process Biochemistry,2005,40:2095-2103.
[8]Bai Dong-Mei,Jia Min-ze.L(+)-Lactic acid production from glucose by Rhizopus oryzae in air-lift bioreactor[J].Journal of Fermentation and Bioengineering,1998,85(1):96-100.
[9]徐晴,高振,付永前,等.米根霉ME-F12发酵产富马酸的菌体形态控制[J].生物加工过程,2009,7(2):48-52.
[10]O’Donnell Dara,Wang Liping,Xu Jianfeng,et al.Enhanced heterologous protein production in Aspergillus niger through pH control of extracellular protease activity[J].Biochemical Engineering Journal,2001,8:187-193.
[11]Daniela A Martinez,B Clara Nudel.The improvement of lipase secretion and stability by addition of inert compounds into Acinetobacter calcoaceticus cultures[J].Canadian Journal of Microbiology,2002,48:1056-1061.
[12]Noriho Kamiya, Takashi Ogawa, Teruyuki Nagamune.Enhancement of apparent thermostability of lipase from Rhizopus sp.by the treatment with a microbial transglutaminase[J].Biotechnology Letters,2001,23:1629-1632.
[13]Li Dan,Wang Bing wu,Tan Tian wei.Production enhancement of Rhizopus arrhizus lipase by feeding oleic acid[J].Journal of Molecular Catalysis B Enzymatic,2006,43(1/4):40-43.
[14]陈守文,徐柔,章克昌,等.微球菌的脂肪酶调节[J].微生物学通报,1998,25(4):202-205.
[15]孙舒扬,王栋,徐岩.固液态发酵中橄榄油对Rhizopus chinensis全细胞脂肪酶的影响[J].微生物学通报,2006,33(4):10-14.
[16]施巧琴.碱性脂肪酶的研究——I菌株的分离和筛选[J].微生物学报,1981,8(3):108-110.
[17]M Höfelmann,J Hartmann,A Zink,et al.Isolation,purification and characterization of lipase isoenzymes form a technical Aspergillus niger enzyme[J].Journal of Food Science,1985,50:1721-1731.
[18]李江华,邬敏辰,邬显章.圆弧青霉PG37碱性脂肪酶的发酵工艺条件[J].无锡轻工大学学报,2000,19(2):100-104.
[19]宋欣,曲音波.耐碱性脂肪酶产生菌的选育及酶学性质的研究[J].工业微生物,1999,29(4):22-26.
[20]Patrick Fickers, Franck Fudalej, Jean-Marc Nicaud, et al.Selection of new over-producing derivatives for the improvement of extracellular lipase production by the non-conventional yeast Yarrowia lipolytica[J].Journal of Biotechnology,2005,115(4):379-386.
[21]Tan Tianwei,Zhang Mu,Xu Jiali,et al.Optimization of culture conditions and properties of lipase from Penicillium camembertii Thom PG-3[J].Process Biochemistry,2004,39 (11):1495-1502.
[22]徐岩,谢红想,王栋,等.一株根霉产脂肪酶发酵条件的研究[J].工业微生物,1999,29(1):6-10.
[23]杨学昊,尹春华,傅四周,等.根霉脂肪酶发酵优化和酶性质的研究[J].中国油脂,2004,29(7):29-32.
