超声波强化酶法合成L-抗坏血酸癸酸酯及其抗氧化性研究
2013-12-08晏日安曾永青
李 卓,晏日安,*,曾永青
(1.暨南大学食品科学与工程系,广东广州 510632;2.广州市食品工业研究所,广东广州 510410)
L-抗坏血酸(VC)是一种常用的水溶性抗氧化剂,然而其亲水性限制了其在疏水相体系中的应用,尤其是在脂溶性食品方面的应用,如抗油脂氧化等。当L-抗坏血酸分子的羟基通过酯化接入疏水性的长链脂肪酸基团后,其亲油性增加,使之成为一种兼具抗氧化性和乳化性两种性能的优良食品添加剂。L-抗坏血酸脂肪酸酯高效、安全、无毒,易溶于醇、醚及油脂中,对高温、光照、重金属、酸碱条件均较抗坏血酸稳定。部分种类的L-抗坏血酸脂肪酸酯已经被用来代替传统的抗氧化剂[1],如L-抗坏血酸棕榈酸酯(L-AP)作为油脂类抗氧化剂已经应用在很多油脂及含油食品中。L-抗坏血酸脂肪酸酯的合成有化学合成法和酶催化法。虽然前者的得率较高,但反应条件剧烈,并要用到浓硫酸等腐蚀性催化剂[2]。后者是利用脂肪酶在有机介质中催化酯合成反应,该合成方法反应条件温和,副反应少[3]。因此,国内外有很多对酶催化合成L-抗坏血酸脂肪酸酯的研究,但目前的研究主要集中在少数几种L-抗坏血酸脂肪酸酯的合成和性质研究,如L-抗坏血酸棕榈酸酯等[4-5]。本文研究了合成一种新型L-抗坏血酸脂肪酸酯-L-抗坏血酸癸酸酯(L-AD),并确定在超声波场中酶法合成的最佳合成条件,所得产物L-抗坏血酸癸酸酯在室温下为白色有光泽的针状晶体,具有一定的油溶性,且抗氧化性强。L-抗坏血酸癸酸酯的合成过程中,水溶性的L-抗坏血酸在溶液的溶解度小和底物在反应过程中局部浓度不均匀是制约产率提高的因素。超声波近年来已经应用在了许多化学合成领域,其产生的空化作用在化学合成方面有重要作用[6]。超声波的高频振动不仅可以促进底物L-抗坏血酸的溶解,增大其浓度促进酯化反应平衡右移以提高产率[2,7],并且可以使底物均匀分散在溶剂中,有效解决局部浓度不均匀的问题,提高底物与酶的有效碰撞次数,加速反应的进行。本工作研究了新型抗氧化剂L-抗坏血酸癸酸酯的酶法合成,通过超声波场的作用来提高反应速度、提高产率,确定了合成的最佳条件,并研究了L-抗坏血酸癸酸酯的分离纯化方法,对产物的纯度和结构进行了分析鉴定,同时测试了固定化脂肪酶(Novozym®435)可以重复使用的次数。另外,从羟基自由基体系、DHHP自由基体系、还原力测试以及氧化诱导时间测定等方面对L-抗坏血酸癸酸酯抗氧化性进行研究,为新型L-抗坏血酸脂肪酸酯衍生物的合成与应用提供了理论依据。
1 材料与方法
1.1 材料与设备
L-抗坏血酸、邻二氮菲 天津市天新精细化工开发中心;癸酸 上海凌峰化学试剂有限公司;叔丁醇、无水硫酸镁、变色硅胶、硫酸亚铁、三氯化铁、三氯乙酸 天津市福晨化学试剂厂;乙酸乙酯、正己烷、4A分子筛 天津市富宇精细化工有限公司,以上材料均为分析纯;二苯苦味肼基自由基(DHHP·) 美国SIGMA-ALDRICH公司;大豆油 中粮集团有限公司;葵花籽油 金龙鱼股份有限公司。
SB25-12DTDN型超声波处理机 宁波新芝生物科技有限公司;RE-52 AAB型旋转蒸发器 上海嘉鹏科技有限公司;X-5型显微熔点测定仪 北京泰克仪器有限公司;KDC-1044型低速离心机 科大创新股份有限公司;DZF-6030A型真空干燥箱 上海一恒科学技术有限公司;2XZ型旋片式真空泵 上海仪器供销公司;EQUINOX 55型红外光谱仪 布鲁克光谱仪器公司;4000Q Trap型质谱仪 AB SCIEX公司;UV-1601型紫外可见分光光度仪 北京瑞利分析仪器有限公司;743型Rancimat氧化稳定性测试仪 瑞士万通中国有限公司。
1.2 实验方法
1.2.1 L-抗坏血酸癸酸酯的合成方法 150mL圆底烧瓶,在固定化脂肪酶(Novozym®435)用量为L-抗坏血酸质量的20%,L-抗坏血酸初始浓度为0.2mmol/mL、底物癸酸与L-抗坏血酸的摩尔比为3∶1、4A分子筛用量为每10mL溶剂1g、水浴恒温55℃,超声波功率密度为0.40W/cm2,反应时间为4h的条件下时,反应液经固液分离,分出酶、分子筛,所得滤液经减压蒸馏蒸出溶剂,得到粗产物经真空干燥后用乙酸乙酯溶解,再经水洗、分液后用无水硫酸镁干燥12h,抽滤得滤液经减压蒸馏得到的产物用甲苯重结晶两次,正己烷洗涤,真空干燥5h,称产物质量并计算产率。
红外光谱用布鲁克光谱仪器公司EQUINOX 55型傅立叶变换红外光谱仪测定,晶体直接测量,扫描范围4000~500cm-1。
质谱由美国AB SCIEX公司的4000Q Trap质谱仪测定,采用电喷雾ESI离子源,电子能量70eV,传输线温度275℃,离子源温度200℃,采用负离子模式,母粒子m/z330,激活电压1.5V,质量扫描范围0~1000。
1.2.2 L-抗坏血酸癸酸酯的纯度测定 产物用显微熔点仪测定产物熔程,测得产物熔程须在2℃以内。并且用国标GB16314-1996的碘量法方法测定产物的纯度[8]。
1.2.3 L-抗坏血酸癸酸酯对羟自由基清除能力的测定 对羟基自由基清除能力的测定采用Fenton反应[9]。先配制0.75mmol/L邻二氮菲无水乙醇溶液,取该液1mL,加2mL的0.2mmol/L磷酸盐缓冲液(pH7.4),充分混匀后加入0.75mmol/L硫酸亚铁溶液1mL,混匀后加入1mL不同浓度的L-抗坏血酸癸酸酯样品为处理样,对照样加入1mL蒸馏水以补充体积;最后加入0.01%H2O21mL,空白对照不加0.01%H2O2,以蒸馏水补充体积。反应液在37℃保温1h后,于536nm处测定吸光度。同时与TBHQ、VC、AP比较清除能力。样品对羟自由基的清除率按下式计算:
清除率(%)=(A536处理-A536对照)/(A536空白对照-A536对照)×100
1.2.4 L-抗坏血酸癸酸酯对DHHP自由基清除能力的测定 配制浓度为0.2mmol/L的DPPH·乙醇溶液,分别吸取不同浓度的L-抗坏血酸癸酸酯样品的乙醇溶液2mL,加入0.2mmol/L的DPPH·乙醇溶液2mL,摇匀后在室温黑暗处放置30min。以无水乙醇调零,测定517nm处的吸光值A样品。再测定2mL DPPH溶液与2mL乙醇在517nm处的吸光值ADPPH·。同时与TBHQ、VC、AP比较清除能力[10]。样品对DPPH·清除率按下式计算:清除率(%)=(ADPPH·-A样品)/ADPPH·×100
1.2.5 L-抗坏血酸癸酸酯还原能力的测定 采用普鲁士蓝法[11],并略作改进。先将样品配成一定质量浓度溶液,取0.5mL L-抗坏血酸癸酸酯样品溶液,加入到2.5mL 0.2mol/L的磷酸缓冲溶液(p H6.6)和2.5mL 1%的铁氰化钾(K3Fe(CN)6)的离心管中,混合均匀,50℃水浴20min后快速冷却,加入2.5mL 10%的三氯乙酸溶液,2000r/min离心10min。取上清液2.5mL,加入2.5mL蒸馏水和0.5mL 0.1%的三氯化铁溶液,混合均匀,室温下静置反应10min,于700nm处检测吸光值。溶液在700nm处的吸光值越高,则样品的还原能力越强。同时与TBHQ、VC、AP比较还原力。
1.2.6 L-抗坏血酸癸酸酯在油脂中的抗氧化性能的测定 通过测定各添加抗氧化剂的油样氧化诱导期,比较抗氧化性[12]。精确称取20mg各抗氧化样品,用无水乙醇分出1.0mg/mL乙醇溶液,根据需要用移液管准确移取一定量的抗氧化剂溶液分别加入到3.00g油样中,配成相应200ppm级的试样,然后在Rancimat仪上测定各油样的氧化诱导期,空气流速为10mL/min,实验温度为120℃。同时与TBHQ、VC、L-抗坏血酸棕榈酸酯(AP)比较氧化诱导期。
1.2.7 数据分析 所有的数据都是进行过三次重复实验,特定数据使用SPSS软件程序进行了统计分析,通过方差分析和多组样本间差异显著性分析。p<0.05时,该组数据被认为具有显著性差异。
2 结果与讨论
2.1 L-抗坏血酸癸酸酯的合成及分离纯化
2.1.1 溶剂对产率的影响 溶剂对脂肪酶催化合成的效率有很大影响,原因之一在于溶剂的极性是否合适。溶剂的极性会直接影响酶的活性和稳定性,溶剂的极性过大会使酶的水化层逐渐被破坏,导致酶的失活。选择合适的溶剂也需考虑反应物和产物在溶剂中的溶解性,L-抗坏血酸分子具有一定极性,癸酸分子为非极性,因此要选择一种具有合适极性的溶剂可以同时溶解L-抗坏血酸和癸酸,同时又不会造成酶的失活。且兼顾溶剂挥发性、沸点、成本、毒性等影响产品产业化的因素。
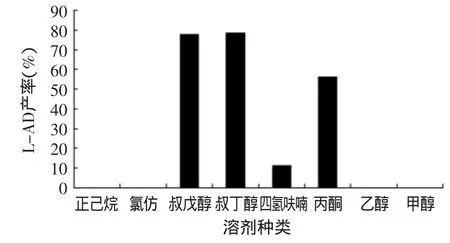
图1 溶剂对L-AD产率的影响Fig.1 Effect of solvent on yield of L-ascorbic decanoate
当固定化脂肪酶(Novozym®435)用量为L-抗坏血酸质量的20%,L-抗坏血酸初始浓度为0.2mmol/mL、底物癸酸与L-抗坏血酸的摩尔比为3∶1、4A分子筛用量为每10mL溶剂1g、水浴恒温55℃,超声波功率密度为0.40W/cm2,反应时间为4h时,分别使用正己烷、氯仿、叔戊醇、叔丁醇、四氢呋喃、丙酮、乙醇和甲醇作为溶剂进行实验,结果如图1所示。由图1可知,极性适中的叔戊醇、叔丁醇、四氢呋喃和丙酮都可以作为合成L-抗坏血酸癸酸酯的溶剂,叔戊醇与叔丁醇产率几乎相同,但叔丁醇的沸点比叔戊醇低很多,因此,减压蒸馏除去溶剂时相对容易且耗能较低,且叔丁醇市售价格较叔戊醇便宜很多,考虑产业化因素,选择叔丁醇作为合成L-抗坏血酸癸酸酯的溶剂。
2.1.2 反应时间对产率的影响 L-抗坏血酸在叔丁醇中的溶解度有限,随着反应进行,L-抗坏血酸在溶剂中逐渐溶解,且酯化反应需要一定的时间才达到平衡。当条件为固定化脂肪酶(Novozym®435)用量为L-抗坏血酸质量的20%,L-抗坏血酸初始浓度为0.2mmol/mL、底物癸酸与L-抗坏血酸的摩尔比为3∶1、4A分子筛用量为每10mL溶剂1g、水浴恒温55℃,超声波功率密度为0.40W/cm2,反应时间由1~6h时的产率变化如图2所示。由图2可知,反应时间对于L-抗坏血酸癸酸酯的产率有很大影响,在4h内随着时间的延长,产率逐渐升高;超过4h后,产率提升缓慢并逐步趋于平稳,反应基本处于平衡状态,再延长反应时间并不能够有效提高产率,因此,最佳反应时间选为4h。
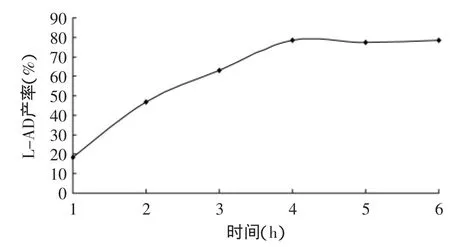
图2 时间对L-AD产率的影响Fig.2 Effect of reaction time on yield of L-ascorbic decanoate
2.1.3 温度对产率的影响 固定化脂肪酶催化的酯化反应需要在合适的温度下才能进行,其催化效率也与温度密切相关。当固定化脂肪酶(Novozym®435)用量为L-抗坏血酸质量的20%,L-抗坏血酸初始浓度为0.2mmol/mL、底物癸酸与L-抗坏血酸的摩尔比为3∶1、4A分子筛用量为每10mL溶剂1g、超声波功率密度为0.40W/cm2,反应时间为4h时,水浴温度由40℃升至65℃时的产率变化如图3所示。由图3可知,在40~55℃时,升温有利于酶促反应速度的升高,使得酯化反应的产率迅速提高,当温度为55℃时L-抗坏血酸癸酸酯产率达到最高。但当温度超过55℃时,随着温度的继续升高,L-抗坏血酸癸酸酯产率却有所下降。此外,产物的抗氧化基团连烯二醇结构在高温下易被破坏,如果过高温度也会降低产物的产率。因此,反应的最佳温度选为55℃。
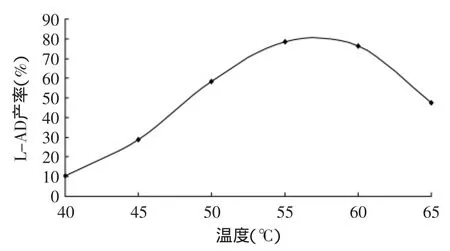
图3 温度对L-AD产率的影响Fig.3 Effect of temperature on yield of L-ascorbic decanoate
2.1.4 脂肪酸与L-抗坏血酸摩尔比对产率的影响 底物的摩尔比对L-抗坏血酸癸酸酯产率有直接影响。固定化脂肪酶(Novozym®435)催化酯化反应是L-抗坏血酸和癸酸反应生成L-抗坏血酸癸酸酯和水的可逆反应,为了使其中一种底物反应转化率提高,即平衡右移,可以使另一底物过量。在本反应中,L-抗坏血酸在溶剂叔丁醇中溶解度较低,溶解于溶剂中的L-抗坏血酸不断与癸酸反应,同时未溶解的L-抗坏血酸不断溶解补充,所以在反应过程中其浓度基本无变化。因此,使在叔丁醇中的溶解度远大于L-抗坏血酸溶解度的癸酸过量,可以提高L-抗坏血酸的转化率。当条件为固定化脂肪酶(Novozym®435)0.35g,L-抗坏血酸10mmol,4A分子筛5g,叔丁醇50mL,水浴恒温55℃,超声波功率密度为0.40W/cm2,反应时间为4h,癸酸物质的量由10~50mmol时产率的变化如图4所示。由图4可知,当癸酸与L-抗坏血酸的摩尔比从1∶1上升至3∶1时,L-抗坏血酸的转化率明显提高,继续增大癸酸的浓度,L-抗坏血酸酯的产率不再继续上升。因此,反应的底物癸酸和L-抗坏血酸的最佳摩尔比选为3∶1。
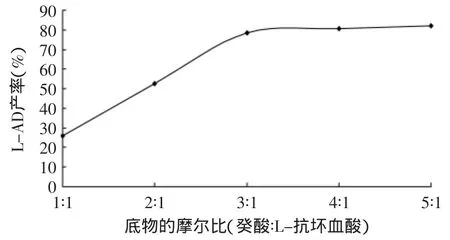
图4 底物的摩尔比对L-AD产率的影响Fig.4 Effect of substrate molar ratio on yield of L-ascorbic decanoate
2.1.5 超声波功率密度对产率的影响 如上文所述,超声波产生的作用会促进L-抗坏血酸的溶解和促进底物浓度均匀,进而促进L-抗坏血酸癸酸酯产率的提高和反应时间的减少。当固定化脂肪酶(Novozym®435)用量为L-抗坏血酸质量的20%、L-抗坏血酸初始浓度为0.2mmol/mL、底物癸酸与L-抗坏血酸的摩尔比为3∶1、4A分子筛用量为每10mL溶剂1g、水浴恒温55℃,反应时间为4h时,超声波功率密度由0.00~0.40W/cm2时产率的变化如图5所示。由图5可知,酶催化效率受到底物扩散速度的影响,局部浓度不均匀会导致产率低,超声波的功率密度影响了底物扩散的速度。超声波的工作频率固定为40k Hz,当功率密度小于0.16W/cm2时产率很低,当超声波的功率密度继续提高时,产率明显提高,当达到处理机最大功率密度0.40W/cm2时,产率达到78.48%。最佳功率密度定为0.40W/cm2。

图5 超声波的功率密度对L-AD产率的影响Fig.5 Effect of ultrasonic power density on yield of L-ascorbic decanoate
2.1.6 固定化脂肪酶使用次数对产率的影响 工业化生产需要控制成本,本实验中酶的价格相对于其他原料较高,为了降低成本,固定化酶需要进行重复使用,本实验考察了固定化酶在功率密度为0.40W/cm2、工作频率为40k Hz时重复使用8次的效果。当固定化脂肪酶(Novozym®435)用量为L-抗坏血酸质量的20%、L-抗坏血酸初始浓度为0.2mmol/mL、底物癸酸与L-抗坏血酸的摩尔比为3∶1、4A分子筛用量为每10mL溶剂1g、恒温55℃,超声波功率密度为0.40W/cm2,反应时间为4h,使用次数与产率的关系如图6所示。由图6可知,前4批次产率都在60%以上,最高产率为首次使用时的产率78.48%,后4批次产率明显降低到40%以下,可能是脂肪酶的在多批次合成之后出现了钝化,也可能是固定化脂肪酶酶受到超声波的空化作用太强烈使得一部分固定化酶的结构出现变形甚至破碎、脱落。因此,固定化脂肪酶的合适使用次数为4次。
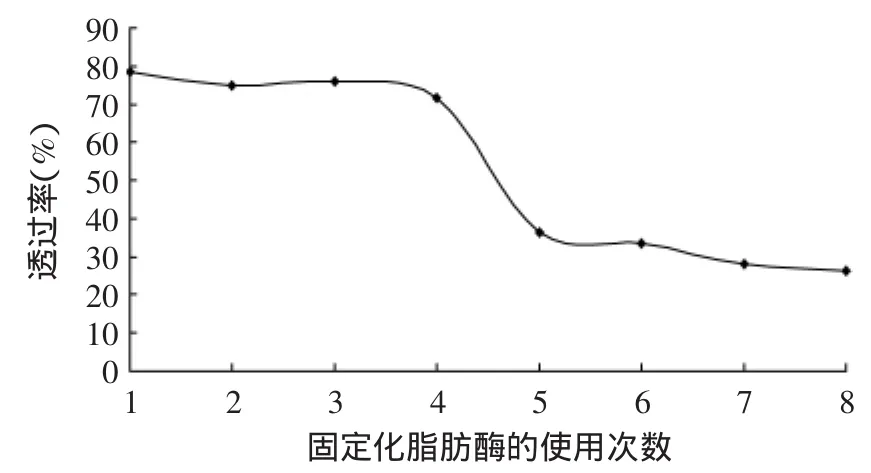
图6 固定化酶的使用次数对L-AD产率的影响Fig.6 Effect of the immobilized lipase reused times on yield of L-ascorbic decanoate
2.2 产物的鉴定
2.2.1 产物的纯度测定 由超声波场中固定化脂肪酶催化合成处的粗产物,分离提纯后得到的为白色有光泽的针状晶体,测得熔点为94.1~94.9℃,用国标GB16314-1996的碘量法[8]测定产物的纯度为98.6%。
2.2.2 产物的红外光谱检测 从红外光谱图(图7)中可以看出3390cm-1处出现-OH的吸收峰,在2919cm-1出现了CH2的C-H伸缩振动吸收峰,在1730cm-1出现了羧酸酯基的伸缩振动吸收峰,在1654cm-1出现了L-抗坏血酸的C=C的吸收峰,指纹区的吸收峰(1290、1144、723cm-1)进一步提供了证明,符合L-抗坏血酸癸酸酯的结构特征。
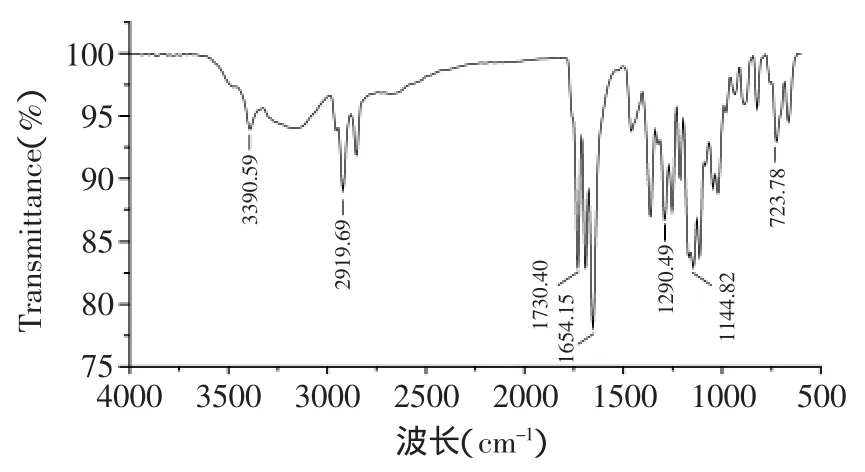
图7 L-抗坏血酸癸酸酯的红外光谱图Fig.7 Infrared spectrogram of L-ascorbic decanoate
2.2.2 产物的质谱检测 质谱图(图8)中的分子离子峰329.6(M-1)和660.1(2M-1)也证实了所得产物为L-抗坏血酸癸酸酯。
2.3 L-抗坏血酸癸酸酯的抗氧化性测定
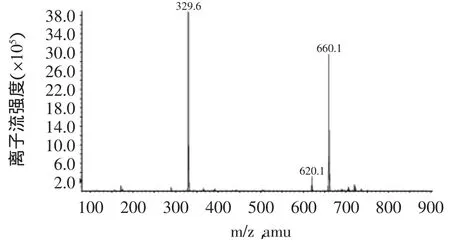
图8 L-抗坏血酸癸酸酯的质谱图Fig.8 Mass spectrogram of L-ascorbic decanoate
2.3.1 L-抗坏血酸癸酸酯对羟自由基清除能力的测定 采用邻二氮菲Fe2+氧化法测定L-抗坏血酸癸酸酯对羟自由基的清除能力,原理是邻二氮菲与Fe2+能够生成稳定的橙红色络合物,此络合物在510nm波长处有最大吸收,反应体系中定量加入Fe+2和H2O2,通过Fenton反应产生羟基自由基,自由基和H2O2把一部分Fe2+氧化为Fe3+,使橙红色络合物减少,加入抗氧化剂可与体系中的自由基和氧化剂反应,抑制Fe2+的减少,通过测定吸光度的变化以评价抗氧化剂清除羟基自由基能力的高低。

图9 L-抗坏血酸癸酸酯对羟自由基的清除能力的测定Fig.9 Hydroxyl radical clearing capacity of L-ascorbic decanoate
由图9可知,在一定质量浓度范围内,各抗氧化剂对羟自由基的清除能力都随着浓度的增加而增强,因为在极性较强的溶剂中L-抗坏血酸溶解度大,且相同质量浓度试样中有抗氧化活性的连烯二醇结构所占比重相对较高。此法测定结果为L-抗坏血酸的清除羟自由基的能力较强,L-抗坏血酸癸酸酯和L-抗坏血酸棕榈酸酯次之,TBHQ最弱,且各抗氧化剂清除能力与其质量浓度基本成量效关系。
2.3.2 L-抗坏血酸癸酸酯对DPPH自由基清除能力的测定 DPPH自由基分析法被广泛用于抗氧化性的测定。此法是根据DPPH自由基有单电子,在517nm处有一强吸收,其醇溶液呈紫色的特性。当有自由基清除剂存在时,由于与其单电子配对而使其吸收逐渐消失,其褪色程度与其接受的电子数量成定量关系,因而可用分光光度计进行快速的定量分析。
由图10可知,各试样均对DPPH自由基有清除能力,清除率随试样浓度的增大而增强。在相同的质量浓度下,TBHQ对DPPH自由基清除能力最强,抗坏血酸次之,L-抗坏血酸癸酸酯和L-抗坏血酸棕榈酸酯较弱,可能因相同质量试样中有抗氧化活性的连烯二醇结构所占比重相对较高所致。
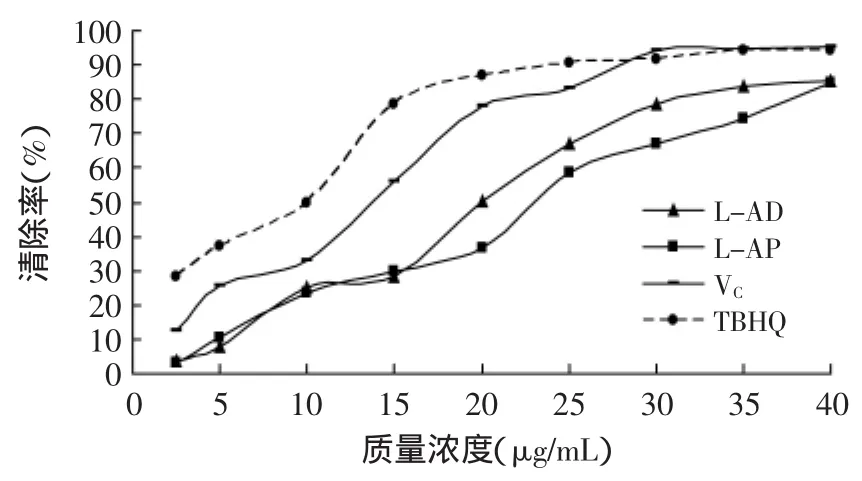
图10 L-抗坏血酸癸酸酯对DPPH·清除能力的测定Fig.10 DPPH radical clearing capacity of L-ascorbic decanoate
2.3.3 L-抗坏血酸癸酸酯的还原性测定 还原力是表示抗氧化物质提供电子能力的指标之一,可检验化合物是否为良好的电子供体。抗氧化物质提供的电子可以把Fe+3还原为Fe+2,引起体系溶液颜色的改变,测定吸光度就可以判断物质还原能力的强弱,还原力越强,抗氧化能力越强。
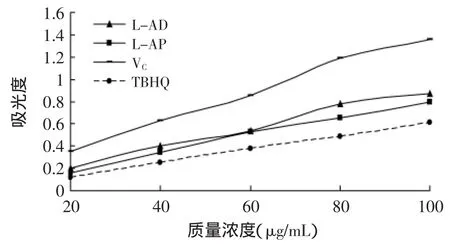
图11 L-抗坏血酸癸酸酯的还原性测定Fig.11 Reducing power of L-ascorbic decanoate
由图11可知,各试样都具有一定的还原力,各物质的还原力随着浓度的增加而增强。可能因单位质量试样中有抗氧化活性的连烯二醇结构所占比重相对较高,在相同的质量浓度下L-抗坏血酸癸酸酯和L-抗坏血酸棕榈酸酯弱于L-抗坏血酸,但强于TBHQ。
2.3.4 L-抗坏血酸癸酸酯在油脂中的抗氧化性能的测定 通过将一定量的油脂在反应器中加热并通入空气,促使油脂氧化产生氢过氧化物,氢过氧化物受热分解,产生短碳链挥发性物质如醇、醛、酸等,挥发性物质被吸收瓶中的去离子水吸收。通过测定吸收液的导电变化,来反应油脂的氧化稳定性,其表示方法为氧化诱导时间(用h表示)。诱导时间越长,抗氧化性越好,反之越差。
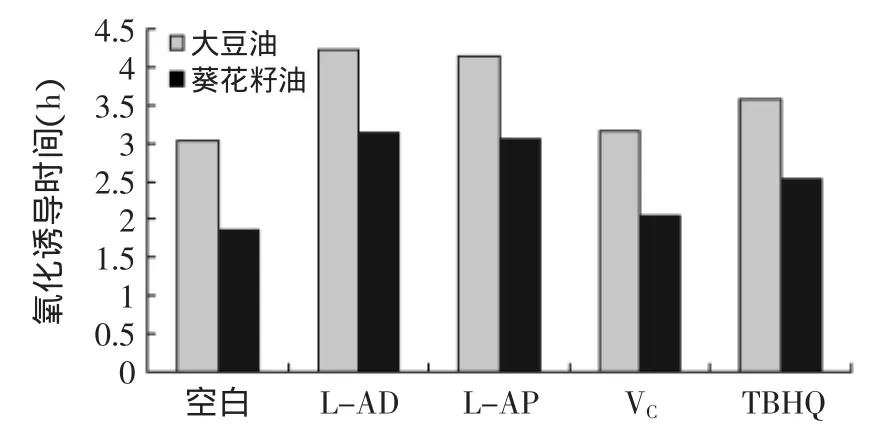
图12 L-抗坏血酸癸酸酯在油脂中的抗氧化性能测定Fig.12 Antioxidant activity in oils of L-ascorbic decanoate
由图12可知,各试样均对两种油脂的氧化诱导时间有延长作用,即有抗氧化作用。添加相同抗氧化剂试样的葵花籽油比大豆油的氧化诱导时间短,符合规律:即不饱和脂肪酸越多,氧化速度越快。在两种不同的油脂中,L-抗坏血酸癸酸酯的抗氧化能力稍强于L-抗坏血酸棕榈酸酯,且两者都强于TBHQ,L-抗坏血酸抗氧化性最弱。在相同质量浓度下,L-抗坏血酸虽然在清除羟自由基、DPPH自由基能力和还原力强于另外三种抗氧化剂,但是,L-抗坏血酸不能很好溶于油脂中,抗氧化的基团无法与油脂良好的接触碰撞,导致抗氧化能力低。L-抗坏血酸癸酸酯克服了L-抗坏血酸油溶性不好的缺点,并且具有良好的抗氧化性;由于L-抗坏血酸癸酸酯分子的侧链碳原子比L-抗坏血酸棕榈酸酯分子的侧链碳原子少了六个碳原子,所以相同质量浓度中L-抗坏血酸癸酸酯的连烯二醇结构的比重大于L-抗坏血酸棕榈酸酯,可能导致L-抗坏血酸癸酸酯的抗氧化能力稍大于L-抗坏血酸棕榈酸酯。
3 结论
超声波可以显著促进L-抗坏血酸的溶解,加速固定化脂肪酶在叔丁醇中催化合成L-抗坏血酸癸酸酯,提高产率,缩短反应平衡时间。同时适当过量的癸酸,合适的溶剂、反应时间、反应温度以及超声波功率密度可以使产率达到最高,最佳的条件为:酶用量为L-抗坏血酸质量的20%、L-抗坏血酸初始浓度为0.2mmol/mL、底物癸酸与L-抗坏血酸的摩尔比为3∶1、4A分子筛用量为每10mL溶剂1g、恒温55℃,超声波功率密度为0.40W/cm2,反应时间为4h,最高产率达到78.48%。L-抗坏血酸癸酸酯具有很强的清除羟自由基、DPPH自由基能力和还原力,在一定质量浓度下优于L-抗坏血酸棕榈酸酯,且前两个指标优于TBHQ;并且克服了L-抗坏血酸油溶性不好的缺点,添加入油脂后的抗氧化作用明显。因此,L-抗坏血酸癸酸酯是一种有潜力的抗氧化剂,有广泛的应用价值。
[1]李炎.食品添加剂制备工艺[M].广州:广东科技出版社,2001:163-164.
[2]Wen B,Eli W,Xue Q,et al.Ultrasound accelerated esterification of palmitic acid with vitamin C[J].Ultrasonics Sonochemistry,2007(14):213-218.
[3]Chang SW,Yang CJ,Chen FY,et al.Optimized synthesis of lipase-catalyzed l-ascorbyl laurate by Novozym®435[J].Journal of Molecular Catalysis B:Enzymatic,2009,56:7-12.
[4]姜新慧,晏日安,曾永青.非水相中脂肪酶催化合成L-抗坏血酸棕榈酸酯[J].食品科技,2011,35(5):258-261.
[5]Burham H,Rasheed RAGA,Noor NM,et al.Enzymatic synthesis of palm-based ascorbyl esters[J].Journal of Molecular Catalysis B:Enzymatic,2009,58:153-157.
[6]Lerin LA,Feiten MC,Richetti A,et al.Enzymatic synthesis of ascorbyl palmitate in ultrasound-assisted system:Process optimization and kinetic evaluation[J].Ultrasonics Sonochemistry,2011(18):988-996.
[7]Humeau C,Girardin M,Rovel B,et al.Effect of the thermodynamic water activity and the reaction medium hydrophobicity on the enzymatic synthesis of ascorbyl palmitate[J].Journal of Biotechnology,1998,63:1-8.
[8]中国国家标准化管理委员会.GB16314-1996,食品添加剂L-抗坏血酸棕榈酸酯[S].北京:中国国家标准化管理委员会,1996.
[9]李晓霞,晏日安,段翰英.白皮杉醇的合成及抗氧化活性研究[J].食品与发酵工业,2010,37(4):78-81.
[10]莫正昌,邓靖,汲广全,等.鹿蹄草提取物体外抗氧化活性评价[J].食品科学,2010,31(3):19-21.
[11]刘杰超,王思新,焦中高,等.苹果多酚提取物抗氧化活性的体外实验[J].果树学报,2005,22(2):106-110.
[12]杨敏,周瑞宝,宋伟.不同大豆品种提取油脂氧化稳定性研究[J].粮食与油脂,2007(11):21-23.
