种植体周围龈沟液中白介素-1β与牙周指数的相关性研究
2013-09-01孙鸿义戴燕平巩玉花
孙鸿义 戴燕平 巩玉花
1.济南市第五人民医院口腔科,山东济南 250022;2.滨州医学院口腔学院,山东滨州 256603
牙周病源于齿龈下特异微生物与宿主的相互作用,两者间的相互作用可导致炎症介质的释放从而造成组织破坏。宿主对龈下牙菌斑的免疫应答受一些细胞因子的调控,包括白介素(IL)-1β,IL-1α和肿瘤坏死因子α(TNFα)。IL-1β能够刺激骨质吸收和抑制骨形成,还可以促进前列腺素和蛋白酶的合成。IL-1β与其他炎症介质协同作用还可以调节或放大牙周组织和口腔种植体周围组织中的炎症反应[1],龈沟液(gingival crevicular fluid,GCF)和牙龈中高水平的IL-1β与慢性牙周炎有明显关联[2],所以不少研究[3]据此尝试抑制IL-1β来减轻慢性牙周炎患者的口腔组织破坏。近年来随着口腔种植技术逐渐普遍,已有学者注意到种植体周围龈沟液(peri-implant crevicular fluid,PICF)中也会出现IL-1β水平的增高,且这种高水平的IL-1β与种植体周围炎有关[4]。本研究将采用左右半口自身对照,探讨种植体周围龈沟液中IL-1β与牙周指数的相关性,同时种植体周围龈沟液(PICF)和健侧齿龈沟液(GCF)中IL-1β的情况也一并比较分析。
1 资料与方法
1.1 一般资料
选取2011年6月~2013年6月来我院接受人工牙种植的缺牙患者。入选标准为接受骨性结合人工牙植入,身体健康,没有吸烟史,未曾服用有可能影响种植体周围组织、牙周组织微生态的药物。总共有34例患者入选,男6例,年龄(51.5±10.3)岁;女28例,年龄(51.7±9.2)岁。患者缺失牙原因:龋病拔除14例,外伤脱落5例,根尖病拔除4例,牙周病脱落3例,其他原因8例。患者入选时机为种植体负重后(35.8±8.3)个月。全部患者共计有43颗ITI种植牙组成种植体组,其中上颌前牙区11枚,前磨牙区6枚,磨牙区7枚,下颌前牙区4枚,前磨牙区6枚,磨牙区9枚。根据左右半口对照原则取每颗种植牙对侧的健侧牙齿作为对照,组成对照组,共43颗。所有患者均签署知情同意书。
1.2 牙周指数
在收集龈沟液之前,先测定改良菌斑指数(modified plaque index,mPI)和改良牙龈指数(modified gingival index,mGI);探针平行于种植体或健侧牙齿的长轴,记录牙周袋探针深度(probing depth,PD);根据根尖周X线片测定牙槽骨吸收(alveolar bone loss,aBL)。以上数据由同一人收集。
1.3 PICF和GCF的采集与定量
种植体组:小心去除齿龈上临床可见的菌斑,务必避免触及齿龈。保持种植体或健侧齿干燥,小心使用棉球隔离之。为保证结果准确,使用吸唾管不断吸出唾液。将已用分析天平称量的2mm×8mm Whatman 3mm滤纸条插入龈沟内,直至有轻微抵抗感为止,留置滤纸条于沟内30s后取出。滤纸条取出后立即称重,后置入盛有400μL PBS溶液的Eppendorf管中。最后将Eppendorf管放入-70℃的冰箱保存。把Eppendorf管放置于离心机,管内注入20μL蒸馏水,以3000g离心15min。丢弃滤纸条,取出龈沟液(PICF)标本,在96孔微孔板上用牛血清白蛋白定量。对照组用同样的方法获取龈沟液(GCF)。
1.4 IL-1β测定
采用双抗体夹心ELISA法检测标本液中IL-1β水平。ELISA试剂盒购自Endogen,USA。严格按照厂家说明书进行操作。
1.5 统计学处理
IL-1β在PICF中和GCF中的差异采用配对t检验;种植体组和对照组牙周指数的差异采用配对t检验;采用直线相关法分析两组龈沟液中IL-1β含量与四个牙周指数(mPI,mGI,PD,aBL)的相关性,计算Pearson相关系数,从而得出t值,查表获知P值。使用SPSS18.0统计学软件进行处理,P<0.05差异有统计学意义。
2 结果
种植体组PICF中的IL-1β含量为76.39pg/μL,对照组GCF中的IL-1β含量为45.68pg/μL,经配对t检验两组P=0.001。种植体组的四项牙周指数平均计分明显高于对照组(P<0.01,表1)。直线相关显示,两组龈沟液中IL-1β含量都与牙周指数计分呈正相关(表2)。
表1 种植体组和对照组的牙周指数(± s)
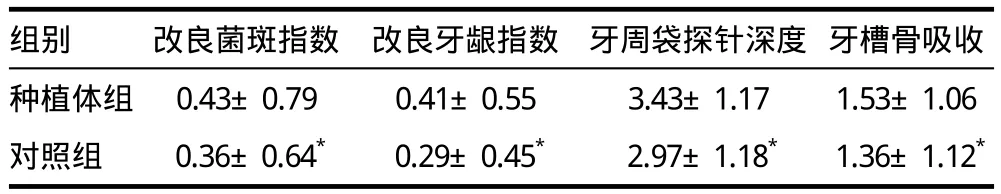
表1 种植体组和对照组的牙周指数(± s)
注:与种植体组比较:t=2.871、2.716、2.812、2.964;*P < 0.01
组别 改良菌斑指数 改良牙龈指数 牙周袋探针深度 牙槽骨吸收种植体组 0.43±0.79 0.41±0.55 3.43±1.17 1.53±1.06对照组 0.36±0.64* 0.29±0.45* 2.97±1.18* 1.36±1.12*
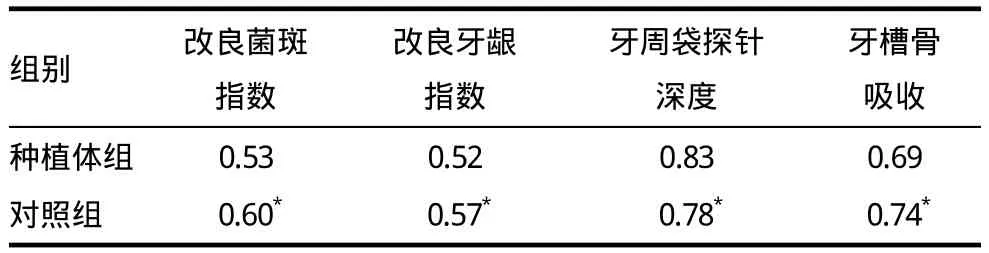
表2 两组龈沟液中IL-1β与牙周指数的相关关系(示Pearson系数)
3 讨论
IL-1β是牙周病免疫应答中重要的炎性因子,它在种植体周围炎中是否具有促进炎症的作用,目前尚没有定论。IL-1β由巨噬细胞产生后激活T细胞诱发免疫反应,在分子生物学层面,IL-1β不仅能够激活破骨细胞,而且种植体周围炎一旦发生IL-1β浓度常常显著提升[5]。另有临床研究[4]证实某些患者接受口腔种植后发生种植体周围炎,他们的龈沟液中IL-1β浓度比正常人显著增高。Takashiba等[3]曾经通过实验证实IL-1β与种植体周围骨组织的吸收呈相关性,可作为检测种植体周围炎边缘骨吸收的敏感指标,而Sakai等[6]则更是提出IL-1β有评价种植体周围炎症程度的潜在价值。
本研究证实PICF和GCF中IL-1β的含量确有明显差异以PICF中为高,这一点与前人的报道是一致的。造成这种差异的原因可能是种植体或健康牙齿周围组织的生物学特点不一。本研究还对PICF中IL-1β的含量与牙周指数的相关性进行探讨,统计学结果表明IL-1β与菌斑指数、牙龈指数、牙周袋探针深度、牙槽骨吸收有正相关关系,与Ata-Ali等[7]的研究结论相一致。而且,我们的课题组还发现,即使是健康牙齿中的IL-1β水平也与牙周指数呈正相关。虽然种植体组比对照组的龈沟液IL-1β水平高,但两组的IL-1β都与牙周指数呈正相关,因此这一点提示我们今后无论患者接受人工牙植入与否,若发现牙周指数有变化即可推断IL-1β的活动,应立即采取抑制IL-1β治疗以减轻患者的口腔组织破坏。Stashenko等[2]推测GCF中IL-1β的含量可能与慢性牙周炎有关。为此Ebersole等[8]专门选取健康人和慢性牙周病患者,用ELISA法测定GCF中IL-1β的含量同时对患者的牙周指数进行评分,最终他们得出结论GCF中IL-1β的含量与牙周炎有关联。不过,Teles等[9]对此持怀疑态度,他发现侵袭性牙周炎常常表现出超乎正常范围的IL-1β/IL-10比值,进而推断牙周炎的成因不应只是GCF中IL-1β的升高,而是诸多促进和抑制炎症反应的细胞因子失衡所致。本研究测定了健康牙齿GCF和种植体PICF中的IL-1β浓度及各自的牙周指数,只得出牙周组织病变的情况与龈沟液中IL-1β浓度正相关,但尚不能据此认为单纯IL-1β升高即会导致牙周病发生,今后仍需测定更多的炎症因子以全面分析。
另外,还有一些报道质疑PICF和GCF中IL-1β含量的差异。Adonogisaki等[10]和Murata等[11]在各自的实验室测量种植体组和对照组龈沟液时,都没有发现两组间IL-1β含量有明显差异;Melo等[1]对比健康牙齿组、健康种植体周围组、种植体周围炎组,龈沟液中未出现具备统计学差异的IL-1β含量值。我们认为这可能因为各实验室研究方法不尽相同,例如样品数量、种植体负重时机、取样时标本处于活跃期抑或是静息期等。
种植体周围龈沟液中的IL-1β比正常牙齿龈沟液中的IL-1β含量高,种植体和正常牙齿龈沟液中的IL-1β含量都与牙菌斑指数、牙龈指数、牙周袋探针深度、牙槽骨吸收呈正相关。IL-1β含量高低有可能作为牙周组织或种植体周围组织病变与否的生物学标志物,但尚存在争议。今后仍需研究更多的炎症因子与种植体周围组织病变的关系。
[1] Melo RF,Lopes BM,Shibli JA,et al.Interleukin-1β and interleukin-6 expression and gene polymorphisms in subjects with peri-implant disease[J].Clin Implant Dent Relat Res,2012,14(6):905-914.
[2] Stashenko P,Van Dyke T,Tully P,et al.Inflammation and genetic risk indicators for early periodontitis in adults[J].J Periodontol,2011,82(4):588-596.
[3] Takashiba S,Naruishi K,Murayama Y.Perspective of cytokine regulation for periodontal treatment:fibra BLast biology[J].J Periodontol,2003,74(1):103-110.
[4] Hall J,Britse AO,Jemt T,et al.A controlled clinical exploratory study on genetic markers for peri-implantitis[J].Eur J Oral Implantol,2011,4(4):371-382.
[5] 刘璐,张巧红,朱洪光,等.白介素-1β与种植体周围炎的相关性实验研究[J].中国口腔种植学杂志,2013,18(1):15-17.
[6] Sakai A,Ohshima M,Sugano N,et al.Profiling the cytokines in gingival crevicular fluid using a cytokine antibody array[J].J Periodontol,2006,77(5):856-864.
[7] Ata-Ali J,Flichy-Fernandez AJ,Ata-Ali F,et al.Clinical, microbiologic,and host response characteristics in patients with peri-implant mucositis[J].Int J Oral Maxillofac Implants,2013,28(3):883-890.
[8] Ebersole JL,Schuster JL,Stevens J,et al.Patterns of salivary analytes provide diagnostic capacity for distinguishing chronic adult periodontitis from health[J].J Clin Immunol,2013,33(1):271-279.
[9] Teles RP,Gursky LC,Faveri M,et al. Relationships between subgingival microbiota and GCF biomarkers in generalized aggressive periodontitis[J]. J Clin Periodontol,2010,37(4):313-323.
[10] Adonogianaki E,Mooney J,Wennström JL,et al. Acute-phase proteins and immunoglobulin G against Porphyromonas gingivalis in peri-implant crevicular fluid:a comparison with gingival crevicular fluid[J].Clin Oral Implants Res,1995,6(1):14-23.
[11] Murata M,Tatsumi J,Kato Y,et al.Osteocalcin, deoxypyridinoline and interleukin-1beta in peri-implant crevicular fluid of patients with periimplantitis[J].Clin Oral Implants Res,2002,13(6):637-643.
