经黏膜下隧道内镜技术与应用
2013-08-31施宏
施 宏
(福建省肿瘤医院内镜科,福州市 350014)
消化内镜微创技术的飞速发展,使其自身诊疗领域不断拓宽,内镜术野更从消化腔内穿越管壁延至浆膜腔内外,体现在传统内镜技术(内镜黏膜切除技术、内镜黏膜下剥离技术等)到经自然腔道内镜外科技术(natural transluminal endoscopic surgery,NOTES)的变革,由此模糊了消化内外科界限。而经黏膜下隧道内镜技术(submucosal tunneling endoscopic technique)的出现,正在加速地缩短了上述进程。
1 经黏膜下隧道内镜技术发展简史
经黏膜下隧道内镜技术,是指消化内镜在消化道黏膜作一约1.0~1.5 cm的横(纵)行切口后,镜身进入黏膜下,建立一条介于黏膜层与固有肌层之间的管状隧道,并借此通道进行黏膜下层侧、固有肌层侧、或浆/外膜侧直至消化道外的诊疗操作。该技术利用消化道天然解剖层次,错开隧道进出切口,将管壁分成黏膜层面与固有肌层面双重屏障,操作中只需保证其中一重屏障完整性,即可隔绝消化壁内外,不仅缩小了创面、降低切口闭合难度,同时也避免了消化道漏的风险。传统消化腔内内镜技术(包括内镜黏膜切除技术(endoscopic mucosal resection,EMR)、内镜黏膜下剥离技术(endoscopic submucosal dissection,ESD)、内镜黏膜下挖除技术(endoscopic submucosal excavation,ESE)等,一旦并发全层穿孔(即黏膜面缺损点与消化管壁垂线、浆/膜面缺损点与管壁垂线两线重合),闭合困难;而经黏膜下隧道内镜技术对黏膜面缺损、浆/外膜面缺损只闭其一,操作容易,真正杜绝了全层穿孔的可能。
2007年堪称隧道内镜技术诞生的纪元。基于各自目的,四组研究人员不谋而合地创立了经黏膜下内镜技术(submucosal endoscopy),方法虽略有差异,原理却殊途同归。①为建立NOTES安全消化道造口,Sumiyama等(美国)[1]在猪胃及食管成功实现黏膜安全瓣的黏膜下内镜造口技术(submucosal endoscopy with the mucosal safety valve flap,SEMF);而 Moyer等(美国)[2]则采用自闭式经腔造口技术(self-approximating transluminal access technique,STAT)建立离体猪胃与食管的NOTES可靠造口模型。这两种造口技术,创新性地克服了既往直接全层切开管壁可能损伤周围脏器、难以全层闭合造口、术后消化道漏继发感染的缺陷,随后该方法在NOTES研究中得以推广。②其次,为实现食管长段环周黏膜病变的整块切除(en bloc circularmucosectomy),von Delius等(德国)[3]创建了食管黏膜管状剥离的黏膜下内镜技术,即先于病灶上下缘环行切开,再从上缘切口黏膜下自上而下剥离建立黏膜下隧道,直至内镜到达下缘切口,最后沿隧道两侧环行剥离直至完整分离食管病灶。③为治疗贲门失弛缓症,Pasricha等(美国)[4]首先报道了经口内镜黏膜下食管环行肌切开的动物模型,并在2010年由Inoue等(日本)[5]最先成功用于临床,即经口内镜下食管环行肌切开术(peroral endoscopic myotomy,POEM):先于GEJ以上约13 cm处纵行切开黏膜,采用ESD专用器械(IT刀、Hook刀、Flex刀、三角刀等)切割黏膜下层疏松结缔组织建立黏膜下隧道,从距胃食管交界(gastroesophageal junction,GEJ)上方约7 cm处纵行切开环行肌层直至GEJ下方2 cm。
无论何种经黏膜下隧道内镜技术,关键在于隧道出入口的异位,即黏膜面切口与浆/外膜面切口彼此错开,恰似“Z”字走行,从而确保消化道内外的隔绝。隧道内镜技术操作步骤包括入口切开、隧道建立与隧道闭合,入口方式基本一致,黏膜下注射后横(纵)行直接切开黏膜,其后程序方法各异,互有利弊(见表1)。SEMF与STAT建立黏膜下隧道,均为钝性分离黏膜下层,存在出血风险;而ESD法则可随时电凝血管,预防出血,内镜头端透明帽钝性分离结合专用器械电切(凝)剥离可更加快隧道延伸速度,故应用最广。至于隧道关闭,分歧较多。Akagi等[10]认为经胃NOTES如未损伤黏膜,可不夹闭入口;Yoshizumi等[11]推荐纤维蛋白胶封堵隧道入口,因其操作时间远短于钛夹钳闭;Turner等[12]的一项随机对照动物实验发现,食管覆膜支架封闭隧道入口反而影响黏膜愈合。由于封闭隧道入口易于封闭出口,各研究对于出口处理多行旷置任其自愈。Gopal J等[9]设计了地毯翻卷式(Carpet roll technique)与帘垂覆盖式(drape technique)两种技术,将去细胞猪真皮基质置入隧道并封堵出口,3周后即可成功植入胃壁。

表1 经黏膜下隧道内镜技术操作步骤
2 经黏膜下隧道内镜技术临床应用
必须指出,经黏膜下隧道内镜技术旨在方便后续内镜操作、预防穿孔,隧道建立只是过程,而非终点。联合相关内镜技术如黏膜切除、狭窄扩张、肌层切开、肿瘤剥除、NOTES等,经黏膜下隧道内镜技术才能彰显价值。
经黏膜下隧道内镜技术的不断完善并用于临床,得益于ESD相应附件的推陈出新。尽管隧道内镜技术尚未统一,诸多问题亟待解决(如隧道入口位置选择、隧道长度确立、适应证、禁忌证的制定),却不妨碍其在动物研究及临床实践中的屡有斩获(见表2)。目前,经黏膜下隧道内镜技术在食管病变治疗中日臻完善,其中经口内镜下环行肌切开术(POEM)治疗食管贲门失弛缓症、经黏膜下隧道内镜切除术(submucosal tunneling endoscopic resection,STER)[14]切除上消化道固有肌层来源肿瘤、食管经黏膜下ESD[3]整块切除长段环周食管早癌(癌前病变)的临床应用最广。POEM[4]、食管环周ESD[3]详见前述。STER系由上海中山医院于2011年创立并命名,步骤如下:①肿瘤口侧约5 cm处切开黏膜;②胃镜进入黏膜下建立隧道直至暴露肿瘤;③ESD专用器械沿瘤体外膜剥离直至取出瘤体;④钛夹封闭隧道入口。此外,经黏膜下隧道内镜技术在消化道其他病变的诊治研究尚未成熟,多在动物实验或个例报道阶段。
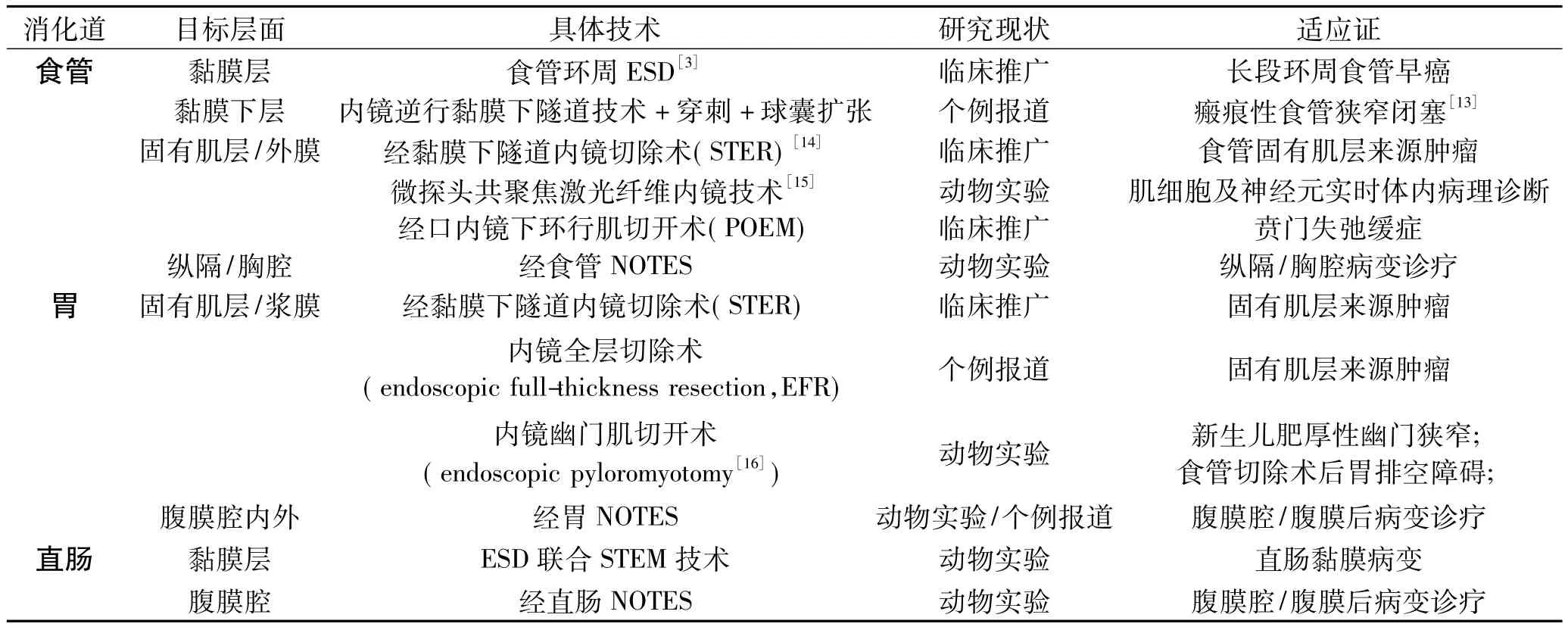
表2 经黏膜下隧道内镜技术应用现状
综上所述,经黏膜下隧道内镜技术的创建至今不足十年,但早已渗入内镜诊疗的各个领域,足证其前景广阔。多种技术的彼此承接、互为补充,将使消化内镜技术日趋成熟,不断地造福人类。
[1] Sumiyama K,Gostout CJ,Rajan E,et al.Transesophageal mediastinoscopy by submucosal endoscopy with mucosal flap safety valve technique[J].Gastrointest Endosc,2007,65(4):679-683.
[2] Moyer MT,Pauli EM,Haluck RS,etal.A self-approximating transluminal access technique for potential use in NOTES:an ex vivo porcinemodel(with video)[J].Gastrointest Endosc,2007,66(5):974 -978.
[3] von Delius S,Feussner H,Henke J,et al.Submucosal endoscopy:a novel approach to en bloc endoscopic mucosal resection(with videos) [J].Gastrointest Endosc,2007,66(4):753-756.
[4] Pasricha PJ,Hawari R,Ahmed I,et al.Submucosal endoscopic esophagealmyotomy:a novel experimental approach for the treatment of achalasia[J].Endoscopy,2007,39(9):761-764.
[5] Inoue H,Minami H,Kobayashi Y,et al.Peroral endoscopic myotomy(POEM)for esophageal achalasia[J].Endoscopy,2010,42(4):265 -271.Epub 2010 Mar 30.
[6] Gostout CJ,Knipschield MA.Submucosal endoscopy with mucosal resection:a hybrid endoscopic submucosal dissection in the porcine rectum and distal colon[J].Gastrointest Endosc,2012,76(4):829 -834.
[7] Turner BG,Kim MC,Gee DW,et al.A prospective,randomized trial of esophageal submucosal tunnel closure with a stent versus no closure to secure a transesophageal natural orifice transluminal endoscopic surgery access site[J].Gastrointest Endosc,2011,73(4):785 -790.
[8] Yoshizumi F,Yasuda K,Suzuki K,et al.Feasibility of fibrin glue versus endoclips to close the transgastric peritoneal access site in NOTES in a survival porcine study[J].Asian J Endosc Surg,2011,4(2):73 -77.
[9] Gopal J,Pauli EM,Haluck RS,et al.Intramural acellular porcine dermalmatrix(APDM)-assisted gastrotomy closure for natural orifice transluminal endoscopic surgery(NOTES)[J].Surg Endosc,2012,26(8):2322 -2330.
[10] Akagi T,Yasuda K,Kono Y,etal.Safety and Efficacy of the submucosal tunnelwithoutmucosal closure for the transgastric approach in a Porcine survivalmodel[J].Surg Innov,2012,19(4):415 -420.
[11] Yoshizumi F,Yasuda K,Suzuki K,et al.Feasibility of fibrin glue versus endoclips to close the transgastric peritoneal access site in NOTES in a survival porcine study[J].Asian J Endosc Surg,2011,4(2):73 -77.
[12] Turner BG,Kim MC,Gee DW,etal.A prospective,randomized trial of esophageal submucosal tunnel closure with a stent versus no closure to secure a transesophageal natural orifice transluminal endoscopic surgery access site[J].Gastrointest Endosc,2011,73(4):785 -790.
[13] Babich JP,Diehl DL,Entrup MH.Retrograde submucosal tunneling technique formanagementof complete esophageal obstruction[J].Surg Laparosc Endosc Percutan Tech,2012,22(4):232 -235.
[14] Xu MD,Cai MY,Zhou PH,et al.Submucosal tunneling endoscopic resection:a new technique for treating upper GI submucosal tumors originating from the muscularis propria layer(with videos)[J].Gastrointest Endosc,2012,75(1):195-199.
[15] Ohya TR,Sumiyama K,Takahashi-Fujigasaki J,et al.In vivo histologic imaging of themuscularis propria andmyenteric neurons with probe-based confocal laser endomicroscopy in porcinemodels(with videos)[J].Gastrointest Endosc,2012,75(2):405 -410.
[16] KawaiM,Peretta S,Burckhardt O,et al.Endoscopic pyloromyotomy:a new concept of minimally invasive surgery for pyloric stenosis[J].Endoscopy,2012,44(2):169 -173.
