L-型钙电流在血管紧张素II诱导新生大鼠心肌细胞肥大中的作用*
2013-08-30闫秋丽余良主
闫秋丽,化 维,余良主
(1.北京市昌平区华一医院,北京 102208;2.湖北科技学院,咸宁 437100)
在压力负荷和神经体液刺激作用下,心肌细胞产生适应性肥大生长,以暂时性改善心脏功能。但这种心脏适应性肥厚能够使心血管发病率和死亡率增高,这主要与其引起的电生理重塑和心律失常有关[1]。心脏的电生理重塑通常表现为复极化过程延迟而致动作电位时程(action potential duration,APD)延长等。其机制涉及到多种离子通道的改变和内外向电流的平衡,包括L型Ca2+通道这种内向离子流的变化。
在压力负荷导致的心肌肥厚中有多种神经体液因素参与,其中血管紧张素II(Angiotensin II,Ang II)是重要的体液因子。研究发现,血管紧张素Ⅱ能调节心肌细胞中多种离子电流或通道的功能。Ang II调节各种跨膜离子流作用的存在,提示Ang II也可能促进了心肌电生理重构过程。事实上,Ang II被证实可增强培养心肌细胞缝隙连接蛋白connexin43的表达[2]。这种缝隙连接蛋白在心肌细胞间动作电位传导中起着关键作用。Ang II还可抑制心肌细胞Kv4.3通道蛋白的表达,减少心肌钾电流Ito;抑制心肌细胞Na+通道蛋白的表达,减少心肌Na+电流密度[3]。但是,在Ang II诱使心肌细胞肥大时,心肌细胞L-型钙通道的功能特征和分子表达水平又有何变化?这一问题目前并不清楚。
为了探索这一问题,本实验拟在培养的新生大鼠心肌细胞上,观察Ang II所诱导肥大心肌细胞中L型Ca2+通道的功能特征和分子表达水平的变化,以便为阐明病理情况下心肌电生理重构机制提供实验依据。
1 材料与方法
1.1 材料
1.1.1 仪器 YS-1300-V超净工作台、DGG-9249电热恒温干燥箱、CO2恒温培养箱、Olympus IX71倒置显微镜、膜片钳放大器、微电极拉制仪、低温高速台式离心机、PCR扩增仪、电泳槽和电泳仪及其他,包括 :纯水机 、冰箱 、Sartorius BSII110S 、精密天平 、压力蒸汽灭菌器、电热恒温水浴箱、三维操纵器、紫外分光光度仪、各种规格移液器、磁力搅拌器、pH测定计等。
1.1.2 药品与试剂 DMEM培养基、胎牛血清、胰蛋白酶、D-Hanks液、溴脱氧尿苷(BRDU)、多聚赖氨酸。
1.1.3 实验用液的配制 配制用于调定溶液pH值的HCl、NaOH 、KOH:HCl(1 mol/L):36%HCl 4.31 ml,加纯水至50 ml;NaOH(2 mmol/L):NaOH 4 g,加纯水至50 ml,塑料器皿盛放;KOH(2 mmol/L):KOH 5.61 g,加纯水至50 ml,塑料器皿盛放。DMEM培养基:将一瓶DMEM培养基干粉溶于950 ml三蒸水中,然后加入3.79NaHCO3,用1mol/L HCl和1 mol/L NaOH调节pH值至7.2,定容至1 L。种植培养液:在无菌条件下,将配好的DMEM培养基与胎牛血清以9∶1比例混合。溴脱氧尿苷(BRDU)的配制:把它配成终浓度为1 mmol/L,然后l ml培养液中加入5 μ l。EDTA 的配制:精确称取EDTA 0.01 g,溶于100 ml D-Hanks液中,高压灭菌,4℃储存。胰蛋白酶:精确称取胰蛋白酶0.25 g,溶于100 ml D-Hanks液中,过滤分装,-20℃储存。标准台氏液(mmol/L):NaCl 140,NaOH 2.3,KCl 5.4,CaCl21.8,MgCl21,HEPES 10,Glucose 10,pH 7.4(adjustedwith NaOH)。记录L-型Ca2+电流时细胞外液(mmol/L):TEA Cl 135,MgCl21,CaCl210,HEPES 10,glucose 10,4-aminopyridine 3,CsCl 20,tetrodotoxin 0.03,pH 7.4(adjusted with CsOH)。记录L-型Ca2+电流时电极内液(mmol/L):CsCl 10,Cs-aspartate 120,MgCl23,HEPES 10,EGTA 15,CaCl21.8,glucose 10,creatine phosphate 3.6,MgATP 5,Tris-GTP 0.2,pH 7.2。DEPC水:1 000 ml超纯水加1 ml DEPC。无RNA酶水:DEPC水(1∶1 000)室温静置12 h,20磅高压消毒15 min。扩增引物:根据Entrez Nucleotide database中大鼠L-型Ca2+通道α 1C亚单位的基因序列,应用Primer 5软件设计引物,由上海生工生物工程技术服务有限公司合成。
1.2 方法
1.2.1 动物 将健康体重250~300 g的SD大鼠雌、雄各一只,合笼喂养。待雌鼠怀孕后,将其从笼中取出,待产。分娩后新生1~2 d的健康SD大鼠仔鼠,用于实验。
1.2.2 新生大鼠心肌细胞分离、培养 取SD新生大鼠心室肌剪碎,0.1%胰蛋白酶反复消化,收集上清后转移到DMEM培养基中离心,弃上清取细胞沉淀,加入含15%新生牛血清(NBS)的DMEM培养基制备成细胞悬液,培养后纯化心肌细胞,以2×105cells/bottle的细胞密度接种培养瓶继续培养72 h开始实验。培养的前72 h加入0.1 mmol/L 5′-溴脱氧尿苷以抑制非心肌细胞增殖。
1.2.3 心肌细胞肥大的诱导 心肌细胞接种72 h后长成单层,换液时在培养基中加入Ang II至终浓度10-7mmol/L,之后每24 h换液并加药一次,连续作用3 d。设空白对照组细胞不加Ang II。
1.2.4 心肌细胞总蛋白含量测定 本实验参照南京建成生物工程公司考马斯亮蓝蛋白检测试剂盒说明测定心肌细胞蛋白质含量,根据各瓶细胞数,计算出每瓶细胞的总蛋白含量。蛋白含量(mg/m1)=(测定管OD值-空白管OD值)/标准管OD值-空白管OD值/(标准管浓度·稀释倍数)。
1.2.5 电生理研究 细胞置于倒置显微镜上的恒温灌流槽中,温度控制在22℃~24℃,先灌流标准台氏液,记录L-Ca2+电流时细胞外液成分,用CsOH调节pH至7.4。记录L-Ca2+电流时电极内液成分(mmol/L):用CsOH调节pH至7.4。在全细胞记录模式下,信号经Ag-AgCl电极引导,由Axon 700B膜片钳放大器放大,经模/数转换系统采集数据,并进行数据分析。于细胞破膜后5min开始记录ICa,L,使电极内液和细胞内液充分交换,减少了系统误差。为消除细胞间误差,电流值以电流密度(pA/pF)表示。以钳制电压为-50 mV,超级化-10 mV得到的细胞电容电流积分值,计算出细胞膜电容。细胞膜电容大小能反映细胞尺寸。
1.2.6 半定量RT-PCR 采用反转录-多聚酶链扩增反应法检测L-型Ca2+通道(α 1C亚单位)的mRNA表达量。通过总RNA的提取、RT(逆转录)、PCR(聚合酶链反应)过程,取逆转录 cDNA产物2 μ l,加L-型Ca2+通道α 1C亚单位上下游引物各 2 μ l及内参GAPDH上下游引物各 2 μ l,2×PCR Master Mix(Fermentas)12.5 μ l,灭菌水 2.5 μ l,总体积为 20 μ l。 扩增反应条件为:94℃,30 s;58℃,40 s;72℃,1 min;30个循环;完成全部循环后72℃10 min以达到充分延伸。取RT-PCR产物6 μ l进行2%琼脂糖凝胶平板电泳。将电泳条带图像摄入凝胶成像分析系统,保存为tiff格式图片,供分析。
1.3 数据分析
采用Origin 7.5 software和Clampfit 10.0 software软件分析电生理数据。电流强度的测定,以电流激活过程中刚出现时数值与电流达最大激活时数值之间的差值为准。电流密度大小即为电流强度与膜电容的比值(pA/pF)。所有数据均以均数±标准差(±s)表示。采用t检验和方差分析。
2 结果
2.1 各实验组心肌细胞总蛋白含量和膜电容值的比较
与正常对照组相比,Ang II组心肌细胞的总蛋白含量明显增高50%(P<0.01);应用Ang II 1型受体阻断剂Losartan明显使心肌细胞的总蛋白含量恢复至正常水平(表1)。与心肌细胞总蛋白含量改变一致,Ang II组心肌细胞的也要高于正常对照组(P<0.01);Losartan同样能使心肌细胞的膜电容值恢复正常。膜电容值的升高反映了心肌细胞尺寸的扩大。这些结果表明,Ang II诱导心肌细胞肥大模型建立成功了。
Tab.1 Total protein content andmembrane capacitance of experimental group in cardiomyocytes(±s)

Tab.1 Total protein content andmembrane capacitance of experimental group in cardiomyocytes(±s)
AngⅡ:AngiotensinⅡ**P<0.01 vs normal group;##P<0.01 vs AngⅡgroup
Group n Total protein content(g/109cells)Membrane capacitance(pF)Normal 8 1.78±0.26 88±9 AngⅡ 9 2.67±0.32** 129±12**Losartan 7 1.88±0.28## 91±11##
2.2 Ang II诱导的肥大心肌细胞中L-型Ca2+电流密度的改变
在形成全细胞封接状态后,将细胞钳制在-50 mV,给予指令电压从-40 mV~+80 mV,波宽为300 ms的刺激,可记录到一系列的 ICa,L。当加入nifedipine(3 μ mol/L),再给予上述刺激后 ,可见该电流被迅速抑制,说明该电流为L-型Ca2+电流。图1是实验中记录的典型L-型Ca2+电流曲线。实验连续记录ICa,L15 min,未见明显的“run-dowm”现象。
如图2A所见,Ang II组心肌细胞的L-型Ca2+电流密度在-20~+40 mV范围内明显高于正常组。其中,0 mV处Ang II组L-型Ca2+电流密度(6.13 pA/pF)比正常组(4.03 pA/pF)增高52.2%(P<0.01)。但L-型Ca2+电流激活电位和翻转电位并没有改变。Losartan可以使大鼠心肌细胞L-型Ca2+电流密度恢复至正常组水平。
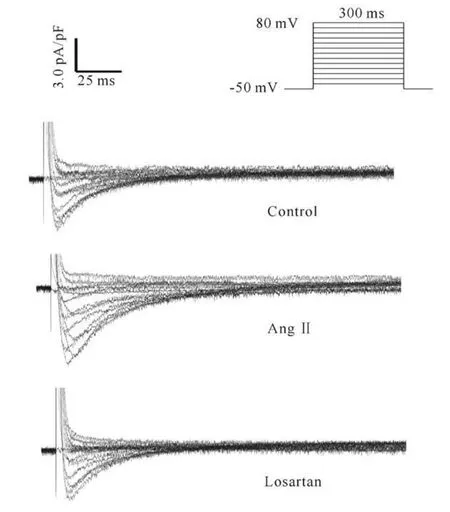
Fig.1 Typical curve of L-type Ca2+currents
2.3 Ang II诱导的肥大心肌细胞中L-型Ca2+通道动力学参数变化
稳态激活特征:记录ICa,L稳态激活曲线时刺激方案与记录I-V曲线的方案相同。稳态激活曲线是将I-V曲线转换成膜电导后得到,用 Boltzmann方程:G/Gmax=1/{1+exp[(V-Va)/k]}进行拟合。其中,G是膜电压为V时的膜电导,Gmax为最大膜电导,Va为半数激活电压,k为斜率因子,G=I/(VErev),I为对应膜电压V时的峰电流,Erev为通过I-V曲线测得的反转电位。
如同图 2B所显示,正常组、Ang II组、Losartan组三组的ICa,L激活曲线特征没有明显不同。三组的半数激活电压Va分别为(-7.86±1.03)mV、(-8.15±1.21)mV、(-8.06±1.18)mV(P>0.05)。
稳态失活特征:记录ICa,L稳态失活曲线应用双脉冲刺激,钳制电压为-50 mV,条件脉冲从-60 mV开始,阶跃10 mV,时间3 000 ms;随后测试脉冲为10 mV,时间300 ms。稳态失活曲线是用Boltzmann方程:I/Imax=1/{1+exp[(V-Vi)/k]}进行拟合。其中,I为测试脉冲引出的峰电流,Imax为测试脉冲引出的最大峰电流,V为条件脉冲电压,Vi为半数失活电压,k为斜率因子。结果显示,正常组、Ang II组、Losartan组三组的失活曲线特征相近(图3)。三组的半数失活电压Vi分别为(-24.86±3.65)mV、(-25.55±4.01)mV 、(-24.31±3.87)mV(P>0.05)。

Fig.2 Activation and I-V curves of L-type Ca2+currents in cardiomyocytes of three groups
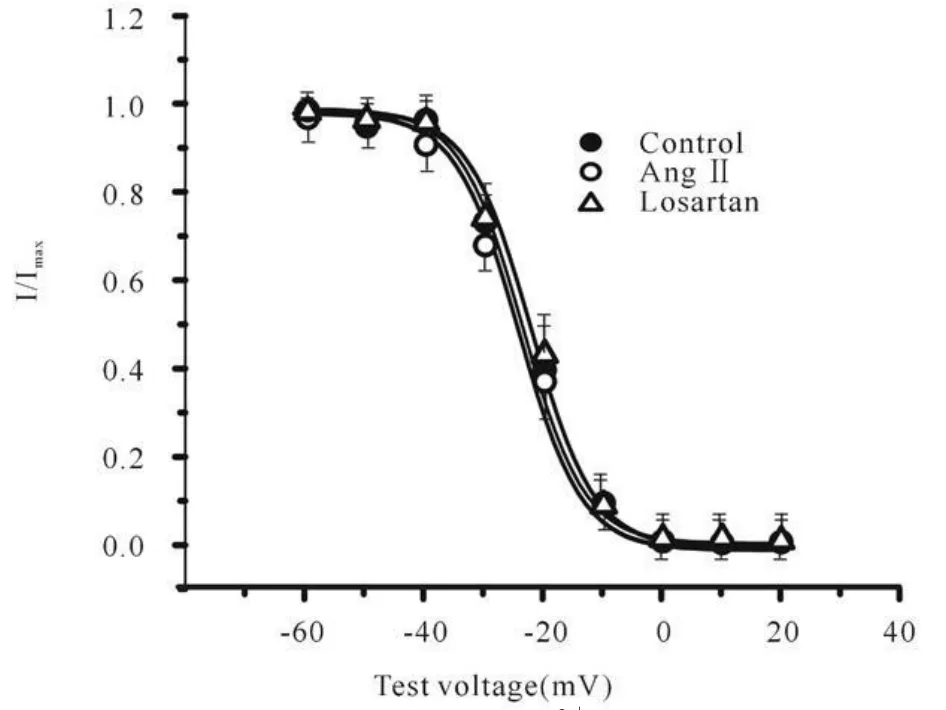
Fig.3 Inactivation curve of L-type Ca2+currentsin cardiocytes of three groups
失活后复活特征:记录ICa,L稳态失活后恢复曲线采用双脉冲刺激,钳制电压为-50 mV,给予+10 mV、时间为200 ms(P1)和200 ms(P2)的两个方波刺激,两刺激间隔时间为从50 ms开始,每次递增50 ms,直至750 ms。分别记录P1和P2对应的峰电流。计算复活电流指数(P2/P1)。以复活电流指数对两刺激间隔时程作复活曲线。并用单指数方程:P2/P1=A1 exp(-t/τ)+A0进行拟合。求出复活时间常数τ。结果显示,正常组、Ang II组、Losartan组三组的失活后恢复曲线特征相近(图4)。三组的复活时间常数分别为(115±13)ms、(120±25)ms、(118±24)ms(P>0.05)。
2.4 Ang II诱导的肥大心肌细胞中L-型Ca2+通道α 1C亚单位mRNA表达的改变
为了确认Ang II诱导的肥大心肌细胞中L-型Ca2+通道分子水平上的改变,我们采用RT-PCR检测了心肌细胞中L-型Ca2+通道α 1C亚单位的mRNA表达量。Ang II组心肌细胞中α 1C亚单位的mRNA表达量明显高于正常组图5A。为了进一步的实时定量检测α 1C亚单位的mRNA表达量,我们又做了Real-time PCR(实时定量PCR),定量检测了α 1C亚单位的表达量。实时定量PCR检测结果进一步证实,Ang II组心肌细胞中α 1C亚单位的mRNA表达明显增高,高于正常组56.0%(图5B)。
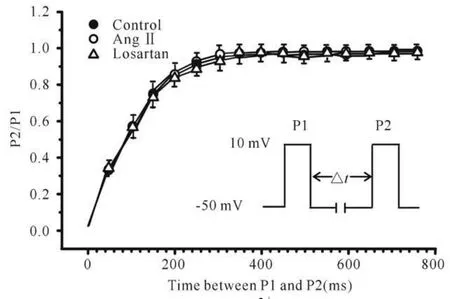
Fig.4 Recovery curve of L-type Ca2+currents in cardiocytes of three groups
3 讨论
3.1 Ang II诱导的肥大心肌细胞中L-型Ca2+通道的功能在分子水平表达上的改变
尽管目前已有一些实验证实,Ang II可以调节心肌细胞ICa,L电流[4,5]。但是,这些实验并没有探讨Ang II对L-型Ca2+通道表达的影响。当前研究的主要新发现是,Ang II在引起新生大鼠心肌肥大的同时,增加心肌细胞 ICa,L电流和L-型Ca2+通道α 1C亚单位mRNA表达。
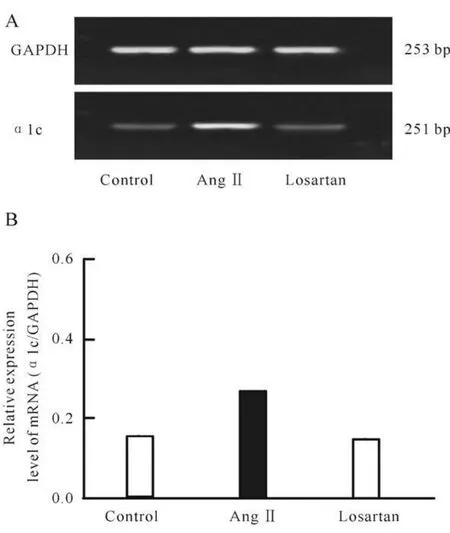
Fig.5 mR NA expression of L-type Ca2+channel α 1C subunits in cardiocytes of three groups
L-型Ca2+通道主要是由α亚单位和β亚单位构成。单独α亚单位表达即可形成功能性L-型Ca2+通道孔,是主要功能亚单位;β亚单位是调节性亚单位,它与α亚单位共表达,可以调节L-型Ca2+通道的功能特征。目前研究发现,心脏组织中并无其他α亚单位类型。心脏的β亚单位主要是β2亚单位。基于上述发现,本实验只检测了培养新生鼠心室肌细胞的L-型Ca2+通道α 1C亚单位的表达。
本实验研究中,Ang II对新生大鼠心肌细胞ICa,L电流的影响与其调节L-型Ca2+通道α 1C亚单位表达的作用相互一致。Ang II所诱导的ICa,L电流密度增加可能与其促进L-型Ca2+通道α 1C亚单位表达增加有关。另外,Ang II虽然增加了心肌细胞ICa,L电流密度,但对 L-型Ca2+通道的激活、失活、复活等通道门控动力学特征并无影响。因而,Ang II可能只是增加α 1C亚单位的表达量,而对心肌细胞L-型Ca2+通道的其它亚单位构成类型并没有影响。
在心肌细胞中,Ang II的作用受体至少有两种,即血管紧张素II 1型受体(angiotensin receptor type 1,AT1R)和血管紧张素II 2型受体(angiotensin receptor type 2,AT2R)。大部分Ang II的作用是由AT1R介导的。本研究发现,Ang II增加新生鼠心室肌细胞ICa,L电流密度和L-型Ca2+通道α 1C亚单位表达的作用也是由AT1R介导的。故应用AT1R拮抗剂losartan能抑制的这些作用。
3.2 Ang II增加 ICa,L电流密度和L-型Ca2+通道表达的可能意义
Ang II对ICa,L电流密度和L-型Ca2+通道表达的增强,可能增加心肌细胞动作电位时期跨细胞膜内流的 Ca2+量,而增加细胞内Ca2+负荷。这种Ca2+负荷加重(或称Ca2+超载)可以导致触发活动发生,引起心律失常[7]。这也许是血管紧张素转换酶抑制剂(angiotensin converting enzyme inhibitor,ACEI)和血管紧张素受体拮抗剂(angiotensin receptor antagonist,ARB)能够对室性心律失常具有一定防治作用的原因[7,8]。
[1]Koren M J,Devereux R B,Casale P N,et al.Relation of left ventricular mass and geometry to morbidity and mortality in uncomplicated essential hypertension[J].Ann InternMed,1991:114(5):345-352.
[2]Dodge S M,Beardslee M A,Darrow B J,et al.Effects of angiotensin II on expression of the gap junction channel protein connexin43 in neonatal rat ventricular myocytes[J].J Am Coll Cardiol,1998,32(3):800-807.
[3]Shang L L,Sanyal S,PfahnlA E,et al.NF-kappaB-dependent transcriptional regulation of the cardiac scn5a sodium channel by angiotensin II[J].Am J Physiol Cell Physiol,2008,294(1):C372-379.
[4]Bkaily G,Sculptoreanu A,Wang S,et al.Angiotensin II-induced increase of T-type Ca2+current and decrease of L-type Ca2+current in heart cells[J].Peptides,2005,26(8):1410-1417.
[5]Tristani-Firouzi M,Chen J,Mitcheson JS,et al.Molecular biology of K+channels and their role in cardiac arrhythmias[J].Am J Med,2001,110(1):50-59.
[6]Song L S,Guia A,Muth J N,et al.Ca(2+)signaling in cardiac myocytes overexpressing the alpha(1)subunit of L-type Ca(2+)channe[J].Circ Res,2002,90(2):174-181.
[7] Anvari A,Türel Z,Schmidt A,et al.Angiotensin-converting enzyme and angiotensin II receptor 1 polymorphism in coronary disease and malignant ventricular arrhythmias[J].Ardiovasc Res,1999,43(4):879-883.
[8]Hiura N,Wakatuki T,Yamamoto T,et al.Effects of angiotensin II type I receptor antagonist(candesartan)in preventing fatal ventricular arrhythmias in dogs during acute myocardial ischemia and reperfusion[J].J Cardiovasc Pharmacol,2001,38(5):729-736.
