重组免疫毒素GnRH-PTD-PE39KDEL 的构建及表达
2013-08-29扈进冬魏艳丽杨合同李纪顺张广志
扈进冬 ,魏艳丽 ,杨合同,2* ,李纪顺,张广志
(1.山东省科学院生物技术研究中心,山东省应用微生物重点实验室,山东 济南 250014;2.山东理工大学生命科学学院,山东 淄博 255049)
免疫毒素是由具有催化作用的毒素和有适当导向作用的细胞因子、短肽激素或者抗体构建的具有药理活性的生物制剂,既具有特异性的识别功能,又具有毒素的杀伤功能,主要应用于肿瘤的导向治疗。研究表明,免疫毒素在细胞培养水平有很好的选择性结合与杀伤肿瘤细胞的作用[1]。但目前在应用中,由于实体瘤的结构问题,不存在对靶组织的特异性杀伤作用较弱,尤其对大型实体瘤的浸润性较差,在体内的免疫反应严重等问题,所以如何增强靶向毒性蛋白中PE 部分的细胞毒性,研制出只杀死病理相关细胞的免疫毒素就成为关键[2-3]。蛋白质转导域(protein transduction domain,PTD)可以有效地将蛋白、多肽及核酸片段通过无受体介导、无耗能的方式,导入多种哺乳动物细胞,且在一定浓度范围内不会造成细胞损伤。PTD 是蛋白靶向入胞有力的生物学手段,为亲水性大分子药物跨越细胞生物膜、血脑屏障[4-5]以及治疗疾病提供了新的途径,在细胞生物学、基因治疗、药物体内转运、临床药效评价及细胞免疫学等研究领域均具有良好的应用前景[6]。而通过在免疫毒素中引入PTD 可以增强免疫毒素对肿瘤细胞的穿透性,增强其对实体瘤的浸润性,从而提高对实体瘤的杀伤作用[7]。
1 材料与方法
1.1 材料
1.1.1 质粒和菌株
大肠杆菌DH5α,BL21(DE3)plysS 为本实验室保存菌种,人乳腺癌MCF-7 细胞为本室保存。质粒pETTrx/GnRH-PE39KDEL,本室构建,其中克隆有GnRH-PE39KDEL 基因,pET-His 表达载体购自美国基因动力实验室有限公司深圳代表处,引物由生工生物工程(上海)有限公司合成。
1.1.2 试剂
Taq DNA 聚合酶、限制性核酸内切酶、T4DNA 连接酶及其配套缓冲溶液、DL2000 DNA Marker 均购自Takara 公司。IPTG、DNA Marker、琼脂糖、蛋白质中等分子量marker、氨苄青霉素购自生工生物工程(上海)有限公司。凝胶电泳回收试剂盒购自天根公司,凝血因子Xa 购自德国Merck 公司,HiTrap Benzamidine FF购自通用电气医疗集团,其他为国产分析纯试剂。MTT 和RPMI 1640 培养液购自北京鼎国昌盛生物技术有限责任公司。
1.2 方法
1.2.1 GnRH-PTD-PE39KDEL 基因的获得
设计3 条引物:MiddlePTDF1 5'TACAACGCTGGTCGTCGTGCTCGTCGTCGTCGTCG TCGTCACTTCCCGGA AGGTGG;MiddlePTDF2 5' CGGGATCCGTGGAAGGTCGCGAACACTGGTCTTACGGTCTGCGTCCGGGTTACAACG CTGGTCGTCG;GnRHR 5' CGGAATTCTCACAGTTCGTCTTTCGG。其中在MiddlePTDF1 中引入PTD 核酸序列,MiddlePTDF2 中引入Factor Xa 蛋白酶切割位点(斜体部分),MiddlePTDF2 和GnRHR 中分别引入BamH I和EcoR I 酶切位点(下划线标注),然后采用两轮PCR 从质粒pET-Trx/GnRH-PE39KDEL 中扩增获得GnRHPTD-PE39KDEL。PCR 反应体系为:10 ×Taq DNA buffer 5 μL,上下游引物20 μmol/L,dNTP 100 μmol/L,模板DNA 0.1 μg,Taq DNA 聚合酶3U,ddH2O 补足到50 μL。反应条件为:94℃预变性2 min;94℃变性30 s,52℃退火30 s,72℃延伸1.5 min,30 个循环;72℃延伸10 min。采用DNA 纯化试剂盒进行目的DNA片段的纯化。
1.2.2 GnRH-PTD-PE39KDEL 基因重组质粒的构建
提取质粒pET-His,用BamH I 和EcoR I 双酶切,回收2.8 kb 的线性质粒;PCR 扩增过的GnRH-PTDPE39KDEL 基因片段同样用BamH I 和EcoR I 双酶切,回收酶切产物片段,使用T4 DNA 连接酶进行连接,于16℃连接过夜,连接产物为pET-His-GnRH-PTD-PE39KDEL 重组质粒。直接转化E.coli DH5α 感受态细胞,涂布LB+Amp 平板,37℃倒置过夜培养。使用MiddlePTDF2 和GnRHR 为引物进行菌落PCR 初步鉴定转化子,并进行限制性内酶酶切重组质粒和测序鉴定(生工生物工程(上海)有限公司)。
1.2.3 GnRH-PTD-PE39KDEL 融合蛋白的表达筛选
取上述1.2.2 中构建的pET-His-GnRH-PTD-PE39KDEL 质粒1 μL,稀释10 倍后直接转化E.coli 表达菌株BL21(DE3)plysS 感受态细胞,在转化平板上挑取转化子若干,2 mL LB +Amp(胰蛋白胨10 g/L,酵母提取物5 g/L,氯化钠10 g/L,用NaOH 调节pH 值到7.0,含100 μg/mL Ampicillin)液体培养基37℃振荡过夜培养。次日,取20 μL 过夜培养液加入到2 mL YTA +Amp(胰蛋白胨16 g/L,酵母提取物10 g/L,氯化钠10 g/L,用NaOH 调节pH 值到7.0,含100 μg/mL Ampicillin)液体培养基中转培养,37℃振荡培养3 h,至OD600 在0.5~0.7 之间,然后加入IPTG 至终浓度为0.3 mmol/L,30℃振荡培养诱导表达3~8 h。诱导前,随机从一个样品中取出0.5 mL 菌液,电泳检测时作为诱导对照。诱导表达完后,各取0.5 mL 菌液(视表达细菌的量多少而变化,一般在0.2~0.5 mL 之间),5 000 r/min 离心5 min 收集细胞,包括未诱导的样品,重悬于100 μL 去离子水中,以此为电泳样品作质量分数为12.5%的SDS-PGAE。根据电泳结果,得到有表达的菌株。
1.2.4 GnRH-PTD-PE39KDEL 融合蛋白的大规模表达
挑取筛选获得的表达菌株单克隆在LB +Amp 液体培养基中37℃过夜振荡培养,次日,按照体积比1:100加入到100 mL YTA+Amp 培养基中转培养,37℃振荡培养3 h 后,加入IPTG 至终浓度为0.3 mmol/L,再30℃振荡诱导培养6 h。诱导培养完后,菌液5 000 r/min 离心10 min 收集细胞,细胞重悬于5 mL 预冷的1 ×PBS,加入50 μL 体积分数20%的Triton X-100,充分混匀后冰浴30 min,进行超声波破碎细胞。超声循环为:超声1 s;间隔1 s;全程40 s。重复4 次,每次间隙时将菌液在冰浴中混匀,避免局部温度太高,使蛋白质变性。最后,将破碎后的菌液10 000 r/min 离心15 min,收集上清液和沉淀,上清液和沉淀分别留样、备用。
1.2.5 GnRH-PTD-PE39KDEL 融合蛋白初纯品的制备
将破碎上清液加到Ni-NTA 层析柱中,流速控制在0.3 mL/min 左右,收集穿透部分,用于SDS/PAGE 分析蛋白质的结合情况。然后用5 倍Ni-NTA 体积的NTA-0 Buffer 洗,流速控制在0.5 mL/min,用NTA-10 Buffer (20 mmol Tris-HCl pH=7.9,0.5 mol NaCl,10% Glycerol,20 mmol Imidazole)洗5 倍Ni-NTA 体积,流速控制在0.5 mL/min 左右,去除未结合杂蛋白。最后用NTA-500 Buffer (20 mmol Tris-HCl pH=7.9,0.5 mol NaCl,10% Glycerol,500 mmol Imidazole)洗脱,直到检测不到蛋白为止,流速控制在0.3 mL/min左右。取上述经过Ni-NTA 树脂纯化的融合蛋白溶液,使用Factor Xa 切割缓冲液(20 mmol Tris-HCl,100 mmol NaCl,2 mmol CaCl2,(pH=8.0))调整至10 mL,用Minipore Ultra-4 超滤离心管浓缩至0.5 mL,加入10 μg的Factor Xa,23℃温育16 h,裂解液SDS-PAGE 电泳检测。然后使用HisTrap FF 和HiTrap Benzamidine FF分别去除未切割的重组蛋白和Factor Xa,得到纯度达到90%以上的药物原液,并使用HPLC 对纯化样品进行测定。
1.2.6 GnRH-PTD-PE39KDEL 的细胞毒性实验
取人乳腺癌MCF-7 细胞进行消化和收集,将细胞用RPMI 1640 培养液稀释成5 ×104个/mL 的细胞悬液,接种于96 孔板,100 μL/孔,37℃培养4 h。对照加入100 μL 培养液。样品先用RPMI 1640 培养液稀释成100 μL/mL,作为起始孔,然后按每孔与上孔2 倍的关系稀释样品,各加入稀释的样品每孔100 μL,每个梯度设8 个平行孔,实验设阴性对照(加等体积的细胞悬液)和空白对照(只含培养基)。体积分数为5%CO2培养箱,37℃培养24 h,取出,用MTT 法染色,用酶标仪570 nm 进行测定并计算IC50值。
2 结果与讨论
2.1 GnRH-PTD-PE39KDEL 重组质粒的鉴定
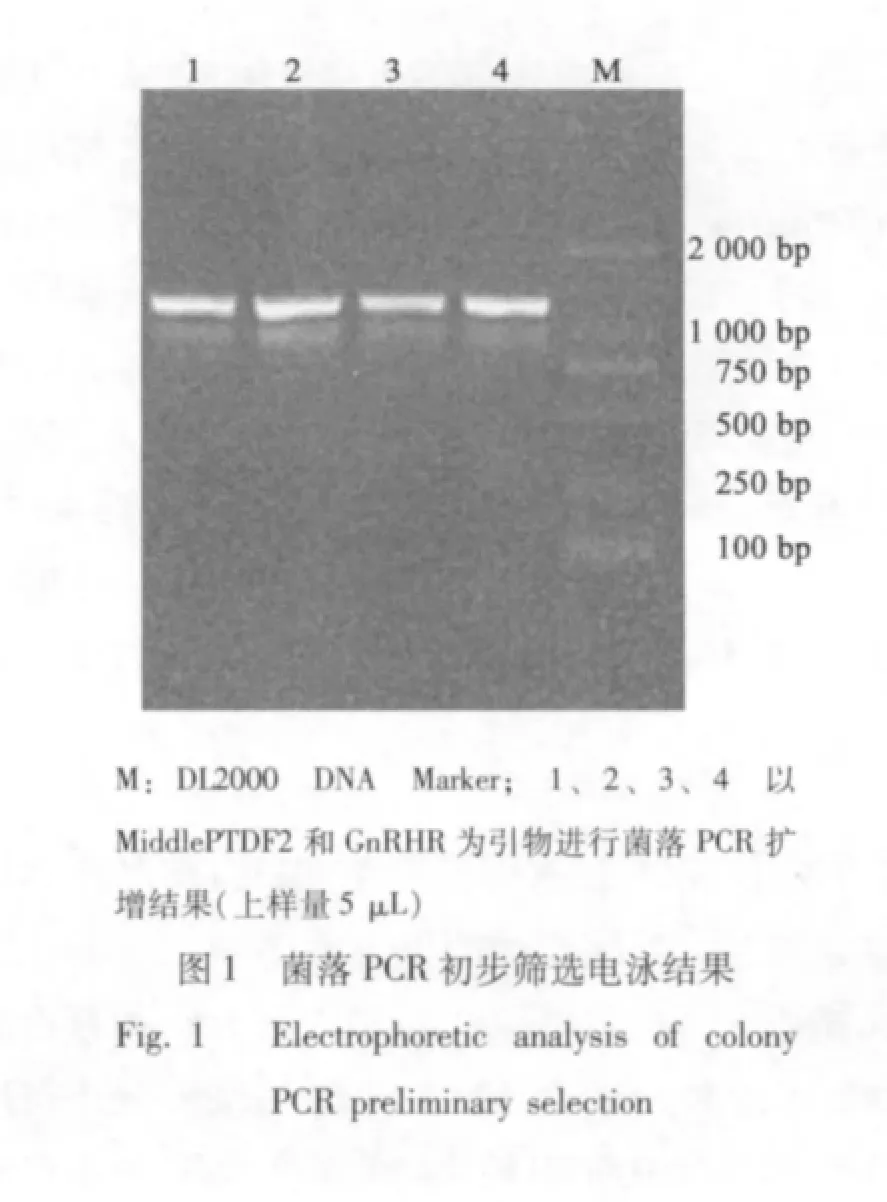
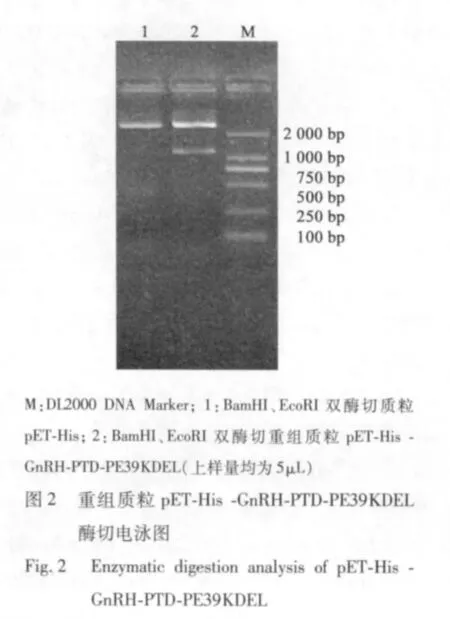
使用MiddlePTDF2 和GnRHR 为引物进行菌落PCR 扩增初步鉴定,琼脂糖电泳结果显示有约1.2 kb 的特异目的条带(见图1),提取重组GnRH-PTD-PE39KDEL 重组质粒。使用BamHI、EcoRI 进行双酶切,获得2个片段,2.8 Kb 和1.2 Kb,与预期长度相符(见图2),经测序后确认序列完全正确。
2.2 pET-His-GnRH-PTD-PE39KDEL 表达产物的鉴定
总蛋白经SDS-PAGE 电泳显示在约45 kD 处有一条目的产物条带,与预期基本一致,采用图像分析软件Bandscan 5.0 分析,表明表达量占总蛋白的20%左右,诱导表达培养产物经超声波破碎,分离上清液和沉淀,用SDS-PAGE 电泳。结果表明,GnRH-PTD-PE39KDEL 以可溶性形式表达(图3)。
2.3 免疫毒素蛋白纯化品的制备
破碎上清液Ni-NTA 镍亲和层析柱纯化后得到纯化免疫毒素蛋白,Minipore Ultra-4 超滤离心管浓缩至0.5 mL(浓度约1 mg/mL),加入10 μg 的Factor Xa,23℃温育16 h,并使用HiTrap Benzamidine FF(high sub)去除Factor Xa,最终获得免疫毒素蛋白初纯品,SDS-PAGE 电泳显示明显的单一条带(图4)。经HPLC 对纯化样品进行测定,主要吸收峰面积超过90%。
2.4 免疫毒素蛋白对人乳腺癌MCF-7 细胞的毒性
检测结果(见表1)表明,GnRH-PTD-PE39KDEL 和对照GnRH -PE39KDEL 对人乳腺癌MCF-7 细胞均有较强的细胞毒性,随着剂量的增加,其对细胞活性的抑制率也有所增强,至5.0 μg/mL 后,其抑制率增幅变缓。GnRH-PTD-PE39KDEL 和对照GnRH-PE39KDEL 对人乳腺癌MCF-7 细胞的IC50分别为0.860 μg/mL 和1.018 μg/mL,靶向融合蛋白引入PTD 后对人乳腺癌MCF-7 细胞的毒性表明较GnRH-PE39KDEL 增强。

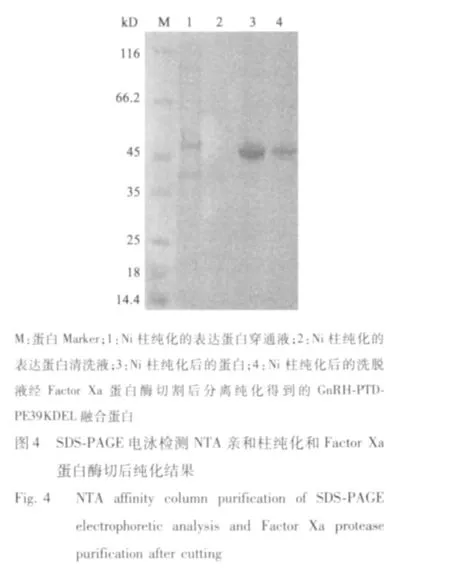

表1 不同浓度GnRH-PTD-PE39KDEL 和GnRH -PE39KDEL对MCF-7 细胞的抑制作用Table 1 Inhibitory effects of GnRH-PTD-PE39KDEL and GnRH -PE39KDEL of different concentrations on cell MCF-7
3 结论
PE 是铜绿假单胞杆菌分泌的一种毒性非常强烈的外毒素,是免疫毒素构建中常用的毒素分子,PE 由3个功能区构成,各区功能明确[8]。PE39KDEL 是绿脓杆菌外毒素A(PE)的截短形式(在去除I 区的PE 毒素的基础上再缺失359~365 位氨基酸后,PE 毒素的活性会大幅度提高[9];同时,将PE 末端5 个氨基酸REDLK 突变为KDEL 后,PE 的活性也会大幅度提高即为PE39KDEL)。免疫毒素的导向部分具有识别靶细胞特异性受体的功能,常见的导向部分有c-Met,即原癌基因met 编码的酪氨酸激酶受体[10];F3 肽,即来自高迁移组蛋白(high mobility group protein,HMG)N2 的31 个氨基酸片段[11];EGF(表皮生长因子)[12];GnRH(又称作LHRH 促黄体激素释放激素)或其衍生物等。其中GnRH 或其衍生物为导向部分,PE 为毒素部分的靶向治疗剂已经有广泛的报道[13-14],这些融合蛋白的靶向性已得到广泛验证[15],能特异性地识别目的细胞并将其杀死[16-17],但在实际应用中对于动物模型中生长旺盛的实体瘤起效不大,本文我们选用一种PTD,其氨基酸为YNAGRRARRRRRR,能够有效地介导外源物质进入细胞的胞质当中,有介导能力强、速度快、温度适应性广、浓度依赖性小、能够掺入所有细胞等特点。PTD 与其他蛋白的融合表达产物能高效地进入体外培养的细胞内,并且表现出生物学活性。胞质转导肽融合分子可以穿越细胞膜而不损伤细胞[18],被胞质转导肽带入细胞的分子仍保留其原有的性质[19]。PTD 介导无活性的分子进入细胞后仍能重新折叠,自我复性,是基因工程药物经济、高效利用的一种有效途径。将PTD 定位于融合蛋白GnRH 的C 端和PE39KDEL的N 端之间,预期将可以大大提高免疫毒素穿透细胞生物膜的能力,增强对实体瘤的浸润性,从而减少免疫毒素融合蛋白的使用量,降低副作用,其效果是其它方法所无法比拟的。
此外,我们在此融合蛋白的N 端引入了6 个His 标签和Factor Xa 蛋白酶切位点,表达后的产物是含有6个His 标签和GnRH-PTD-PE39KDEL 的前体融合蛋白,Factor Xa 蛋白酶切割纯化的重组蛋白N 端无任何来自载体的氨基酸,直接得到GnRH-PTD-PE39KDEL,从而使生产、纯化工艺简化,为融合蛋白GnRH-PTDPE39KDEL 的大规模纯化和功能研究奠定了基础。
[1]YOSHIOKA Y,TSUTSUMI Y,NAKAGAWA S,et al.Recent progress on tumor missile therapy and tumor vascular targeting therapy as a new approach[J].Curr Vasc Pharmacol,2004,2(3):259 -270.
[2]FONSATTI E,ALTOMONTE M,ARSLAN P,et al.Endoglin (CD105):A Target for Anti-angiogenetic Cancer Therapy[J].Current Drug Targets,2003,4(4):291 -296.
[3]BEATTY J D.Immunotherapy of colorectal cancer[J].Cancer,1992,70(5):1425 -1433.
[4]吴昊,吴江,杨宇,等.携带信号肽NT4-GFP-穿膜肽Ant 融合基因的重组腺相关病毒载体的构建及意义[J].吉林大学学报,2007,33(5):798 -802.
[5]BAKER R D,HOWL J,NICHOLL I D.A sychnological cell penetrating peptide mimic of p21WAF1/CIP1 is pro-apoptogenic[J].Peptides,2007,28(4):731 -740.
[6]曲恒燕,孙曼霁.蛋白转导域内在化机制的研究进展[J].生命科学,2007,19(2):220 -223.
[7]CHAUHAN A,TIKOO A,KAPUR A K,et al .The Taming of the Cell Penetrating Domain of the HIV Tat:Myths and Realities[J].J Control Release,2007,117(2):148 -162.
[8]祁志荣.PE 类重组免疫毒素的研究进展[J].微生物学免疫学进展,2006,34(1):50 -53.
[9]WOLF P,ELSASSER-BEILE U.Pseudomonas exotoxin A:From virulence factor to anti-cancer agent[J].Int J Medical microbial,2009,299(3):161 -176.
[10]朱晓娟,冯振卿,朱进,等.重组免疫毒素抗c-Met/ PE38KDEL 免疫毒素的构建、表达及纯化[J].南京医科大学学报,2009,29(7):920 -924.
[11]PORKKA K,LAAKKONEN P,HOFFMAN J A,et al.A fragment of the HMGN2 protein homes to the nuclei of tumor cells and tumor endothelial cells in vivo[J].Proc Natl Acad Sci U S A,2002,99(11):7444 -7449.
[12]刘新,魏洪涛,王国珍,等.EGF-PE40 重组毒素的构建[J].中国实验诊断学,2006,10(7):736 -737.
[13]TAUPIAC M P,BEBIEN M,ALAMI M,et al.A deletion within the translocation domain of Pseudomonas exotoxin A enhances translocation efficiency and cytotoxicity concomitantly[J].MOL Microbiol,1999,31(5):1385 -1393.
[14]邓欣,KLUSSMANN S,李亘松,等.Spiegelmer NOX 1255 对LHRH-PE40 与HeLa 细胞上LHRH 受体结合的抑制作用[J].中国生物制品学杂志,2011,24(6):657 -664.
[15]张国利,何畅,吴广谋,等.冻干重组人促黄体激素释放激素-绿脓杆菌外毒素A 融合蛋白与不同细胞受体结合竞争试验[J].中国实验诊断学,2007,11(5):583 -587.
[16]张鸿,邓欣,张国利.LHRH-PE40 对非小细胞肺癌细胞A549 的作用[J].解剖科学进展,2010,16(3):261 -263.
[17]邓欣,刘莹,张国利,等.LHRH-PE40 对黑色素瘤A375 细胞的诱导凋亡作用[J].中国生物制品学杂志,2011,24(1):37 -40.
[18]KHAFAGY E S,MORISHITA M,ISOWA K,et al.Effect of cell penetrating peptides on the nasal absorption of insulin[J].J Control Release,2009,133(2):103 -108.
[19]KIM D,JEON C,KIM J H,et al.Cytoplasmic transduction peptide (CTP):New approach for the delivery of biomolecules into cytoplasm in vitro and in vivo[J].Exp Cell Res,2006,312(8):1277 -1288.
