超高压辅助浊点萃取法提取富集莲子心总生物碱
2013-08-29朱荣华王晓刘建华张树芹刘峰
朱荣华 ,王晓 ,刘建华 ,张树芹,刘峰
(1.山东农业大学化学与材料科学学院,山东 泰安 271018;2.山东省分析测试中心,山东 济南 250014)
植物中活性成分的提取、富集是分离与分析的第一步,也是最关键的一步。近年来一些新技术,如超临界流体萃取[1]、微波辅助提取[2-3]等已被广泛应用于中药活性成分的提取过程中,但是这些方法存在耗时长,能耗高等缺点。超高压提取(ultrahigh pressure extraction,UPE)是利用100 MPa 以上的流体静压力作用于溶剂和中药的混合液,保压一段时间(几分钟)后卸压,从而达到提取的目的[4-5],已广泛应用于中药有效成分的提取,如葡萄皮中提取花青素[6]、茶叶中提取茶多酚[7]、荔枝果皮中提取黄酮类化合物[8]和人参中提取人参皂苷[9]等。该方法与传统技术相比,可以大大缩短提取时间、降低能耗、减少杂质成分的溶出,提高有效成分的收率,避免了因热效应引起的有效成分结构变化、损失以及生理活性的降低[10-11]。浊点萃取(cloud point extraction,CPE)是以表面活性剂胶束水溶液的溶解性和浊点现象为基础,通过改变一定的萃取条件(如电解质、温度、时间等),达到将水溶性物质与亲油性物质分离的目的[12]。该方法完全取代了有机溶剂,具有经济、高效的特点[13],有着广阔的应用前景。因此,超高压提取与浊点萃取技术相结合,可在无有机溶剂条件下实现快速提取、富集天然产物中的有效成分。目前,超高压-浊点萃取技术提取、富集天然产物有效成分的研究尚未见文献报道。
莲子心是莲科植物莲(Nelumbo nucifera Gaertn)成熟种子中的绿色胚芽,主要成分为生物碱,包括甲基莲心碱、异莲心碱、莲心碱等[14]。现代医学研究表明,莲子心具有抗多种实验性心律失常、抗血小板聚集及降压等作用[15]。
本文对超高压-浊点萃取莲子心中生物碱的影响因素进行了系统研究。通过表面活性剂类型、浓度、提取压力、时间、料液比等单因素实验确定了液-固提取工艺条件;进一步通过NaCl 浓度、平衡温度、平衡时间等单因素实验确定了浊点萃取富集条件。结果表明,此方法可在极短的时间内实现莲子心生物碱的提取、富集。
1 仪器和试剂
1.1 仪器与设备
HPP.L3-600 型超高压生物提取设备(天津市华泰森淼生物工程技术有限公司);UV-2550 型双光束紫外-可见分光光度计(日本岛津公司);AE240 分析天平(METTLER 公司)。
1.2 原料与试剂
莲子心购自山东中医药大学中鲁药店,甲基莲心碱对照品购自天然产物国家标准样品参比实验室;烷基酚聚氧乙烯醚(OP-10)、聚乙二醇辛基苯基醚(Triton X-100)均购自天津市科密欧化学试剂有限公司;十二烷基磺酸钠(SDS)、十二烷基苯磺酸钠(SDBS)、氯化钠为分析纯,均购自国药集团化学试剂有限公司;甲醇、无水乙醇为分析纯,均购自济南巨业化学试剂有限公司。
2 实验方法
2.1 超高压提取方法
称取一定量的样品,转入聚乙烯塑料袋中,按照一定的料液比加入溶剂,密封。在一定压力下,提取一定时间,卸压后,过滤,得提取液,分析总生物碱含量。所有实验均重复3 次,取平均值。
2.2 浊点萃取方法
将上述过滤后的提取液中加入一定量的NaCl,混匀,放入设定温度的恒温水浴中加热。平衡一段时间后,进行离心分离,使表面活性剂相与水相分离。分别量取两相体积并测定两相中莲子心生物碱的含量。所有实验均重复3 次,取平均值。
2.3 总生物碱含量测定
精确配制0.50 mg/mL 的甲基莲心碱对照品溶液,用甲醇分别稀释2、5、10、20、50 倍后,用紫外-可见分光光度计于280 nm 下分别测定吸光度。以吸光度为纵坐标,甲基莲心碱浓度(mg/mL)为横坐标作图,得线性回归方程:Y=-0.04826+12.52484X,R2=0.9992。
分别取提取液、表面活性剂相、水相溶液100 μL 用去离子水稀释定容至10 mL,测定总生物碱含量,计算提取率及萃取回收率。
2.4 萃取回收率及浓缩系数
萃取回收率=表面活性剂相总生物碱的浓度/提取液总生物碱的浓度;
浓缩系数(CF)=浓缩分层后水相体积/表面活性剂相体积。
3 结果与讨论
3.1 液-固提取
3.1.1 表面活性剂的选择
称取0.25 g 莲子心粉,分别采用质量分数5%的OP-10、Triton X-100、SDS、SDBS、甲醇、乙醇溶液为提取溶剂,固定料液比1:40 (g/mL),在压力200 MPa 下提取2 min,不同提取溶剂对提取率影响如图1(A)所示。
从图1(A)可知,OP-10、SDS 比其他溶液具有更高的提取效率,但是SDS 的Krafft 点在8℃左右,后续萃取阶段较难控制,而OP-10 的浊点为65~80℃,易于进行后续浊点萃取阶段的操作,综合以上因素最终选择OP-10 水溶液作为溶剂。
3.1.2 OP-10 水溶液浓度对提取率的影响
称取0.25 g 莲子心粉,分别配制质量分数为1%、3%、5%、7%、9%的OP-10 水溶液作为提取溶剂,固定料液比1:40 (g/mL),在压力200 MPa 下提取2 min,不同提取溶剂浓度对提取率影响如图1(B)所示。
表面活性剂具有亲水基和疏水基,达到临界胶束后,可以形成疏水基在里的胶束团,本实验对莲心生物碱的提取作用依靠的就是表面活性剂溶液中所形成的胶束。从图1(B)中可以看出OP-10 质量分数在1%~5%之间,提取率随着溶剂浓度的增大呈上升趋势,原因是随着表面活性剂溶液浓度的增大,形成的胶束越来越多,增溶作用越强,越有利于总生物碱的提取。但在OP-10 质量分数高于5%之后,随着浓度的增大提取效率呈下降趋势,这是因为随着表面活性剂浓度的增大,溶液黏度增大,扩散能力减弱,胶束难渗入到莲子心样品基质的内部,导致提取率降低。因此,质量分数5%的OP-10 水溶液为最佳提取溶剂。
3.1.3 压强对提取率的影响
称取0.25 g 莲子心粉,以质量分数5%的OP-10 水溶液为溶剂,固定料液比1:40 (g/mL),分别在100、200、300、400、500 MPa 高压下提取2 min,结果见图1(C)。
超高压提取的过程是先对物料加压,保持一定时间后,突然卸压。由于在增压过程中,莲子心细胞内外出现超高压差,溶剂在压力作用下迅速渗透到细胞内;卸压过程中压力由几百兆帕迅速降为常压,同样,在内外压差作用下,有效成分从细胞内向周围溶剂内扩散,从而大大加快了有效成分向外扩散的速率[16]。
从图1(C)中可以看出,在100~500 MPa 之间,随着超高压压力的升高,提取率略有下降。说明压力在达到100 MPa 时,细胞的细胞壁和细胞膜已被充分破坏,目标化合物已充分溶出,当压力增大,溶剂粘度增加,扩散能力减弱,提取率略有下降。因此,提取压力选择100 MPa。
3.1.4 保压时间对提取率的影响
称取0.25 g 莲子心粉,以质量分数5%的OP-10 水溶液为溶剂,固定料液比1:40 (g/mL),100 MPa 高压下分别提取1、2、3、4、5 min,结果见图1(D)。
从图1(D)中可以看出,在1~5 min 之间,随着保压时间的延长,提取率略有下降。实验结果表明,提取溶剂在高压作用下,进入莲子心细胞内,100 MPa 高压下莲子心的细胞破裂很快,在这1 min 内已经充分破裂,并且超高压力引起体系的体积变化,推动了化学平衡的移动,溶剂的渗透、溶质的溶解快速达到平衡[16]。从效率和能耗等方面综合考虑,1 min 为最佳时间。
3.1.5 料液比对提取率的影响
以质量分数5%的OP-10 溶液为溶剂,分别按照料液比1:5,1:10,1:20,1:30,1:40 (g/mL),100 MPa 高压下提取1 min,结果见图1(E)。
如图1(E)所示,在一定范围内,随着料液比的增大,表面活性剂的量增加,胶束作用越强,溶剂对总生物碱的提取效果越好,但是达到一定的浓度后,溶剂实现了对总生物碱的充分提取,再增大料液比提取率基本不变,因此本实验的最佳料液比为1:20。

图1 超高压提取影响因素对提取率的影响Fig.1 Impact of ultrahigh pressure-assisted micellar extraction on the extraction yield of total alkaloids
超高压辅助表面活性剂提取莲子心中生物碱的最佳工艺条件如表1 所示,按照上述条件进行提取实验,莲心生物碱的提取率可以达到103.6 mg/g。

表1 最佳提取工艺条件Table 1 The optimal conditions of the extraction process
3.2 液-液萃取
3.2.1 NaCl 质量分数对萃取回收率的影响
完成提取后过滤,向滤液中加入一定量的NaCl,使NaCl 的质量分数分别达到5%、10%、12%、15%、17%、20%,恒温65℃水浴加热10 min 后,2 000 r/min 离心4 min,结果如图2(A)所示。
溶液中加入电解质NaCl 可增大OP-10 胶团的聚集数,并降低表面活性剂浓缩相中自由水的质量分数和减少溶质在水相的溶解度,从而提高其对莲心生物碱的增溶能力并且减小表面活性剂相的体积,另外,无机盐可以改变非离子表面活性剂的浊点温度[17]。图2(A)表明,随着NaCl 质量分数的增加,浓缩系数一直呈上升趋势,萃取回收率值在NaCl 质量分数增大到15%后达到平衡,再增加NaCl 的质量分数对萃取回收率值基本没有影响,而且加入过多的NaCl 难以溶解,因此15%为最佳质量分数。
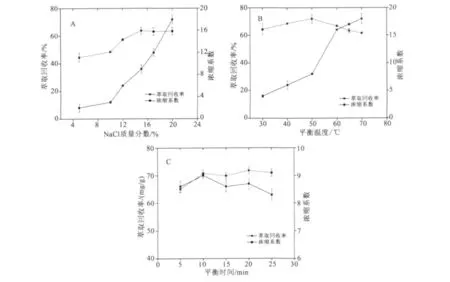
图2 浊点萃取各因素对萃取回收率和浓缩系数的影响Fig.2 Impacts of CPE factors on CPE extraction yield and CF
3.2.2 平衡温度对萃取回收率的影响
完成提取后过滤,向滤液中加入NaCl,使其质量分数达到15%,再分别以恒温30、40、50、60、65、70℃水浴加热10 min 后,2 000 r/min 离心4 min,结果如图2(B)所示。
随着平衡温度的上升,胶束中氢键断裂脱水,使表面活性剂富集相体积减少,引发更好的相分离。图2(B)表明,随着温度的上升,浓缩系数一直呈上升趋势,萃取回收率值在30~50℃间呈上升趋势,在50℃之后出现下降趋势,可能是温度过高,莲心生物碱稳定性下降,部分生物碱被破坏。所以最佳的平衡温度是50℃。
3.2.3 平衡时间对萃取回收率的影响
完成提取后过滤,向滤液中加入NaCl,使其质量分数达到15%,分别在50℃恒温水浴加热5、10、15、20、25 min 后,2 000 r/min 离心4 min,结果如图2(C)所示。
在合适的电解质和浊点温度下,足够的平衡时间可以使表面活性剂充分的提取富集目标成分。从图2(C)可知,在50℃恒温水浴条件下,平衡时间对萃取回收率和浓缩系数影响不大,浓缩系数基本保持不变,萃取回收率值在平衡时间达到10 min 后也基本保持不变。所以平衡时间选择为10 min。最佳富集工艺条件见表2。

表2 最佳富集工艺条件Table 2 The optimal conditions of the enrichment process
2.3 最优化条件
综上所述,超高压辅助胶束提取莲子心生物碱的最佳提取工艺为提取压力100 MPa,提取时间1 min,质量分数5% OP-10 为溶剂,料液比1:20 (g/mL),莲心生物碱的提取率达到103.6 ±2.6 mg/g。提取液中加入NaCl 使其质量分数达到15%再在50℃条件下平衡10 min,两相分离,离心后莲子心生物碱的萃取回收率为70.73% ±1.34%,浓缩系数为8.6 ±0.2。
4 结论
本文利用超高压辅助胶束提取结合浊点萃取技术从莲子心中提取富集了莲心生物碱,与传统方法相比,超高压提取时间短、操作简单、能耗低。同时,超高压处理后的提取液成分较简单,不浑浊,粘度低,易过滤,有利于后续操作。常温提取又能使莲子心生物碱避免因热效应损失和药理活性降低。超高压辅助胶束提取结合浊点技术是在密闭的环境下常温进行的,没有溶剂挥发,绿色环保,是一种提取和富集莲子心中生物碱的新方法。
[1]KARLSSON L,TORSTENSSON A,TAYLOR L T,et al.The use of supercritical fluid extraction for sample preparation of pharmaceutical formulations[J].Journal of Pharmaceutical and Biomedical Analysis,1997,15(5):601 -611.
[2]FANG L,LIU Y Q,ZHUANG H Y,et al.Combined microware-assisted extraction and high-speed counter-current chromatography for separation and parification of xanthones from Garcinia mangostana[J].Journal of Chromatography B,2011,879(28):3023 -3027.
[3]LIU Y Q,GUO X F,DUAN W J,et al.Accelerated solvent extraction of monacolin K from red yeast rice and purification by highspeed counter-current chromatography[J].Journal of Chromatography B,2010,878(28):2881–2885.
[4]张格,张玲玲,吴华,等.采用超高压技术从茶叶中提取茶多酚[J].茶叶科学,2006,26(4):291 -294.
[5]ZHANG S Q,CHEN R Z,WANG C Z.Experiment study on ultrahigh pressure extraction of Ginsenosides[J].Journal of Food Engineering,2007,79(1):1 -5.
[6]CORRALES M,GARCI A F,BUTZ P,et al.Extraction of anthocyanins from grape skins assisted by high hydrostatic pressure[J].Journal of Food Engineering,2009,90 (4):415 -421.
[7]XI J,SHEN D J,ZHAO S,et al.Characterization of polyphenols from green tea leaves using a high hydrostatic pressure extraction[J].International Journal of Pharmaceutics,2009,382(1/2):139 -143.
[8]PRASAD K N,YANG B,ZHAO M M,et al.Application of ultrasonication or high-pressure extraction of flavonoids from litchi fruit pericarp[J].Journal of Food Process Engineering,2009,32 (6):828 -843.
[9]SHIN J S,AHN S C,CHOI S W,et al.Ultra high pressure extraction(VHPE)of ginse-nosides from Korean panax ginseng powder[J].Food Science and Biotechnology,2010,19(3):743 -748.
[10]曾亮,罗理勇,官兴丽.超高压提取茶叶内含物工艺优化[J].食品科学,2011,32(6):85 -88.
[11]PRASAD K N,YANG B,SHI J,et al.Enhanced antioxidant and antityrosinase activities of longan fruit pericarp by ultra-highpressure-assisted extraction[J].J Pharm Biomed Anal,2010,51 (2):471 -477.
[12]姬厚伟,张建勋.现代萃取技术及其在烟草化学分析中的应用[J].烟草科技,2007(9):46 -50.
[13]SHI Z H,HE J T,CHANG W B.Micelle-mediated extraction of tanshinones from Salvia miltiorrhiza bunge with analysis by highperformance liquid chromatography[J].Talanta,2004,64(2):401 -407.
[14]张弦,潘扬.植物莲中生物碱类成分的研究概况[J].南京中医药大学学报:自然科学版,2002,18(6):382 -384.
[15]娄红祥,苑辉卿,季梅.莲子心化学成分的研究[J].山东医科大学学报,1995,33(4):346 -348.
[16]陈瑞战,张守勤,刘志强.超高压技术在中药有效成分提取中的应用[J].中草药,2007,38(12):1905 -1908.
[17]TIAN M L,YAN H Y,ROW K H.Solid-phase extraction of tanshinones from Salvia Miltiorrhiza Bunge using ionic liquidmodified silica sorbents[J].Journal of Chromatography B,2009,877(819):738 -742.
