可剪切聚乙二醇及TAT肽共修饰多柔比星脂质体的制备及表征Δ
2013-08-29朱亚勤李玲胡青黄发珍程亮程丽芳陈大为苏州大学药学院江苏苏州2523沈阳药科大学沈阳006
朱亚勤,李玲,胡青,黄发珍,程亮,程丽芳,陈大为,2#(.苏州大学药学院,江苏苏州2523;2.沈阳药科大学,沈阳 006)
多柔比星(DOX)是临床常用的广谱抗肿瘤药物,但是它的毒副作用如骨髓抑制、心脏毒性等限制了其临床应用[1]。脂质体作为一种新型给药系统,具有不良反应小、无免疫原性和可生物降解等优点。将DOX包裹入脂质体可显著降低药物毒性,改善药物抗肿瘤效果[2]。
TAT肽是一种细胞穿膜肽[3],其有效序列为AYGRKKRRQRRR,在生理pH下带正电荷。研究表明,TAT肽可显著提高脂质体、胶束等的细胞摄取[4],增强化疗药物的抗肿瘤效果。然而,TAT肽无细胞选择性,直接与纳米载体相连后会降低纳米载体在体内的肿瘤靶向性。本研究将可剪切的聚乙二醇(PEG)5000连接在脂质体表面,TAT肽通过PEG2000连接隐藏在内层,构建可剪切PEG及TAT肽共修饰DOX脂质体(C-TAT-DOX-LP),并对其进行表征。
1 材料
RV10旋转蒸发仪(德国IKA公司);Nicomp TM380ZLS粒径分析仪(美国Nicomp公司);DeBEE高压微射流纳米均质机(美国Nano DeBEE公司);SPD-M20A高效液相色谱仪(日本岛津公司)。
盐酸DOX(原料药,北京华奉联博科技技术有限公司,批号:HF100622,纯度:>99.5%);二硬脂酸磷脂酰乙醇胺(DSPE,上海艾伟特医药科技有限公司,批号:100929,纯度:≥99%);大豆卵磷脂(上海太伟药业有限公司,批号:040403,纯度:96%);胆固醇(国药集团化学试剂有限公司,批号:F20101215,纯度:95%);TAT-半胱氨酸(TAT-Cys,上海吉尔生化有限公司,批号:P120322-CQ289039,纯度:98%);N-羟基丁二酰亚胺-聚乙二醇2000-马来酰亚胺(NHS-PEG2000-Mal,北京键凯科技有限公司,批号:ZZ112P038,纯度:95%);N-琥珀酰-3-2-联巯基吡啶-丙酸盐(SPDP,圣克鲁斯生物技术上海有限公司,批号:A1912,纯度:95%);甲氧基-聚乙二醇 5000-巯基(CH3O-PEG5000-SH,上海炎怡生物有限公司,批号:B120628,纯度:≥95%);二硫苏糖醇(DTT,上海前尘生物科技有限公司,批号:233155,纯度:≥99.5%);透析袋(分子质量:8000~14000,上海源叶生物科技有限公司);氯仿为分析纯,乙腈、三氟乙酸为色谱纯。
2 方法与结果
2.1 二硬脂酸磷脂酰乙醇胺-二硫键-聚乙二醇5000(DSPE-S-S-PEG5000)的合成与表征
2.1.1 DSPE-S-S-PEG5000的合成。根据参考文献[5],DSPES-S-PEG5000的合成步骤如下:称取20mg DSPE、8.2mg SPDP溶于无水氯仿中,加入适量三乙胺,N2保护,室温黑暗下搅拌反应5h。薄层色谱(TLC)监测反应进程。将80mg Ch3OPEG5000-SH溶解于氯仿反应液,继续反应12h,反应结束后,冷乙腈中沉淀除去未反应的DSPE。3000r/min离心5min,上清液旋转蒸发除去乙腈,加纯水置透析袋中透析48h,冻干。
2.1.2 DSPE-S-S-PEG5000的核磁氢谱(1H-NMR)表征。1HNMR(溶剂:氘代氯仿)表征,DSPE:δ 0.88(t,—CH3,6H),1.25(s,—CH2—,56H),PEG:3.65(s,—CH2—,456H),见图1。
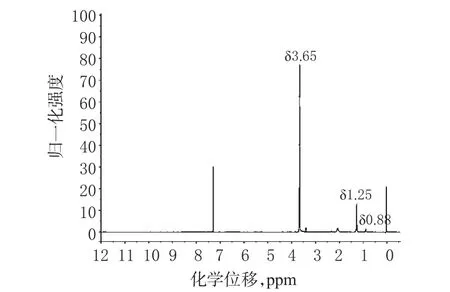
图1 DSPE-S-S-PEG5000的1H-NMR图Fig 1 1H-NMR spectrum of DSPE-S-S-PEG5000
以上特征峰表明PEG5000成功连接到了DSPE上。以δ3.65与δ1.25处峰面积比计算产物纯度,结果产物纯度约为84.4%。
2.2 DSPE-PEG2000-TAT的合成与表征
2.2.1 DSPE-PEG2000-TAT的合成。根据参考文献[6],DSPEPEG2000-TAT的合成方法如下:按物质的量之比1.2∶1称取DSPE、NHS-PEG2000-Mal溶于无水氯仿中,滴加5μl三乙胺,N2保护,室温反应5h。TLC监测反应进程。反应结束后,旋转蒸发除去氯仿,冷乙腈沉淀DSPE,上清液旋转蒸发除乙腈。产物透析48h,冷冻干燥。按物质的量之比1∶1.2称取DSPEPEG2000-Mal、TAT-Cys,溶于纯水,N2保护下,轻微搅拌。TLC监测反应进程。反应结束后置透析袋中透析48h,冷冻干燥。
2.2.2 DSPE-PEG2000-TAT的红外光谱(IR)表征。分别取适量TAT-Cys、DSPE-PEG2000-Mal、DSPE-PEG2000-TAT,加KBr压片,IR表征见图2。

图2 红外光谱图a.TAT-Cys;b.DSPE-PEG2000-Mal;c.DSPE-PEG2000-TATFig 2 FTIR spectrumsa.TAT-Cys;b.DSPE-PEG2000-Mal;c.DSPE-PEG2000-TAT
其中,a图中2556cm-1为TAT-Cys中巯基(—SH)的特征吸收峰,在c图中该吸收峰消失,b图中在此位置无吸收峰干扰,证明TAT肽中—SH与DSPE-PEG2000-Mal中的Mal基团已成功连接。b、c图中2920cm-1、2850cm-1为PEG中C—H伸缩振动,1104cm-1为PEG中C—O伸缩振动,a、c图中1664cm-1为TAT肽中酰胺键C—O伸缩振动,表明已成功合成DSPE-PEG2000-TAT。
2.3 TAT肽连接率的测定
2.3.1 TAT肽含量测定色谱条件。色谱柱:Promosil C18(250mm×4.6mm,5μm);流动相:A(乙腈+0.1%三氟乙酸)-B(水+0.1%三氟乙酸),梯度洗脱:0~12min,A:12%~37%,B:63%~88%,12~16min,A:37%~100%,B:0~63%;流速:1.0ml/min;检测波长:220nm;柱温:30℃;进样量:20μl。
2.3.2 方法学考察。依法进行精密度和回收率试验。结果低、中、高水平的日内精密度RSD分别为0.30%、0.67%、0.58%(n=5),日间精密度RSD分别为1.56%、1.23%、1.31%(n=5);回收率分别为(98.68±0.23)% 、(99.49±0.21)%、(99.40±0.43)%,RSD分别为0.62%、0.71%、0.75%(n=5)。
2.3.3 测定方法。反应前精密称取TAT-Cys,配制成100µg/ml的溶液,按“2.3.1”项色谱条件进样20µl,记录峰面积为A1;反应后取适量反应液稀释后按相同色谱条件进样,记录峰面积为A2,色谱见图3。
由图3可见,DSPE-PEG2000-Mal在此条件下对TAT肽无干扰。根据外标一点法计算未反应的TAT肽的量[=(100×A2×稀释倍数×反应液体积)/A1],进一步计算得到TAT肽的连接率[=(反应前TAT肽的量-反应后TAT肽的量)/TAT肽理论反应量×100%],经计算为96.3%。
2.4 脂质体的制备

图3 TAT肽的HPLC色谱图a.反应前TAT肽;b.反应后TAT肽;c.DSPE-PEG2000-MalFig 3 HPLC chromatograms of TAT peptidea.TAT peptide before reaction;b.TAT peptide after reaction;c.DSPEPEG2000-Mal
采用薄膜分散法及pH梯度法制备DOX脂质体(DOXLP),以后插入法[7]制备TAT肽修饰的DOX-LP(TAT-DOX-LP)、C-TAT-DOX-LP。方法如下:称取适量大豆卵磷脂、胆固醇溶于无水乙醇,旋转蒸发成膜。加入pH 4的柠檬酸-磷酸氢二钠缓冲液,40℃水化20min。所得的脂质体进行超声粉碎(100W,400s),经高压微射流处理(20000psi,5min)后得空白脂质体(Blank-LP)溶液。取Blank-LP溶液适量,用0.1mol/L的Na2HPO4溶液调pH至7.6。按药脂比1∶15称取DOX溶于pH 7.6的柠檬酸-磷酸氢二钠缓冲液中,将其缓慢滴加到Blank-LP溶液中,70℃温浴30min后,立即冷却,即得DOX-LP,未包封的DOX以透析法除去。取DSPE-S-S-PEG5000、DSPE-PEG2000-TAT各适量溶于pH 7.6的柠檬酸-磷酸氢二钠缓冲液中形成胶束溶液,按物质的量之比分别吸取适量胶束溶液滴入DOX-LP中,55℃条件下温浴1h,冷却后即得到C-TAT-DOX-LP,以同样方法制备TAT-DOX-LP。
2.5 粒径及Zeta电位的测定
取Blank-LP、DOX-LP、TAT-DOX-LP及C-TAT-DOX-LP各适量,蒸馏水稀释后用粒径分析仪测定粒径及电位。结果,所得脂质体粒径均在200nm以下,除TAT-DOX-LP带正电外,其他类型脂质体均带负电,见表1。
表1 不同脂质体粒径、电位、包封率测定结果(±s,n=3)Tab 1 Particle size,Zeta-potential and encapsulation efficiency of different liposomes(±s,n=3)
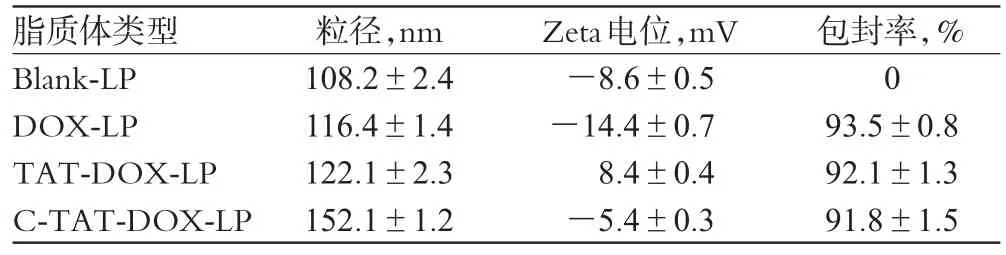
表1 不同脂质体粒径、电位、包封率测定结果(±s,n=3)Tab 1 Particle size,Zeta-potential and encapsulation efficiency of different liposomes(±s,n=3)
包封率,%093.5±0.892.1±1.391.8±1.5脂质体类型Blank-LP DOX-LP TAT-DOX-LP C-TAT-DOX-LP粒径,nm 108.2±2.4116.4±1.4122.1±2.3152.1±1.2Zeta电位,mV-8.6±0.5-14.4±0.78.4±0.4-5.4±0.3
2.6 透射电镜(TEM)形态观察
取DOX-LP及C-TAT-DOX-LP适量,滴加至专用铜网上,样品干燥后进行TEM扫描,结果见图4。
由此可见二者在形态上无明显差别,分布均匀且呈球形。
2.7 包封率的测定
2.7.1 色谱条件。色谱柱:Promosil C18(250mm×4.6mm,5µm);流动相:水(含0.01mol/L磷酸二氢胺)-甲醇(35∶65);流速:1.0ml/min;柱温:30℃;检测波长:497nm;进样量:20µl。
2.7.2 方法学考察。依法进行精密度和回收率试验。结果低、中、高水平的日内精密度RSD分别为0.43%、0.41%、0.32%(n=5),日间精密度RSD为0.62%、0.78%、0.58%(n=5);回收率分别为(98.75±0.52)%、(98.82±0.31)%、(100.04±0.52)%,RSD分别为0.52%、0.81%、0.63%(n=5)。
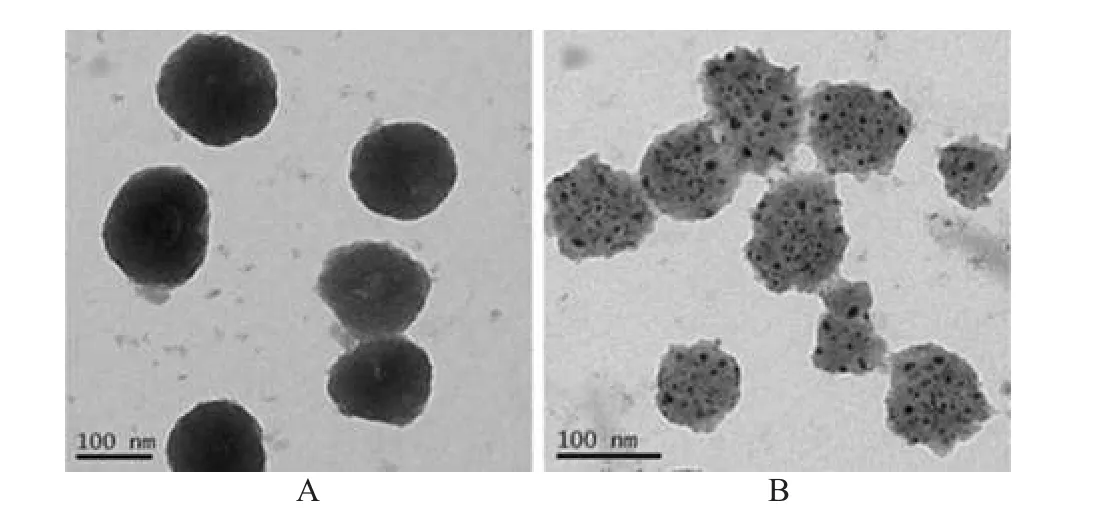
图42 种脂质体的TEM图A.DOX-LP;B.C-TAT-DOX-LPFig 4 TEM micrograph of 2kinds of liposomesA.DOX-LP;B.C-TAT-DOX-LP
线性关系考察。标准溶液的制备:精密称取盐酸DOX适量,配成1.0mg/ml的母液,然后分别配成1、5、10、20、40μg/ml的溶液。按“2.7.1”项下色谱条件进样,以峰面积(A)对质量浓度(c)进行回归,得标准曲线方程A=12129.4c-1064.5(r=0.9998)。结果表明,DOX的检测质量浓度在1~40μg/ml范围内与峰面积线性关系良好。
2.7.3 包封率(Entrapment efficiency,EE)测定。采用超滤离心法测定脂质体的包封率。分别取“2.4”项下脂质体溶液各0.5ml,置于10KD超滤离心管中,12000r/min离心60min。将滤液适当稀释,过滤后取20μl进样,按“2.7.1”项下色谱条件测定外水相中游离药物的含量。按以下公式计算脂质体的包封率。包封率=(投入的总药量-游离的药量)/投入的总药量×100%。结果所测脂质体的包封率均>90%,见表1。
2.8 体外可剪切试验
取适量TAT-DOX-LP及C-TAT-DOX-LP,分别测定其粒径及电位;加入还原剂二硫苏糖醇(DTT,10mmol/L)后,同时在37℃水浴中孵育30min,再次测定二者粒径及电位[DTT(-)表示不加DTT,DTT(+)表示加DTT],结果见表2。
表2 不同脂质体体外剪切后粒径及Zeta电位测定结果(±s,n=3)Tab 2 Particle size and Zeta-potential of different liposomes after cleaved in vitr(ox ±s,n=3)

表2 不同脂质体体外剪切后粒径及Zeta电位测定结果(±s,n=3)Tab 2 Particle size and Zeta-potential of different liposomes after cleaved in vitr(ox ±s,n=3)
脂质体类型TAT-DOX-LP C-TAT-DOX-LP粒径,nm DTT(-)120.8±2.3155.1±2.8DTT(+)122.1±1.2140.5±3.7Zeta电位,mV DTT(-)8.4±0.5-5.9±0.8DTT(+)8.1±0.37.8±0.6
孵育30min后,TAT-DOX-LP粒径及电位均无明显变化,说明DTT本身对粒径及电位无显著影响;而C-TAT-DOX-LP的粒径从155.1nm降低至140.5nm,电位由-5.9mV上升至7.8mV,证实了二硫键可在DTT作用下被还原断裂,暴露出TAT肽。
2.9 体外释放试验
分别取 C-TAT-DOX-LP、剪切后 C-TAT-DOX-LP(即TAT-DOX-LP)、盐酸DOX溶液各5ml(DOX质量浓度均为5mg/ml)于透析袋中,两端扎紧后,投入装有50ml pH 7.4的磷酸盐缓冲溶液(PBS)的三角瓶中,于(37±0.5)℃的恒温水平振荡,频率为100次/min。分别于 0.5、1、2、4、6、8、10、12、16、24、36、48h取样1ml,同时补充等体积的pH 7.4的磷酸盐缓冲溶液。收集样品按“2.7.1”项下色谱条件测定,计算累积释放度,绘制释放曲线,见图5。

图5 DOX、C-TAT-DOX-LP及TAT-DOX-LP的体外释放曲线Fig 5 Accumulative release curves of DOX,C-TAT-DOXLPand TAT-DOX-LPin vitro
由图5可见,游离DOX在8h时释放已达到90%,10h时几乎已释放完全;而C-TAT-DOX-LP及TAT-DOX-LP均释放缓慢持续,无突释点。对比2组脂质体,TAT-DOX-LP释放DOX有所增加,说明PEG被剪切后有利于DOX的释放。
3 讨论
本研究旨在制备C-TAT-DOX-LP。该脂质体外层的PEG5000可起到长循环作用,同时掩蔽TAT肽;在肿瘤组织的还原环境中,DSPE-S-S-PEG5000中的二硫键被还原断裂,暴露出内层的TAT肽,从而促进DOX-LP入胞,增强其抗肿瘤效果。合成部分,采用1H-NMR对DSPE-S-S-PEG5000进行表征,根据DSPE及PEG的特征质子峰鉴定其结构,并通过二者峰面积比计算其纯度;采用高效液相色谱法检测TAT肽连接率。结果表明,本研究所采用的合成方法简单易行且具有较高的反应效率。制备部分,采用经典的pH梯度法制备了高EE的DOX-LP,后插入法制备了C-TAT-DOX-LP。后插入法相较于传统方法简便、节省膜材且对EE无明显影响。体外试验用浓度为10mmol/L的DTT来模拟肿瘤组织的还原环境,通过测定C-TAT-DOX-LP粒径及电位的变化来考察其能否在肿瘤微环境下暴露TAT肽。结果显示,C-TAT-DOX-LP在DTT作用下电荷由负变正,与TAT-DOX-LP的电位较接近,证明C-TAT-DOX-LP能够暴露TAT肽,达到了试验设计的目的。体外释放试验表明,所制备的C-TAT-DOX-LP有明显缓释效果,PEG剪切后有利于DOX的释放。
综上所述,本研究成功制备了粒径均一、包封率高的CTAT-DOX-LP,为下一步考察其抗肿瘤效果奠定了基础。
[1] 樊秋平,梁嘉碧,杨海云,等.热疗用多柔比星温敏纳米粒的制备及工艺优化[J].中国药房,2011,22(17):1580.
[2] Wang M,Thanou M.Targeting nanoparticles to cancer[J].Pharmacol Res,2010,62(2):90.
[3] Qin Y,Chen H,Zhang Q,et al.Liposome formulated with TAT-modified cholesterol for improving brain delivery and therapeutic eff i cacy on brain glioma in animals[J].Int J Pharm,2011,420(2):304.
[4] Torchilin VP.Tat peptide-mediated intracellular delivery of pharmaceutical nanocarriers[J].Adv Drug Deliv Rev,2008,60(4/5):548.
[5] McNeeley KM,Karathanasis E,Annapragada AV,et al.Masking and triggered unmasking of targeting ligands on nanocarriers to improve drug delivery to brain tumors[J].Biomaterials,2009,30(23/24):3986.
[6] Kuai R,Yuan W,Qin Y,et al.Efficient delivery of payload into tumor cells in a controlled manner by TAT and thiolytic cleavable PEG co-modified liposomes[J].Mol Pharm,2010,7(5):1816.
[7] Saul JM,Annapragada A,Natarajan JV,et al.Controlled targeting of liposomal doxorubicin via the folate receptor in vitro[J].J Control Release,2003,92(1/2):49.
