不同海拔高山植物美丽风毛菊生理生化特性的研究
2013-08-28朱鹏锦师生波
朱鹏锦,杨 莉,师生波,韩 发
(1.广西壮族自治区亚热带作物研究所,广西 南宁 530000;2.中国科学院西北高原生物研究所,青海 西宁 810008)
1 引言
美丽风毛菊(Saussureapulchra)为多年生草本植物,主要分布于青海、西藏和甘肃等部分地区,生长在海拔1900~4600m的山坡草地、滩地、高寒草甸,是典型的高山植物[1]。其根可入药,味苦、辛,性寒,有清热解毒功效,主治流行感冒、麻疹和风疹,为青藏高原地区常见的一种药用植物[2]。青藏高原由于海拔较高,形成了寒冷、干燥、太阳总辐射高和近地面紫外线强的独特生态环境,被称为“世界第三极”,随着海拔的增加,影响植物生长发育的生态环境随之发生显著的变化[3]。因此,在高原气候的寒冷、干燥、太阳总辐射高和强紫外辐射等环境因子的综合作用下,高山植物的形态结构和生长发育受到很大的限制,迫使其不断对极端环境产生的胁迫做出生理生化方面的响应以增强适应性。有许多文献报道,低温、强紫外辐射等逆境胁迫均可造成植物体内的代谢紊乱,破坏自由基动态平衡以致细胞、组织受到损伤[4,5]。但有研究表明,植物体内的适应机制可以有效清除活性氧自由基起到减缓或者保护的作用,且抗氧化物的活力和含量与植物抗逆能力强弱有密切联系[6,7]。尽管关于逆境胁迫对植物的生长发育、形态结构和生理生化等方面的影响的研究有很多,但自然条件下以青藏高原为实验平台,研究高山植物的生理生化机制对高原气候胁迫的研究报道较少。所以,本研究以美丽风毛菊为材料探究不同海拔下高山植物的生理生化变化规律及其特征,旨在揭示高山植物适应青藏高原极端环境胁迫的抗逆机理,为筛选优良的抗逆种质资源及保护脆弱的高寒生态系统均具有重要而深远的意义。
2 材料与方法
2.1 采样地点及气候概况
美丽风毛菊分别采自青藏高原的2个不同海拔地区,其中西宁位于青藏高原东部边缘(N36°37′,E101°46′),海拔2200m,年均温为5.8℃,最冷月均温为-8.1℃,7月份月均温为20.0℃,年总辐射为612.5MJ·m-2,7月份降水量79.8mm,属高原大陆性半干旱气候;中国科学院海北高寒草甸生态系统定位站(海北)位于青藏高原的东北部,即祁连山东段的冷龙岭南麓(N37°37′,E101°19′),山地平均海拔4000m,受到明显的高原大陆性气候影响,无四季之分,仅有冷暖季之别,年平均气温-1.7℃,年平均降水量为590.1mm,降水主要集中在5~9月(占全年降水总量的80%)。年均实际日照时间为2462.7h,占理论可照时间的55.0%,年平均太阳辐射6170MJ·m-2,占太阳总辐射的60.1%。
2.2 光合色素含量的测定
选取健康无伤斑的叶片,避开主脉用打孔器(直径0.7cm)取18个叶圆片,混合均匀随机分成3组每组6片,将叶圆片分别放入装有10mL叶绿素提取液(V丙酮:V乙醇:V水=45∶45∶10)的试瓶中,密封瓶盖,密封低温保存至叶圆片无色约10d。用紫外分光光度计(UV-1601,日本)检测在663nm、645nm、440nm波长处的吸光值。叶绿素含量的测定与计算参照Arnon的方法[8],类胡萝卜素含量的测定与计算参照朱广廉的测定方法[9],光合色素以单位叶片重量的含量表示。
2.3 紫外吸收物质的测定
选叶片方法与光合色素含量测定的一样,取叶圆片混匀后随机分成3组每组6片置于10mL紫外吸收物质提取液(V甲醇:V盐酸:V水=79∶1∶20)的试瓶中,盖紧密封、避光低温保存10d至叶圆片无色。用UV-1601紫外分光光度计测量200~400nm吸收值,叶片的紫外吸收物质含量计算参照Caldwell[10],以 A/cm2表示。
2.4 抗氧化酶活性的测定
称取0.5g无病虫害的剪碎的叶组织加入5mL,62.5mmol/L pH 值7.8PBS(含0.3%PVP)和少量石英砂,在冰浴中匀浆,然后15000g,4℃低温离心10min,取上清液4℃低温保存。超氧化物歧化酶(SOD)按Giannopolitis C N等的方法测定[11],以抑制氮蓝四唑(NBT)光化还原,50%作为1个酶单位,酶活性以U/g;过氧化物酶(POD)按 Omran R G 等的方法测定[12],以(A470)每分钟OD值降低0.01为1个酶单位,酶活性以U/g表示;过氧化氢酶(CAT)按Chacne B等的方法测定[13],以每分钟OD值降低(A240的降低)来相对定量过氧化氢酶的酶活性,0.01为1个酶单位,酶活性以U/g表示。
2.5 丙二醛含量的测定
按照Raeri的方法进行测定[14],用UV-1601紫外分光光度计测量上清液450nm,532nm和600nm吸收值,具体计算如下:
MDA浓度(μmol/L)=6.45×(OD532-OD600)-0.56×OD450
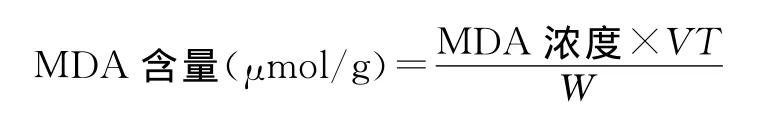
式中VT 为酶提取液体积(mL);W 为样品鲜重(g)。
2.6 数据分析
实验数据用SPSS16.0统计分析软件进行统计分析并选用LSD进行显著性检验。数据为5次以上重复的平均值,不同小写字母表示显著差异性(p<0.05)。
3 结果与分析
3.1 不同海拔美丽风毛菊叶片光合色素含量的变化
在植物光合作用过程中,叶片的光合色素涉及光能的吸收、能量传递和转化,是客观反映其利用光能的重要指标,也是作为判断植物光合生理能力、反映环境胁迫状况的重要指标[15,16]。本实验发现生长于不同海拔的美丽风毛菊叶片中的光合色素含量有着明显差别(表1)。随着海拔的升高,Chla和Chlb均呈现出下降的趋势,而Car、Chla/Chlb和Car/Chla+b的比值则呈现出增加的趋势,这可能与海北地区海拔较高且气候寒冷多变有关。叶绿素含量的下降,可能有利于减少叶片对光的吸收,使植物免受强辐射的损伤;类胡萝卜素的增加可以对强近地面UV-B辐射和高太阳辐射的胁迫起到促进过剩光能耗散的作用,避免强光对光合机构破坏。
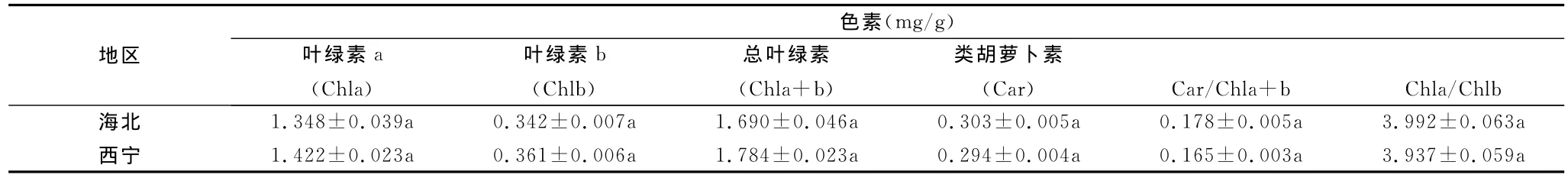
表1 不同海拔美丽风毛菊叶片光合色素含量的变化
3.2 不同海拔美丽风毛菊抗氧化酶活性的比较
植物在受到逆境胁迫时,其生理生化代谢发生紊乱以致产生多种自由基,而体内抗氧化酶系统中的超氧化物歧化酶(SOD)可将超氧阴离子O-2歧化为 H2O2和O2;过氧化物酶(POD)能将H2O2和有机的氢过氧化物等底物转变成无毒性物质;过氧化氢酶(CAT)再把H2O2催化生成H2O从而减少体内自由基[17]。本研究结果发现,随着海拔的升高美丽风毛菊的抗氧化酶SOD、POD和CAT的活性也出现增强的趋势,其中生长在海北地区的美丽风毛菊体内超氧化酶歧化酶(SOD)活性比生长在西宁地区的高且具有显著性差异(表2)。

表2 不同海拔美丽风毛菊抗氧化酶活性的比较
3.3 不同海拔美丽风毛菊叶片紫外吸收物质和丙二醛含量的比较
植物体内的丙二醛(MDA)是细胞中活性氧代谢失衡,导致产生过量的自由基作用于生物膜的多不饱和脂肪酸发生过氧化反应的产物,其含量的多少可以反映逆境对其膜受到损伤程度的大小[18]。本研究结果表明,美丽风毛菊叶中膜脂过氧化产物的含量随海拔升高呈增加趋势,其中生长在海北地区的叶片MDA含量较高,但两地差异不显著。还有植物体内的次生代谢产物(黄酮类和酚醛类等化合物)对青藏高原地区强近地面UV-B辐射和高太阳辐射具有明显的吸收作用,这种生理生化特性是植物响应环境和自我保护的机制。在研究中,也发现不同海拔的美丽风毛菊叶片的紫外吸收物质含量存在差异并且随着海拔的升高而增加,但无显著性(表3)。

表3 不同海拔美丽风毛菊叶片丙二醛和紫外吸收物质含量的比较
4 讨论
青藏高原海拔较高,空气稀薄以及上空臭氧总量低于同纬度的地区,导致到达近地面的UV-B辐射增加,形成了独特的生态环境,是研究植物对极端环境的响应和适应性的理想实验平台[19]。在极端环境的各种胁迫因子相互“耦联”作用下,植物不仅通过改变叶片形态、调整叶片角度、增加叶表蜡质层和微绒毛反射部分太阳辐射而有效避免强光和紫外线造成的损伤,还从生理生化过程中作出一系列的调整以适应寒冷和干旱的胁迫,尤其是植物体内的一些次生代谢产物和抗氧化酶系统,能清除活性氧自由基,维持细胞中活性氧代谢的平衡[20~22]。但在青藏高原地区低温和强辐射等环境因子胁迫均能引起植物生理代谢的失衡,活性氧自由基含量积累,导致膜系统、蛋白质和核酸等大分子的破坏,以致植物的生长发育和生殖繁衍产生深远的负面影响[23~25]。然而,高山植物虽然生长于恶劣的环境条件下,但其光合作用等生命过程并未明显减弱,而呈现出很强的适应性,这可能与其体内的抗氧化系统的保护有很大关系[26,27]。
美丽风毛菊在青藏高原一定海拔范围内出现垂直分布,是一种多年生的高山植物。本研究结果不仅发现,随着海拔的升高,美丽风毛菊叶片中的膜脂过氧化而产生的MDA含量升高,杨景宏等研究紫外线-B辐射对作物小麦叶绿体膜组分和膜流动性的影响,发现UV-B辐射诱导小麦叶片中MDA含量升高是膜脂发生过氧化导致叶绿体膜系统受破坏造成的;罗丽琼等[28]以云南报春花为材料研究了在不同海拔地区UV-B辐射对其叶片中丙二醛、蛋白质含量的影响也得出了相似的结果,这说明随着高海拔升高近地面UV-B辐射增强植物受到胁迫致使质膜发生过氧化损伤更为严重。我们的研究还发现,随着海拔的升高美丽风毛菊叶片中的叶绿素含量出现降低的趋势而构成比例却相反,叶绿素含量的降低可能是减少光能的吸收防止因光能过剩而发生光破坏现象,Car含量增加和Car/Chl比值升高可以促进非光化学猝灭耗散过剩光能起到光破坏防御的功能,这些变化可能是植物光合生理对青藏高原地区高太阳辐射、强紫外线等独特环境的响应和自我保护的机制。
张红霞等以蚕豆为研料研究不同强度UV-B辐射对蚕豆幼苗生长发育的影响,结果表明UV-B辐射降低叶绿素a、b及总叶绿素含量[29]。且我们的研究还发现美丽风毛菊的SOD、POD和CAT活性也随着海拔的升高而增加,其中两个不同海拔地区相比,海北地区的美丽风毛菊的SOD活性较高且具有显著差异。通常认为SOD是细胞抗氧化胁迫的关键酶,其活性的升高有利于低温、强UV-B辐射等逆境因子胁迫产生的O2等活性氧自由基的清除,与此同时的叶片中POD和CAT活性也升高,有利于细胞中进一步对H2O2的清除。李惠梅等以不同海拔的麻花艽为材料研究结果也发现类似的现象[29]。此外,美丽风毛菊叶片中的紫外吸收物质含量也随着海拔的升高而呈现增加的趋势。有许多研究结果证明,植物叶片表皮细胞含有一些类黄酮和酚醛类化合物能大量吸收UV-B辐射改变穿透率起到保护作用[30]。有诸多学者认为植物受到UVB辐射后体内类黄酮明显增加,且这些类黄酮化合物在紫外线的波长范围内具有吸收作用,从而可减少UVB辐射对核酸、蛋白质等大分子的破坏作用,形成保护自我保护机制,如叶蜡中的黄酮类化合物为游离状态,表现为O-甲基化和亲脂性等特性,这使化合物紫外吸收特性偏向更短的波长范围,以至于在230~320nm处具有明显的特异吸收短波长紫外线的能力,从而保护植物叶片免遭紫外线伤害[31];还有类黄酮可以直接清除自由基(羟自由基、氧自由基),如植物体内4-羟基黄酮等转变成保护性黄酮清除氧化自由基。
5 结语
随着海拔升高极端环境胁迫压力增加,美丽风毛菊从生理生化方面做出了适应性响应,首先通过增加叶片表皮细胞中的紫外吸收物质含量滤除UV-B辐射以减少机体损伤,同时抗氧化酶系统之间可能存在一定的协同关系通过增强抗氧化酶活性清除低温、强近地面UV-B辐射等胁迫产生的自由基以维持机体代谢的平衡,这种协同作用可能是美丽风毛菊适应高山环境胁迫的重要生理机制之一。
[1]刘尚武.青海植物志[R].西宁:青海人民出版社,1999.
[2]刘永昌,刘海青.青海省风毛菊属药用植物资源的初步调查[J].中国民族民间医药杂志,2001,52(1):289~289.
[3]潘红丽.海拔梯度上的植物生长与生理生态特性[J].生态环境学报,2009,18(2):722~730.
[4]巫光宏.低温胁迫对马占相思树代谢的影响研究[J].林业科学研究,2001,14(6):633~640.
[5]朱鹏锦.植物对UV-B辐射胁迫响应的研究进展[J].热带生物学报,2011,2(1):89~96.
[6]江福英,李 延,翁伯琦.植物低温胁迫及其抗性生理[J].福建农业学报,2002,17(3):190~195.
[7]王海霞.植物对增强UV-B辐射的防御机制研究进展[J].西北植物学报,2007,27(7):1491~1497.
[8]Arnon D I.Copper enzymes in isolated chloroplasts[J].Polyphenoloxidase in Beta vulgaris.Plant Physiology,1949,24(1):126~138.
[9]朱广廉.植物生理实验[M].北京:北京大学出版社,1990.
[10]Caldwell M M,Solar ultraviolet radiation as an ecological factor for alpine plants[J].Ecological Monographs,1968,38(3):243~268.
[11]Giannopolitis C N and S K Ries.Superoxide Dismutases:II.Purification and Quantitative Relationship with Water-soluble Protein in Seedlings[J].Plant Physiology,1977,59(2):315~318.
[12]Omran R G,Peroxide levels and the activities of catalase,peroxidase,and indoleacetic acid oxidase during and after chilling cucumber seedlings[J].Plant physiology,1980,65(2):407~408.
[13]Chance B and A Maehly,Assay of catalases and peroxidases[J].Methods in enzymology,1955(2):764~775.
[14]Ranieri Glutathione-ascorbic acid cycle in pumpkin plants grown under polluted air in open-top chambers[J].Journal of plant physiology,1993,142(3):286~290.
[15]Matsubara S,Lutein epoxide cycle,light harvesting and photoprotection in species of the tropical tree genus Inga.Plant[J].Cell & Environment,2008,31(4):548~561.
[16]张守仁.叶绿素荧光动力学参数的意义及讨论[J].植物学通报,1999,16(4):444~448.
[17]Yannarelli G G.Heme oxygenase up-regulation in ultraviolet-B irradiated soybean plants involves reactive oxygen species[J].Planta,2006,224(5):1154~1162.
[18]Treutter D,Significance of flavonoids in plant resistance and enhancement of their biosynthesis[J].Plant Biology,2005,7(6):581~591.
[19]莫申国.青藏高原的主要环境效应[J].地理科学进展,2004,23(2):88~96.
[20]戴怡龄.寒区不同海拔橘黄罂粟叶片结构特征的比较研究[J].西北植物学报,2004,24(3):495~503.
[21]梁 滨,周 青.UV-B辐射对植物类黄酮影响的研究进展[J].中国生态农业学报,2007(3):191~194.
[22]左园园.短期增强UV-B辐射对青榨槭幼苗生理特性的影响[J].应用生态学报,2005(9):1682~1686.
[23]陈 拓,安黎哲.UV-B辐射对蚕豆叶膜脂过氧化的影响及其机制[J].生态学报,2001,21(4):579~583.
[24]冯国宁.增强UVB辐射对菜豆蛋白质代谢的影响[J].植物学报,1999(8):833~836.
[25]强维亚.增强UV-B辐射对大豆胚轴DNA损伤、修复和蛋白质含量的影响[J].生态学报,2004(4):852~856.
[26]姚晓芹,刘 庆.陆生植物体内酶系统对UV-B辐射增强的响应[J].应用生态学报,2006(5):939~942.
[27]董新纯.增强UV-B条件下类黄酮与苦荞逆境伤害和抗氧化酶的关系[J].山东农业大学学报:自然科学版,2006(2):157~162.
[28]罗丽琼.低纬高原地区UV-B辐射对报春花丙二醛、蛋白质含量的影响[J].广西植物,2008(1):130~135.
[29]张红霞,吴能表,洪 鸿.不同强度的UV-B辐射对蚕豆种子萌发及幼苗生长的影响[J].西南大学学报:自然科学版,2008(8):132~136.
[30]李惠梅,师生波.增强UV-B辐射对麻花艽叶片的抗氧化酶的影响[J].西北植物学报,2005(3):519~524.
[31]李 鹏.抗UV-B辐射植物黄酮类化合物研究进展[J].生态学杂志,2001(6):36~40.
[32]林植芳.亚热带植物叶片UV-B吸收化合物的积累[J].生态学报,1998(1):90~95.
