贵州酥李离体快繁技术研究
2013-08-27韩晓莹
韩晓莹,陈 红*
(1.贵州省果树工程技术研究中心,贵州 贵阳 550025;2.贵州大学 农学院,贵州 贵阳 550025)
酥李又名冰脆李,是蔷薇科李属植物,属于中国李,其果实色绿、质脆、味甜,遗传多样性较高,为地方良种之一[1]。对于李属植物的组织培养,国内外已有报道[2-4],而对中国李的研究较少,尤其是对贵州酥李此方面的研究,至今未见报道。贵州自然灾害频繁,资源管理粗放,许多种于房前屋后,易造成特异资源的流失。因此,本文以贵州优良李资源酥李为材料,探讨建立组培快繁体系的适宜条件,为李资源的超低温保存及种质资源创新利用提供参考。
1 材料与方法
1.1 材料
供试材料取自贵州大学李种质资源圃5年生酥李半木质化枝条。试验于2011年5月—2012年5月在贵州省果树工程技术研究中心进行。
1.2 方法
1.2.1 外植体灭菌时间的筛选 取当年生半木质化枝条,保留小段叶柄,用流水冲洗1 h。消毒时将材料置于体积分数75%酒精中浸泡30 s,再用1 g/L HgCl2消毒不同时间(6,8,10,12,14 min),用无菌水冲洗3~5次后,将材料切成单芽或多芽茎段接种于培养基中。
1.2.2 初代诱导培养植物生长调节剂浓度的筛选 以WPM为基本培养基,分别添加不同质量浓度的6 -BA(0.5,1.0,2.0 mg/L)、NAA(0.05,0.1 mg/L)、KT 0.5 mg/L 进行初代培养。每个外植体带 1 ~2个腋芽。
1.2.3 增殖培养植物生长调节剂浓度的筛选 以初代培养诱导的芽为外植体,接种到以WPM为基本培养基,添加有不同质量浓度的 6 -BA(0.5,1.0 mg/L)、NAA(0.05,0.1 mg/L)、KT(0.5,1.0 mg/L)、IBA(0.05,0.1,0.2,0.3 mg/L)的增殖培养基上进行增殖培养。
1.2.4 生根培养基筛选与移栽 将生长健壮的芽苗接种到1/2 MS+0.4 mg/L IBA+15 g/L蔗糖和WPM+0.5 mg/L KT+0.05 mg/L IBA+15 g/L蔗糖的培养基上进行生根培养。生根后2个月,将植株取出洗净根部培养基,浸入1 g/L KMnO4溶液中消毒10 s,移栽至已灭菌的营养土中。
1.2.5 培养条件 在进行初代、增殖培养时,培养基附加蔗糖30 g/L、琼脂7 g/L,pH5.8,121℃灭菌15 min。接种后置于培养室内,每天光照14~16 h,光照强度2 000~3 000 lx,培养温度(25±1)℃。
1.2.6 数据统计与处理 用DPSv7.05软件进行数据处理。

外植体接种1个月后统计污染率、褐化率及萌发率;新梢增殖培养1个月后统计增殖倍数和生长情况;试管苗诱导生根后两周统计生根情况及移栽成活率。
2 结果与分析
2.1 外植体的消毒效果
从表1可知,消毒时间对外植体污染率、褐化率、萌发率有显著的影响,随着消毒时间的延长,污染率和萌发率均呈下降趋势。酥李茎段用1 g/L HgCl2消毒6 min时,萌发率达96.3%,污染率也高达92.8%。而消毒14 min时,污染率虽只有19.88%,但萌发率也仅19.9%。综合比较,适宜的外植体消毒时间为1 g/LHgCl2处理8 min。
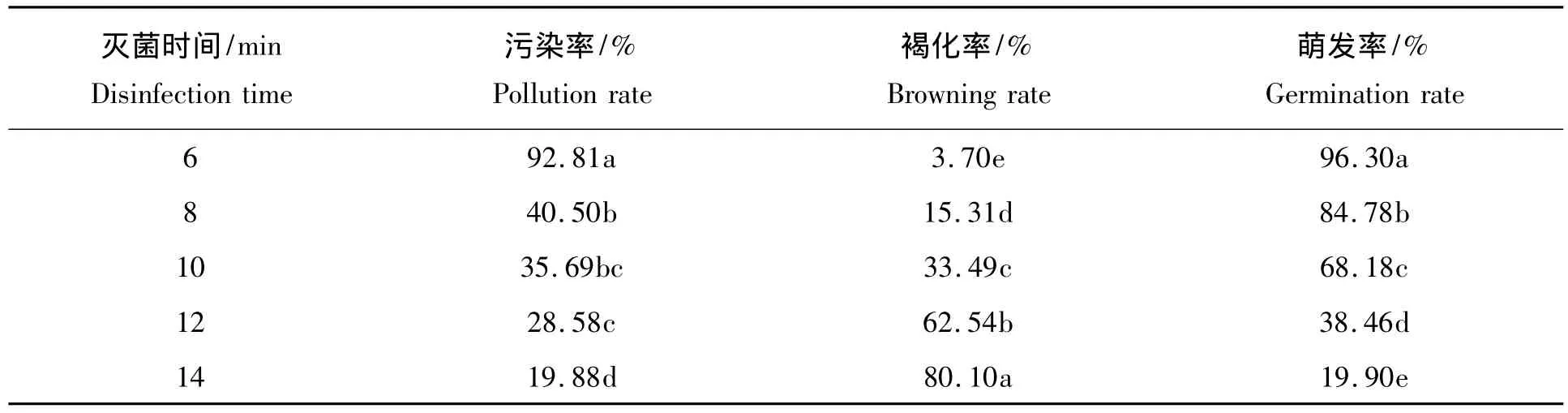
表1 不同消毒时间对酥李茎段的影响Tab.1 Effect of different disinfection time on bud stems of crisp plum
2.2 不同植物生长调节剂浓度配比对初代诱导的影响
不同质量浓度的细胞分裂素对酥李腋芽诱导效果不同,在一定范围内,随着细胞分裂素质量浓度的增加,酥李腋芽诱导率不断增加。由表2可知,当细胞分裂素6-BA为1.0 mg/L、生长素NAA浓度为0.1 mg/L时,酥李腋芽诱导率达最高为96%,诱导出的腋芽生长健壮,叶色浓绿(图版-A);但当6-BA为2.0 mg/L时,腋芽诱导率有所降低,此时腋芽长势较差,叶色发黄,逐渐脱落,大部分出现玻璃化苗,已不适合李腋芽诱导。因此,培养基WPM+1.0 mg/L 6-BA+0.5 mg/L KT+0.1 mg/L NAA比较适合酥李腋芽诱导。

表2 植物生长调节剂对酥李腋芽生长的影响Tab.2 Effects of different plant growth regulators combination on buds growth of crisp plum
2.3 植物生长调节剂质量浓度对芽苗增殖和生长的影响
将萌发的新梢剪下并接种到WPM培养基上,配合不同质量浓度的细胞分裂素和生长素进行试验(表3)发现,酥李在细胞分裂素6-BA、生长素NAA的培养基中生长不良,叶脉间失绿,叶片逐渐变黄脱落。而在细胞分裂素为1.0 mg/L KT、生长素0.1 mg/L IBA的培养基上,植株生长健壮,叶色浓绿,增殖倍数达3.5。当KT为1.0 mg/L时,随着IBA质量浓度的升高,芽诱导率下降,当浓度为0.3 mg/L时,增殖倍数仅有 1.17。同时,设置不同浓度的 GA3,即 0.0,0.1,0.2,0.5,1.0,2.0 mg/L,观察试管苗的生长状况。从试管苗的长势和增殖情况看,1.0 mg/L的GA3为最佳。故适宜增殖培养基配方为WPM+1.0 mg/L KT+0.1 mg/L IBA+1.0 mg/L GA3(图版 -B)。
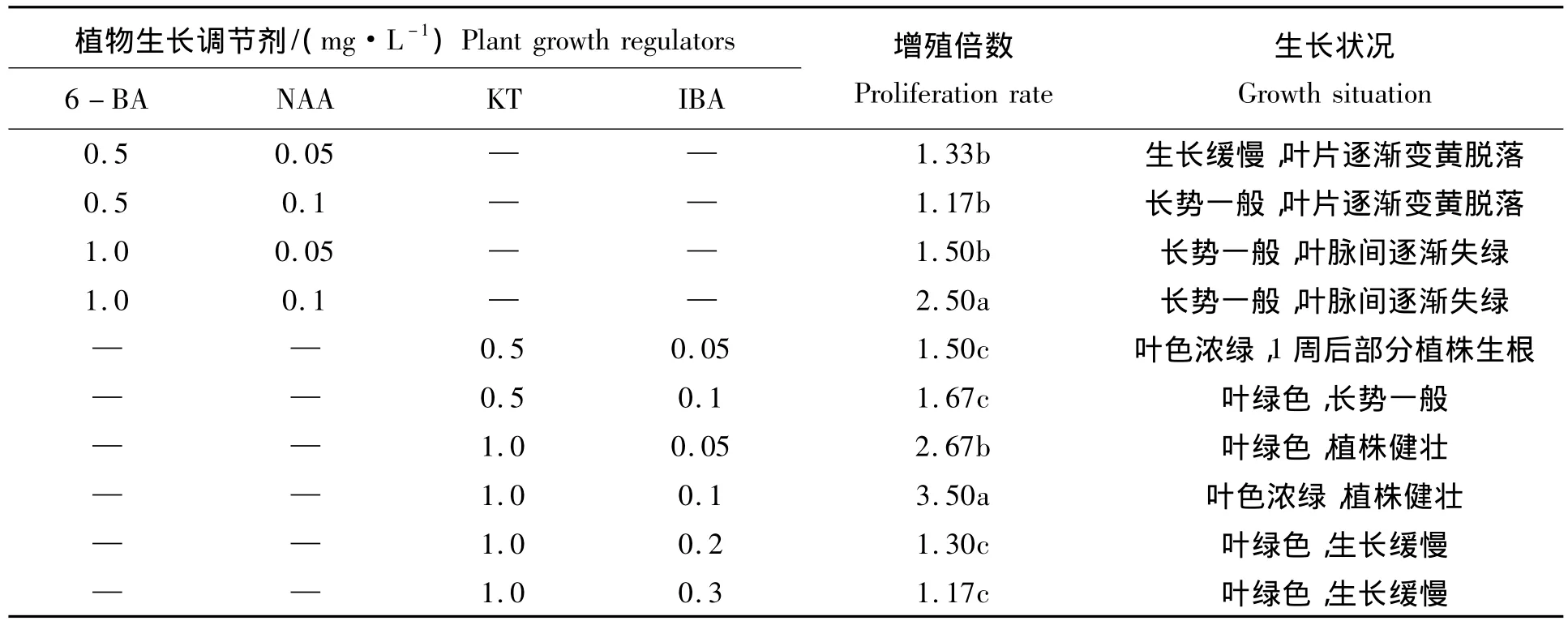
表3 植物生长调节剂对增殖倍数的影响Tab.3 Effects of different plant growth regulators combination on buds proliferation of crisp plum
2.4 不同基本培养基及植物生长调节剂对生根的影响
当新梢长至2 cm以上时,选取生长健壮的试管苗,转接到生根培养基上进行诱导生根。结果表明,采用1/2MS+0.4 mg/L IBA的培养基生根效果较好(图版-C),生根率为95%,平均生根数达9.5条,与另一处理的平均生根数存在显著差异,且不经愈伤组织从新稍基部直接发出不定根。而在WPM+0.5 mg/L KT+0.05 mg/L IBA的培养基中,生根显著推迟且根条数明显减少。选取根系发达的生根苗植株,移出洗去根部培养基,栽入无菌营养土中,温室锻炼30 d,移栽成活率达90%以上(图版-D)。

表4 不同基本培养基及植物生长调节剂对生根的影响Tab.4 Effects of different media and plant growth regulators combination on rooting of crisp plum

图版A:腋芽诱导芽苗生长良好;B:芽苗增殖生长;C:生根;D:移栽至温室1个月后的生长情况。Plates A:Induction of axillary buds and vigorous growth;B.Proliferation of buds;C:Roots of crisp plum;D.Transplant to greenhouse after one month situation.
3 讨论
外植体消毒是植物组织培养过程中极为重要的步骤。消毒时间过长,材料生活力弱,褐化、死亡严重,进一步影响萌发。反之,时间过短消毒不彻底,造成外植体接种后未萌发就污染,成活率也低。故置于体积分数75%酒精内浸30 s,1 g/L升汞溶液处理8 min为宜。另外,木质化程度高的外植体,消毒越不容易,污染越严重。同时,本试验还发现,不同取材季节对消毒处理后的萌发率也有很大影响。
本文又以MS为基本培养基进行试验,发现新梢在两种基本培养基上生长状况差异显著。在WPM基本培养基上,新梢增殖倍数高,叶色浓绿,植株生长健壮。而在MS培养基上长势不佳,叶片变黄脱落,节间不伸长,说明此培养基不适合酥李的增殖培养。故新梢在WPM培养基上生长较好。分析两种培养基中大量元素的含量,可能是因为WPM培养基中N的质量浓度较低、Ca的质量浓度升高的原因。相较之下,WPM更适合中国李的组织培养,这与前人[5-6]的研究结果一致。
植物生长调节剂在植物生长发育过程中起到调节作用,而不同种类和浓度的组合对植物增殖的效果明显不同[7]。有关结果表明,培养基中植物生长调节剂类型、浓度和组合决定了组织、器官的发育和分化方向,当生长素与细胞分裂素比值低时有利于长芽,比值高时有利于长根,中间比值有利于愈伤组织的诱导和分化[8-10]。同时,在培养基中加入细胞分裂素能够促进细胞分裂和增殖[11-13]。在茎尖培养中,许多研究者都加入GA3,以促进茎尖的萌发和伸长,提高茎尖培养成苗率[14]。本试验发现,GA3对植株节间的伸长起重要作用,但质量浓度不宜过高。过高,植株生长迅速,却纤细瘦弱;过低,对植株无明显影响,生长健壮但节间不伸长。因此,培养基中适宜的GA3为1.0 mg/L。但是,在陈君帜等[15]的试验研究中,观察到加入GA3对促进成苗并无很大影响,质量浓度高了反而会降低成苗率,这可能是因为不同树种及不同基因型所需激素的种类和质量浓度不同。
培养基及生长素种类、质量浓度是影响生根的主要因素。浦艳吉等[16]采用1/2MS+1.0 mg/L IBA培养基,发现欧洲李和樱桃李的生根率分别达到98.3%和94.1%。赵艳华等[17]用1/2MS+0.3 mg/LIAA+0.3 mg/L IBA培养基对李新梢进行生根培养,生根率达95%以上。孙新政等[18]钙果4号欧李在1/2MS+1.0 mg/LIBA+0.02 mg/L KT中生根率高达100%。本试验采用1/2MS、WPM为基本培养基进行生根培养。试验发现,新稍在两种基本培养基上的生根率无显著差异,但生根条数差异显著,且在1/2MS+0.4 mg/L IBA上生根效果较好,生根率达95%,根条数较多,利于移栽。虽然1/2MS和WPM中N的含量相差不大,但是不同的植物生长调节剂对植物生根的效果不同。综合比较,酥李的适宜生根培养基为1/2MS+0.4 mg/L IBA+1.5%蔗糖。试验证明诱导酥李生根容易,根生长良好。
致谢:陈红副教授对本文的撰写、修改给予了悉心指导,周金忠同学在试验过程中给予了帮助,谨致谢意!
[1]罗福贤.黔南山区李种质资源果实形态分类及开发利用[J].贵州农业科学,1996(3):39-42.
[2]孙在红,夏阳,梁慧敏,等.紫叶李组织培养及快繁体系的建立[J].草原与草坪,2005(1):58-61.
[3]Barbara N,Kazimierz M,Ludwik H.Sugar uptake and utilisation during adventitious bud differentiation on in vitro leaf of‘Wegierka Zwykla’plum(Prunus domestica)[J].Plant Cell Tissue and Organ Culture,2004,76:255 -260.
[4]任清盛.钙果(欧李)组织培养技术研究[J].中国农学通报,2005,21(1):53-54.
[5]邹英宁,李国怀,吴强盛.中国李组织培养过程中褐变的抑制研究[J].山地农业生物学报,2007,26(6):508-512.
[6]Emershad R L,Ramming D W.Effects of media on embryo enlargement,germination and plant development in early-ripening genotypes of Prunus grown in vitro[J].Plant Cell Tissue and Organ Culture,1994,37:55 -59.
[7]许建兰,马瑞娟,余明亮,等.Damas 1869 李组培繁殖技术研究[J].果树学报,2008,25(5):740-743.
[8]王玉英,顾晓红,高新一.6-BA和IAA对葡萄试管苗快速繁殖的影响[J].中国农业科学,1988(3):94-95.
[9]裴东,郑均宝,凌艳荣,等.红富士苹果试管培养中器官分化及其部分生理指标的研究[J].园艺学报,1997,24(3):229-234.
[10]Fouad M M,Gomaa A H,Abd El Zahar M H.Factors influencing rooting of peach shoots culture in vitro[J].Acta Horticulturae,1995,409:197-202.
[11]Te-chato S,Hilae A,In-Peuy K.Effects of cytokinin types and concentrations on growth and development of cell suspension culture of oil palm[J].Journal of Agriculture Technology,2008,4:157 -163.
[12]Canli F A,Tian L.Regeneration of adventitious shoots from mature stored cotyledons of Japanese plum(Prunus salicina Lind1)[J].Scientia Horticulturae,2009,120:64 -69.
[13]Matt A,Jehle J A.In vitro plant regeneration from leaves and internode sections of sweet cherry cultivars(Prunus avium L.)[J].Plant Cell Rep,2005,24:468 -476.
[14]胡博然,徐文彪.中国李离体繁殖的研究[J].宁夏大学学报,1999,20(4):368 -370.
[15]陈君帜,李青,孙钊.中国樱桃半野生种对樱的茎尖培养[J].园艺学报,2003,30(3):317-318.
[16]浦艳吉,李国怀,姚延兴,等.李茎尖离体培养与植株再生[J].华中农业大学学报,2009,28(2):214-217.
[17]赵艳华,程和禾,吴雅琴,等.李离体茎尖组培快繁试验[J].河北果树,2009(3):12-13.
[18]孙新政,申顺先,李庆伟,等.钙果4号欧李组织培养技术研究[J].果树学报,2007,24(1):80- 83.
