耐盐性不同的大豆品种幼苗的蛋白质组学比较研究
2013-08-27徐晓燕
徐晓燕,唐 迪
(1.南京农业大学 大豆研究所,江苏 南京 210095;2.江苏农林职业技术学院 基础部,江苏 句容 212400)
农业生产和生态环境严重地受到土壤盐渍化的影响,据估计全球有20%的灌溉土地受盐害威胁[1]。而且次生盐碱化土壤面积有不断加剧的趋势,给农业生产造成了重大的损失。由于蒸腾作用和毛细管作用,盐碱地表层土壤中更容易积累盐分,因此种子萌发和幼苗早期生长更易受到盐害[2],种子在盐碱地表层土壤中顺利萌发是幼苗生长的先决条件。萌发,从狭义上讲,是指种子吸水后,胚轴伸长胚根突破种皮[3]。
大豆(Glycine max L.)作为油料作物和经济作物,在食品工业和农业生产中占重要地位。栽培大豆属于盐敏感植物,提高大豆的耐盐性是大豆抗性育种的重要课题之一。但目前对不同抗性大豆品种的蛋白质差异的分子遗传基础仍然知之甚少。蛋白质组学技术为遗传分析(如种内,种间遗传差异)提供了准确的手段,其核心技术包括双向电泳技术(2-dimensional gel electrophoresis,2-DE)和质谱技术(mass spectrometry,MS)[4]。李春梅等[5]运用蛋白质组学技术研究野生大豆与栽培大豆种子蛋白的差异鉴定出5个蛋白,主要是与大豆抗性、抗营养以及种子萌发相关的蛋白质。宋浩等[6]通过对不同烟草青枯病抗性品种的蛋白质组学比较,鉴定出22个蛋白,并推测其中2个可能与烟草对青枯病的抗病性密切相关。
Lee68是世界公认的大豆耐盐品种,N2899是本实验鉴定出的盐敏感品种。本研究运用蛋白质组学方法在整体水平上比较了Lee68和N2899大豆萌发期幼苗的蛋白表达的差异,鉴定出与抗性和品种相关的蛋白,为用遗传工程的方法改良大豆的耐盐性提供依据。
1 材料与方法
1.1 试验材料
1.1.1 研究材料 大豆种子N2899、Lee68,由国家大豆改良中心种质资源研究室提供。
1.1.2 主要试剂 硫脲、甘氨酸、尿素、碘乙酰胺、三氨基甲烷、十二烷基磺酸钠(SDS)、低熔点琼脂糖、甲叉双丙烯酰胺、丙烯酰胺、二硫代苏糖醇(DTT)、碘乙酰胺为AMRESO分装;载体两性电解质(pH3-10)、IPG预制胶条等均为Bio-Rad公司产品;蛋白酶抑制剂为Sigma公司产品;α-氨基-4-羟基肉桂酸(CCA)、胰蛋白酶、三氟乙酸(TFA)为Roche公司产品。过硫酸铵、三氯乙酸(TCA)等为国产分析纯。
1.2 试验方法
1.2.1 不同萌发时期大豆种子样品的准备 选取干燥度一致、饱满、种皮色泽正常的种子,经1 g/LHgCl2溶液浸没消毒2 min后用纯水漂洗6次之后,置于18 mL纯水、垫有双层9 cm定性滤纸的玻璃培养皿中,每皿30粒,盖上盖,25℃恒温光照培养箱中避光发芽。随机选取了胚根突破种皮2~3 mm的种子为幼苗。
1.2.2 大豆幼苗可溶性蛋白2-DE样品制备 用三氯乙酸/丙酮沉淀法,方法参照郑蕊等[7]。蛋白质浓度的测定参照 Bradford[8]。
1.2.3 幼苗可溶性蛋白的双向电泳(2-DE) 上样量1 mg蛋白,每个样品重复3次,方法参照李春梅等[5]的报道。
1.2.4 考马斯亮蓝染色 ddH2O洗后,12%TCA固定2 h后。ddH2O洗,体积分数为20%甲醇,1.6%磷酸,8%硫酸铵和0.08%考马斯亮蓝-G250染色16~24 h,ddH2O漂洗脱色。
1.2.5 2-DE图像分析 2-DE胶用Bio-Rad公司VersaDoc 3000凝胶成像系统进行扫描,PDQuest软件进行背景消减、斑点检测、匹配、分子量和等电点计算及蛋白质点量值的标准化分析等图像的分析处理。
1.2.6 差异表达蛋白点的质谱分析及鉴定 用基质辅助激光解析电离飞行时间质谱(MALDI-TOFMS)进行差异表达蛋白的质谱分析,方法参照李春梅等[5]。质谱数据的数据库搜索参照Hajduch等[9]。
2 结果与分析
2.1 Lee68和N2899幼苗的双向电泳图谱
通过双向电泳技术得到Lee68和N2899大豆萌发期幼苗的蛋白质2-DE图谱(图1)。在pH 4~7,分子量10~116 ku,样品经考马斯亮蓝染色,PDQuest软件分析2-DE图谱,Lee68和N2899分别平均检测到665和654个蛋白质点。从图1中可以看出,蛋白质在横向和纵向都得到了较好的分离。同时用软件分析得到Lee68和N2899的2-DE图谱之间的蛋白质点相关系数(correlation coefficient)为0.812,表明Lee68和N2899幼苗之间的主要蛋白质组成比较一致。在2-DE胶上为了准确地反映蛋白质点量的变化,每个点的量均表示为相对的量,即一个蛋白质点的量占该胶内所有蛋白质点总量的比。PDQuest软件分析各个蛋白质点相对量在Lee68和N2899中的差异表达,其中质量较好、重复性高、表达量变化超过2倍以上的蛋白质点有52个。选取6个蛋白点做MALDI-TOF-MS分析,各蛋白质点的相对丰度如图2。其中5个蛋白质点(Spot1、Spot2、Spot4、Spot5和Spot6)在Lee68中表达量较高,而Spot3在N2899中表达量较高。

图1 Lee68和N2899萌发期幼苗的双向电泳图谱Fig.1 2-DE maps of the Lee68 and N2899 seedlings
2.2 差异表达蛋白的 MALDITOF-MS分析及数据库检索
将这6个蛋白质用MALDITOF-MS分析,以基质峰、酶自动降解片段峰进行校正,去除角蛋白峰和胰酶自切峰,精确标定强度为基质峰强度2倍以上的峰,6个点均获得肽质量指纹图谱(PMF),PMF数据用 MS-Fit搜索大豆UniGene库初步鉴定出4个大豆,鉴定结果如表1。

图2 6个差异蛋白点的相对量变化Fig.2 Histograms showing the volume changes of 6 differentially expressed spots
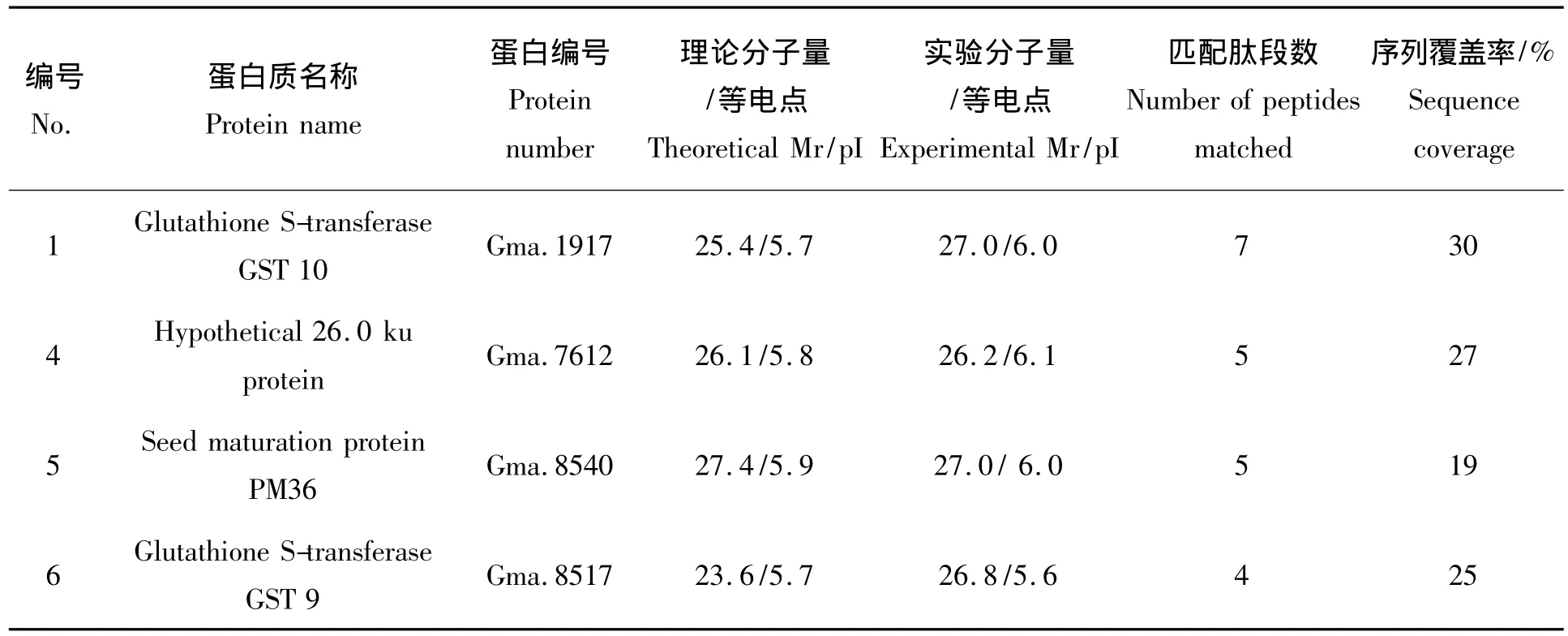
表1 差异表达蛋白PMF数据库检索的鉴定结果Tab.1 Differentially expressed proteins identified by PMF query
3 结论
种子在高等植物的生命周期中占据核心地位,种子萌发是幼苗生长的先决条件,是植物丰产的基础。本研究运用蛋白质组学方法从整体水平上比较了耐盐品种Lee68和盐敏感品种N2899大豆萌发期幼苗的蛋白表达的差异,所鉴定的蛋白主要与抗性相关。发现与抗逆性相关的蛋白质(Spot1、Spot5、Spot6)在耐盐大豆Lee68中表达量较高。Spot3在盐敏感品种N2899中大量表达,但未能鉴定出该蛋白。Spot4通过数据检索其为26 ku蛋白质,但具体是何蛋白尚不清楚,有待后续进一步研究。
Spot1、Spot6分别被鉴定为谷胱甘肽S-转移酶10(GST 10)、谷胱甘肽S-转移酶9(GST 9)。植物中GSTs由多基因家族编码,大豆中已克隆到25条序列全长,GST的活性受氧化损伤的诱导[10]。谷胱甘肽S-转移酶对植物抵御逆境胁迫和解除细胞毒素起着重要作用。王臻昱等[11]从野大豆盐碱胁迫基因表达谱中筛选并克隆得到GST 19基因,将其导入苜蓿,研究发现GST 19显著提高了转基因苜蓿的耐盐碱性。Ji等[12]将从野生大豆盐碱胁迫基因表达谱中筛选并克隆得到GST基因(GsGST:GQ265911)导入烟草,显著提高了转基因烟草的抗旱性和耐盐性。大量研究表明,GST能够增强植物对干旱、低温、机械损伤、盐碱胁迫等多种逆境的耐受能力。本研究中GST 9、GST 10在Lee68中的表达量均高于N2899,表明这可能与品种间抗性差异有关,Lee68存在着比较强的耐盐机制,为GST能否作为大豆的抗逆性指标提供依据。
Spots5被鉴定为种子成熟蛋白PM36。种子成熟蛋白PM36在胚胎发生后期合成和积累,在种子萌发早期被降解,其有助于种子萌发阶段幼苗的生长[13]。Skriver和Mundy[14]推测种子成熟蛋白PM36可能与部分LEA蛋白一样,在逆境条件下有保护植物细胞的作用。本研究中Lee68平均萌发时间为1.5 d,而N2899的平均萌发时间为2.1 d,种子成熟蛋白PM36在Lee68中的表达量高于N2899,可能与Lee68种子萌发更快,抗性更强相关。
当然本研究中鉴定出的差异蛋白有限,今后将借助不同的蛋白鉴定技术鉴定出更多的蛋白。并用不同盐质量浓度处理大豆萌发期幼苗,进一步研究耐盐大豆和盐敏感大豆之间的差异,为大豆耐盐性性状的改良提供有价值的基因来源。
[1]FAO.Global network on integrated soil management for sustainable use of salt-affected soils.Rome,Italy:FAO.Land andplant nutrition management service[EB/OL].(2005 -10 -12)[2012 -10 -13]http://www.fao.org/ag/agl/agll/spush.
[2]Almansouri M,Kinet J M,Lutts S.Effect of salt and osmotic stresses on germination in durum wheat(Triticum durum Desf.)[J].Plant and Soil,2001,231(2):243 -254.
[3]Bewley J D.Seed germination and dormancy[J].Plant Cell,1997,9(1):1055 -1066.
[4]Rabilloud T.Two-dimensional gel electrophoresis in proteomics:Old fashioned,but it still climbs up the mountains[J].Proteomics,2002,2(1):3 -10.
[5]李春梅,杨守萍,盖钧镒,等.野生大豆与栽培大豆种子差异蛋白质组学研究[J].生物化学与生物物理进展,2007,34(12):1296-1302.
[6]宋浩,丁伟,沙伟,等.不同烟草青枯病抗性品种的蛋白质组学比较[J].中国烟草科学,2011,32(5):70-76.
[7]郑蕊,喻德跃.适于蛋白质组研究的大豆种子蛋白双向电泳技术的改进[J].大豆科学,2005,24(3):166-170.
[8]Bradford M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Analytical Chemistry,1976,72(1):248 -254.
[9]Hajduch M,Ganapathy A,Stein J W,et al.A systematic proteomic study of seed filling in soybean:Establishment of highresolution two-dimensional reference maps,expression profiles,and an interactive proteome database[J].Plant Physiology,2005,137(4):1397 -1419.
[10]McGonigle B,Keeler S J,Lau S M C,et al.A genomics approach to the comprehensive analysis of the glutathione S-transferase gene family in soybean and maize[J].Plant Physiology,2000,124(3):1105 -1120.
[11]王臻昱,才华,柏锡,等.野生大豆GSGST 19基因的克隆及其转基因苜蓿的耐盐碱性分析[J].作物学报,2012,38(6):971-979.
[12]Ji W,Zhu Y M,Li Y,et al.Over-expression of a glutathione S-transferase gene,GSGST,from wild soybean(Glycine soja)enhances drought and salt tolerance in transgenic tobacco[J].Biotechnol Lett,2010,32(8):1173 -1179.
[13]Hsing Y C,Tsou C H,Hsu T F,et al.Tissue-and stage-specific expression of a soybean(Glycine max L.)seed-maturation biotinylated protein[J].Plant Molecular Biology,1998,38(3):481 -490.
[14]Skriver K,Mundy J.Gene expression in response to abscisic acid and osmotic stress[J].Plant Cell,1990,2(6):503 -512.
