Apelin-13对葡萄糖剥夺乳鼠心肌细胞自噬的影响及机制
2013-08-27马清华
焦 慧,张 志,马清华,付 伟
1辽宁医学院附属第三医院 心内科,辽宁锦州 121001;2辽宁医学院附属第一医院 心内科,辽宁锦州 121001
细胞自噬是真核细胞中普遍存在的生命现象,低水平自噬对心肌细胞起保护作用,而高水平或持久的自噬则加重细胞损伤导致细胞死亡。如何适时有效地抑制自噬,减轻心肌损害,已成为心血管疾病的研究热点。Apelin是Tatemoto等[1]利用反向药理学方法从牛胃分泌物中提取并纯化的孤儿G蛋白偶联受体(血管紧张素1型受体相关蛋白APJ)的内源性配体,在体内广泛分布,尤其在心血管系统高度表达,具有降低血压、改善心脏功能、减小心肌缺血再灌注损伤[2]及抑制心肌细胞凋亡[3]等多种心肌保护作用。研究发现,Apelin亚型之一Apelin-13还具有抑制心肌细胞自噬的作用[4],但其作用机制尚未得到证实。本研究通过葡萄糖剥夺建立体外乳鼠心肌细胞自噬模型,在细胞水平上观察Apelin-13对自噬的影响,进一步探讨其可能的作用机制。
材料和方法
1 主要试剂及药品 DMEM:F12(1∶1)培养基、5-溴脱氧尿嘧啶核苷(BrdU)、PBS平衡盐溶液(Hyclone公司);小牛血清(杭州四季青生物工程材料公司);胰蛋白酶(Byotime公司);Apelin-13(北京康肽生物科技有限公司),Tricribine、抗磷酸酪氨酸抗体(美国Santa Cruz公司),兔抗人β-actin抗体、兔抗人LC3抗体、兔抗人Akt抗体、兔抗人p-Akt(Ser473)抗体、兔抗人mTOR抗体及兔抗人p-mTOR(Ser2448)抗体(Cell Signaling Technology公司)。
2 心肌细胞的培养及鉴定 标本取自出生1~3 d的Sprague-Dawley(SD)乳鼠(辽宁医学院实验动物中心),无菌条件下,取出生乳鼠的心脏,用PBS平衡盐溶液清洗3次后剪成1 mm3大小,用浓度为0.06%的胰蛋白酶于37℃恒温磁力搅拌器中分次消化,每次6~10 min至消化完全,小牛血清终止消化。收集的细胞悬液以1 200 r/min,10 min离心,加入含15%小牛血清的DMEM∶F12(1∶1)培养基制成单细胞悬液,经200目筛网过滤,接种于25 cm3的培养瓶中,每组设6个平行组,置于37℃、5%的CO2培养箱中,静置90 min。吸出细胞悬液并加入0.1 mol/L的5-溴脱氧尿核苷(BrDU),混匀将细胞悬液稀释成5×105/ml的细胞密度,接种于培养瓶,继续置入培养箱中培养,每24 h换液1次。连续培养72 h后,选择生长良好、搏动规律的细胞进入实验。采用肌动蛋白单克隆抗体(α-Sarcomeric actin)进行心肌细胞鉴定。
3 实验分组及模型建立 将上述培养72 h的心肌细胞随机分为5组。1)正常对照组(Control组):在其他组不同时间加入不同干预因素时,加入与干预因素等量的培养基,然后继续按原培养基换液,培养12 h;2)葡萄糖剥夺组(GD组):细胞换液前,操作同正常对照组,然后更换不含糖的DMEM∶F12(1∶1)培养基,建立葡萄糖剥夺诱导的乳鼠心肌细胞自噬模型,继续培养12 h;3)Apelin-13预处理组(GD+Apelin-13组):培养基中加入终浓度为1μmol/L的Apelin-13预处理30 min,其后同GD组;4)Tricribine+Apelin-13预处理组(GD+Tricribine+Apelin-13组):培养基中加入终浓度为1μmol/L的Tricribine 30 min后,处理同GD+Apelin-13组;5)阻断剂组(Tricribine组):培养基中加入终浓度为1μmol/L的Tricribine 30 min后,处理同正常对照组。
4 透射电镜下观察自噬体 心肌细胞经上述处理后,吸去培养液后用PBS缓冲液轻柔洗涤3遍,细胞刮刮取细胞移入离心管,1 600 r/min离心30 min,仔细吸弃上清后得到细胞团块,3%戊二醛及1%锇酸双重固定共3 h,PBS缓冲液漂洗30 min后,乙醇、丙醇逐渐脱水,环氧树脂包埋,解剖显微镜下修块,切片厚度1μm,醋酸双氧铀和枸橼酸铅双重染色。在透射电镜下观察心肌细胞的超微结构,选取典型视野拍照。观察心肌细胞自噬体的形态及数量变化。
5 免疫沉淀脂质激酶分析法测PI3K活性 提取细胞总蛋白质,加入抗-磷酸酪氨酸抗体,孵育1 h后,加入G蛋白包被的琼脂糖珠悬液继续孵育4~12 h。充分洗涤G蛋白包被的琼脂糖珠后,再用PI3K分析缓冲液洗涤1次。经洗涤过的抗原-抗体复合物加入50μl PI3K分析缓冲液,20μl脂质底物的混合液进行预孵育,加入10μl γ32PATP混合剂进行酶反应。10 min后加入等体积终止液终止反应,用磷酸化的脂类用氯仿-甲醇(1∶1)抽提2次,进行薄层层析及放射自显影。采用FJ-2115型自动液体闪烁计数仪检测放射性活度,以正常对照组平均放射性活度为100%标准,各组之间进行比较。
6 Western-blotting法检测心肌细胞LC3、Akt、p-Akt、mTOR与p-mTOR的蛋白表达水平 所收集心肌细胞用预冷PBS洗涤2次,加入适量细胞裂解液,轻轻反复吹打混匀,冰上裂解20 min后,4℃、12 000 r/min离心20 min,取上清为总蛋白,用BCA法行蛋白定量。在各组样品中取总蛋白50μg上样,进行SDS-聚丙烯酰胺凝胶电泳,半干法行蛋白转膜,5% BSA-PBST室温封闭1 h。LC3、Akt、p-Akt、mTOR及 p-mTOR和 β-actin一抗4℃孵育过夜,二抗室温孵育1 h。经洗涤、显影、灰度扫描后,以目的条带和内参条带β-actin的灰度比值分别表示Akt、p-Akt、mTOR及p-mTOR的蛋白表达水平。LC3是自噬标志性蛋白,有Ⅰ型和Ⅱ型之分,当哺乳动物细胞自噬发生时,LC3-Ⅰ向LC3-Ⅱ转化明显增加,因此常用目的条带LC3-Ⅱ与LC3-Ⅰ的比值间接比较自噬率的多少。
7 统计学分析 采用SPSS13.0统计软件处理,计量资料以表示,多组间比较采用单因素方差分析,组间比较采用LSD检验,P<0.05为差异有统计学意义。
结 果
1 透射电镜下观察自噬体 自噬体表现为包绕废弃胞浆成分的双层膜结构,发生自噬的细胞可见损伤的细胞器如线粒体的肿胀变性等,自噬体进一步与溶酶体融合、消化,可表现为空泡样结构[5]。在相同单位视野下,GD组细胞内自噬体及空泡样结构较正常对照组明显增多;Apelin-13预处理后自噬体及空泡样结构较GD组明显减少;而Apelin-13联合应用Tricribine后,自噬体及空泡样结构较Apelin-13预处理组显著增多;单独阻断剂组与正常对照组自噬体及空泡样结构数量无明显差异,见图1。
2 LC3的表达水平 与正常对照组相比,GD组LC3-Ⅱ/LC3-Ⅰ的比值明显增加(P<0.01);与GD组相比,GD+Apelin-13组LC3-Ⅱ/LC3-Ⅰ的比值明显下降(P<0.01);与GD+Apelin-13组相比,GD+Apelin-13+Tricribine组LC3-Ⅱ/LC3-Ⅰ的比值明显增加(P<0.01);Tricribine组与正常对照组相比,LC3-Ⅱ/LC3-Ⅰ的比值差异无统计学意义(P>0.05),见图2。
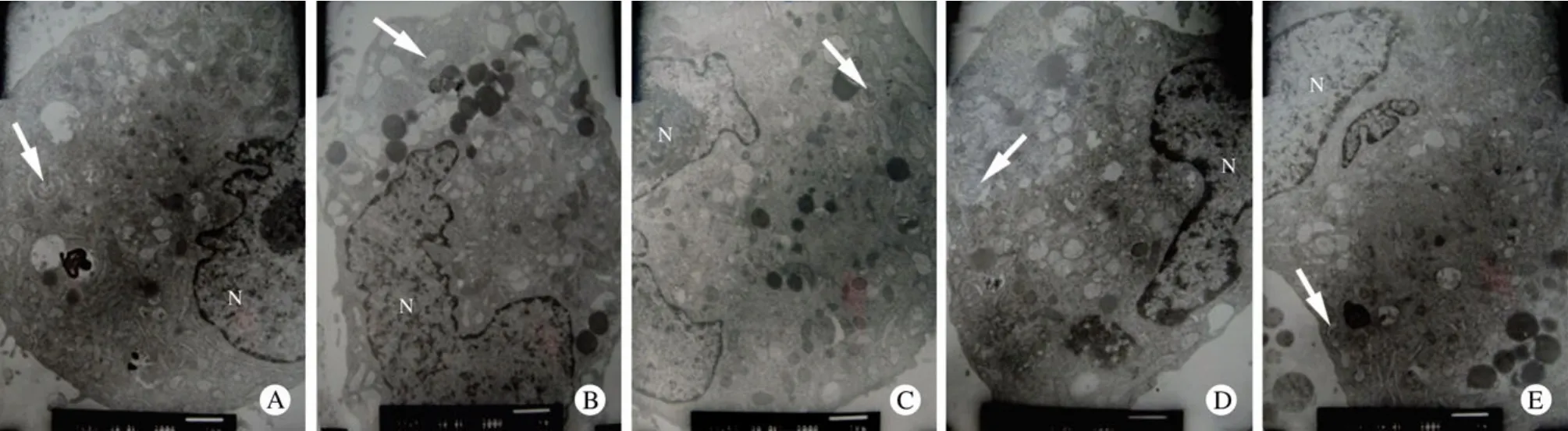
图1 透射电镜下观察心肌细胞内的自噬体(×8 000)箭头所示:为包绕废弃胞浆成分的自噬体; N:细胞核Fig.1 Transmission electron microscopy showing autophagosomes of cardiomyocytes in control group (A), GD group (B), GD+apelin-13 group(C), GD+apelin-13+tricribine group (D), ticribine group (E) (×8 000)Arrows indicate the autophagosomes wrapping cytoplasmic components. N: nuclei
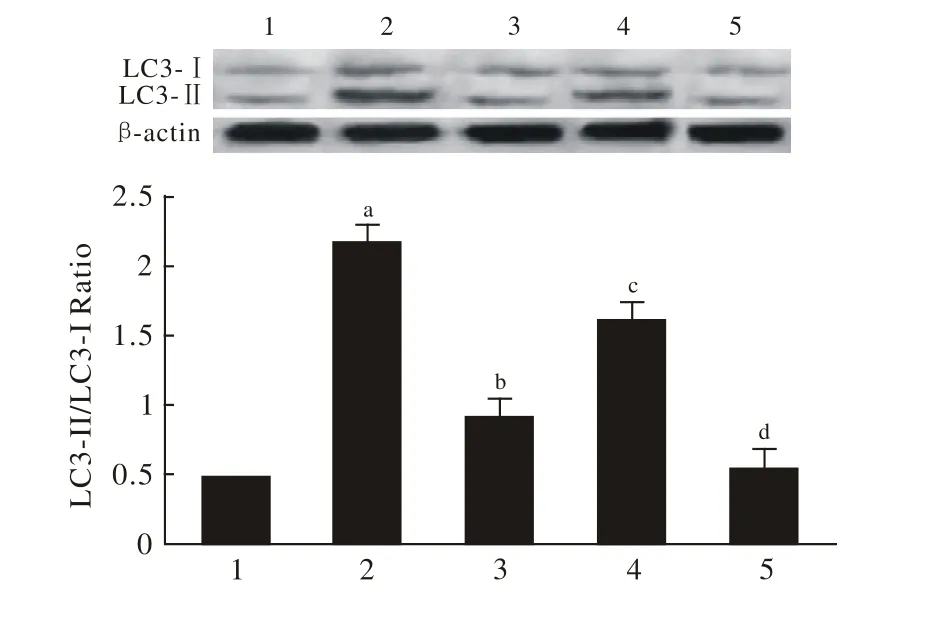
图2 Western-blotting法检测 LC3蛋白表达水平Fig.2 Western-blot showing LC3 protein expression level in control group 1), GD group 2), GD+apelin-13 group 3), GD+apelin-13+tricribine group 4), ticribine group 5)aP<0.01, vs control group; bP<0.01, vs GD group; cP<0.01,vs GD+apelin-13 group; dP>0.05, vs control group
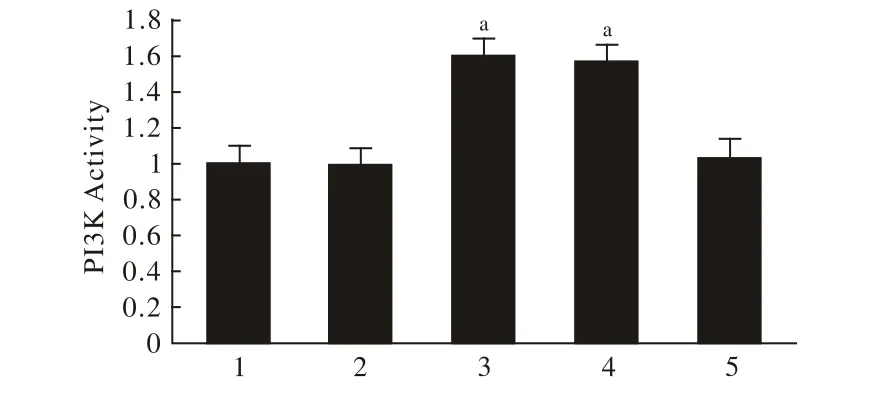
图3 各组与对照组PI3K活性比较Fig.3 PI3K activity in control group 1), GD group 2), GD+apelin-13 group 3), GD+apelin-13+tricribine group 4), ticribine group 5)aP<0.01, vs GD group
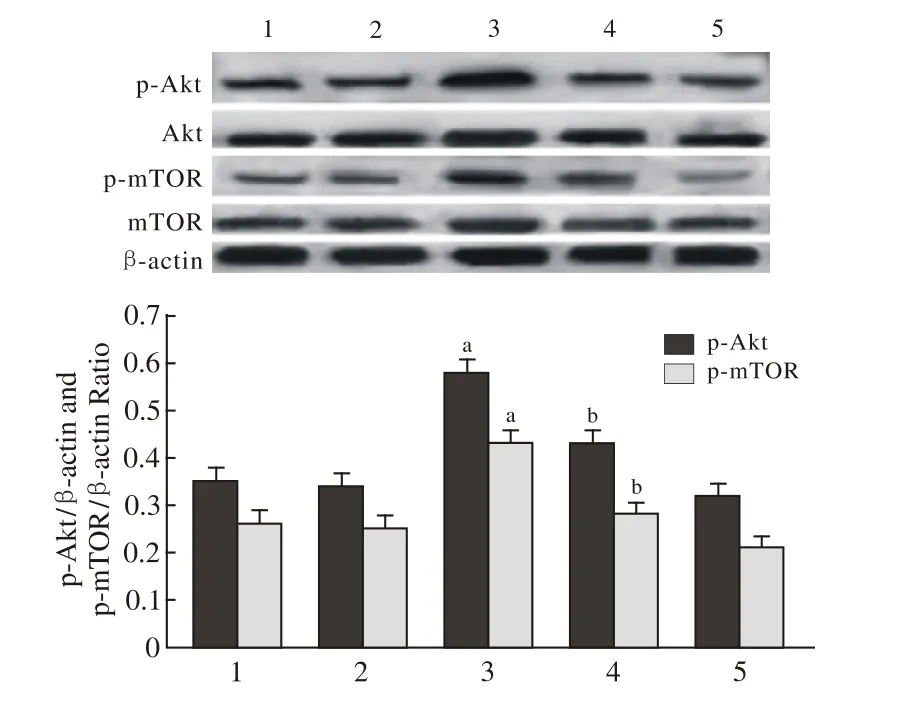
图4 Western-blotting法检测p-Akt与p-mTOR蛋白表达水平Fig.4 Western-blot showing expression level of p-Akt and p-mTOR protein in control group 1), GD group 2), GD+apelin-13 group 3),GD+apelin-13+tricribine group 4), ticribine group 5)aP<0.01, vs GD group; bP<0.01, vs GD+apelin-13 group
3 各组与对照组PI3K活性比较 与正常对照组(100%)相比,GD+Apelin-13组与GD+Tricribine+Apelin-13组PI3K的活性分别升高至159.72%、156.89%,差异均有统计学意义(P<0.01);其余3组与正常组差异无统计学意义(P>0.05),见图3。
4 通 路 蛋 白 Akt、p-Akt、mTOR、p-mTOR的 表 达水平 葡萄糖剥夺的心肌细胞使p-Akt、p-mTOR的表达略有下降,但与正常对照组相比,差异无统计学意义(P>0.05);Apelin-13预处理30 min可明显提高Akt与mTOR的磷酸化水平(P<0.01);而Apelin-13联合应用Tricribine后Akt与mTOR的磷酸化水平又被显著下调(P<0.01);另外,各组心肌细胞中总Akt与总mTOR蛋白表达水平无统计学差异(P>0.05),见图4。
讨 论
细胞自噬广泛存在于真核细胞内,正常情况下,自噬维持在一个较低的水平。在缺血缺氧、养分缺失、氧化应激或感染等因素刺激下,细胞可启动自噬来清除受损的细胞器,对细胞起到一定的保护作用,但是过度的激活自噬可导致细胞的死亡-Ⅱ型程序性细胞死亡[6]。因此适时干预自噬现象,可有效阻止受伤细胞向不可逆损伤方向发展。本研究中,我们用无糖无血清的培养基进行葡萄糖剥夺以诱导心肌细胞发生自噬[7]。
我们前期研究发现,Apelin-13可以明显抑制GD诱导的心肌细胞自噬,并且具有浓度依赖性,在1μmol/L时效果最佳[4]。近期研究还发现,Apelin-13可以通过激活PI3K/Akt信号通路发挥抑制急性缺血诱导的大鼠心肌细胞凋亡的保护作用[8]。因此,本研究我们选用1μmol/L浓度的Apelin-13进行预处理,之前30 min给予Akt抑制剂Tricribine抑制PI3K/Akt信号通路的激活,观察心肌细胞自噬及通路相关蛋白的变化,从而探讨Apelin-13是否也可通过PI3K/Akt信号通路抑制心肌细胞自噬的发生。
研究证实,电子显微镜下观察到自噬体是自噬发生的金标准[9]。另外,LC3是重要的自噬相关蛋白,有Ⅰ型和Ⅱ型之分,未发生自噬时,细胞内合成的LC3经过加工,成为细胞质可溶性的Ⅰ型LC3,当发生自噬时,LC3-Ⅰ经泛素样加工修饰过程,与自噬膜表面的磷脂酰乙醇胺(PE)结合,形成Ⅱ型LC3。LC3-Ⅱ/LC3-Ⅰ的比值与自噬体的数量呈正相关[10]。本研究表明:葡萄糖剥夺后乳鼠心肌细胞内自噬体数量显著增多,LC3-Ⅱ/LC3-Ⅰ的比值明显升高,表明心肌细胞自噬模型成功建立,与Matsui等[7]的研究结果一致;外源给予Apelin-13后,发现可以拮抗葡萄糖剥夺引起的自噬体增多及LC3-Ⅱ/LC3-Ⅰ比值升高,说明Apelin-13抑制了自噬的发生;而Akt特异性阻断剂Tricribine则部分逆转Apelin-13对心肌细胞自噬的改善;另外,单独应用Tricribine组与正常对照组相比,上述指标差异无统计学意义(P>0.05),说明1μmol/L浓度的Tricribine对心肌细胞自噬的影响较小。综上提示我们,Apelin-13抑制心肌细胞自噬的作用可能与PI3K/Akt信号通路的激活相关。
自噬的发生机制主要包括:Ⅰ型PI3K/Akt/mTOR信号通路、mTOR信号通路、Ⅲ型P13K复合物及AMPK/eEF2激酶信号通路等,这些均参与调节自噬[11]。其中mTOR是一种进化上高度保守的丝氨酸/苏氨酸激酶,参与调控细胞在营养条件改变时的反应及与能量新陈代谢有关的许多调节通路,位于PI3K/Akt通路下游,是自噬的门控机制,起负性调节自噬的作用[12]。细胞外受体的激活可使受体酪氨酸激酶残基磷酸化,磷酸化位点识别并结合PI3K的p85调节亚单位,使Ⅰ型PI3K激活,PI3K激活后产生的PIP2、PIP3可结合Akt,导致Akt的磷酸化,磷酸化的Akt激活下游信号分子mTOR,从而抑制自噬的发生。我们的研究发现:Apelin-13能明显提高PI3K的活性,促进Akt、mTOR磷酸化水平的升高;联合给予阻断剂Tricribine后,这种效应部分被消除,提示Tricribine显著下调了Apelin-13诱导p-Akt、p-mTOR蛋白的表达。上述自噬现象的变化支持了我们的假说:Apelin-13激活了PI3K/Akt信号通路,同时激活其下游信号分子mTOR,发挥了抑制心肌细胞自噬的作用。然而在电镜观察与Western-blotting检测中,我们发现:Tricribine抑制PI3K/Akt信号通路后,Apelin-13抑制自噬作用只是部分被消除,说明尚有其他机制参与。因此,Apelin-13抑制自噬的过程部分是通过激活PI3K/Akt/mTOR信号通路介导的。
综上所述,Apelin-13可以抑制细胞自噬,其机制是部分激活PI3K/Akt/mTOR信号通路,抑制自噬相关蛋白LC3的表达及自噬体的形成,从而抑制损伤心肌细胞自噬的过度激活,提高心肌细胞的存活率。
1 Tatemoto K, Hosoya M, Habata Y, et al. Isolation and characterization of a novel endogenous peptide ligand for the human APJ receptor[J]. Biochem Biophys Res Commun, 1998, 251(2):471-476.
2 Sorli SC, Van den Berghe L, Masri B, et al. Therapeutic potential of interfering with apelin signalling[J]. Drug Discov Today, 2006, 11(23-24):1100-1106.
3 张志,于波.Apelin-13对急性缺血诱导的大鼠心肌细胞凋亡的影响[J].中国动脉硬化杂志,2008,94(9):693-696.
4 任晓倩,张志.Apelin-13对葡萄糖剥夺诱导的乳鼠心肌细胞自体吞噬的影响[J].广东医学,2011,32(24):3176-3178.
5 Chen Y, Azad MB, Gibson SB. Methods for detecting autophagy and determining autophagy-induced cell death[J]. Can J Physiol Pharmacol, 2010, 88(3): 285-295.
6 Kroemer G, Levine B. Autophagic cell death: the story of a misnomer[J]. Nat Rev Mol Cell Biol, 2008, 9(12): 1004-1010.
7 Matsui Y, Takagi H, Qu X, et al. Distinct roles of autophagy in the heart during ischemia and reperfusion: roles of AMP-activated protein kinase and Beclin 1 in mediating autophagy[J]. Circ Res,2007, 100(6): 914-922.
8 Zhang Z, Yu B, Tao GZ. Apelin protects against cardiomyocyte apoptosis induced by glucose deprivation[J]. Chin Med J (Engl),2009, 122(19):2360-2365.
9 Martinet W, De Meyer GR, Andries L, et al. In situ detection of starvation-induced autophagy[J]. J Histochem Cytochem, 2006,54(1): 85-96.
10 Wohlgemuth SE, Seo AY, Marzetti E, et al. Skeletal muscle autophagy and apoptosis during aging: effects of calorie restriction and life-long exercise[J]. Exp Gerontol, 2010, 45(2):138-148.
11 Dutta D, Calvani R, Bernabei R, et al. Contribution of impaired mitochondrial autophagy to cardiac aging: mechanisms and therapeutic opportunities[J]. Circ Res, 2012, 110(8):1125-1138.
12 Yu L, Mcphee CK, Zheng L, et al. Termination of autophagy and reformation of lysosomes regulated by mTOR[J]. Nature, 2010,465(7300): 942-946.
