优良观赏药用地被植物——白芨组织培养及快速繁殖研究
2013-08-27连芳青
邹 娜,李 意,连芳青
(江西农业大学 园林与艺术学院,江西 南昌 330045)
白芨(Bletilla striata)为兰科白芨属多年生草本植物,花期3—5月,其花紫红色,花形奇特,是一种理想的耐荫观花地被植物,还可盆栽室内观赏或作切花材料供插花之用[1-2]。白芨不仅具有较高观赏价值,亦是我国常用的中药材之一,以干燥块茎入药,具有收敛止血、消肿生肌等功效[3]。此外,白芨茎中还含有较高的白芨胶,具有特殊的黏度特性,可作为增稠剂、混悬剂、保湿剂和助乳化剂等应用于化妆品中,具有良好的效果[4]。
因其极高的观赏药用及经济价值,野生白芨遭到了无限制人工采挖。同时,由于白芨种子自然条件下繁殖困难,野生白芨资源急剧减少。白芨目前已被国家列为珍稀濒危的保护植物[5]。在其野生资源日益减少的情况下,大力推广人工栽培[2,6]、并探索其行之有效的快速繁殖技术,可在解决其由于资源短缺制约白芨产业可持续发展的同时,实现对野生白芨资源的有效保护[7]。
白芨常规以分生繁殖为主,但分生繁殖系数低,生长周期较长,而且耗种量大,不宜进行大规模的商业化生产[8]。利用无菌播种技术,通过组织培养方法可以快速繁殖大量种苗,远较分株繁殖快捷高效[9]。目前,虽然白芨组织培养和设施栽培等人工繁育关键技术得到了一定的发展,但是还没有组织培养技术迅速推广应用的报道[7]。因此,本研究的目的在于建立一套简单实用且易推广的白芨组培快繁技术程序,为白芨的产业化发展及对野生白芨资源的有效保护提供技术支持。
1 材料与方法
1.1 试验材料
白芨成熟未开裂的长卵圆形蒴果、花茎和地下茎。
1.2 试验方法
1.2.1 外植体灭菌 外植体材料首先用流水冲洗20 min,再用小毛刷蘸洗衣粉溶液轻轻刷洗其表面,用流水冲洗干净。在超净工作台上,用体积分数为75%酒精溶液浸泡30 s,然后转入1 g/L的HgCl2溶液中进行表面消毒6~10 min,再用无菌水冲洗6次,吸干表面水分。花径切去两端并纵切成2半切口向下接到培养基上;块茎每个切成4~6份接到培养基上;蒴果纵切,将粉末状的细微种子均匀地撒于培养基上。每种外植体每次均接30瓶培养基,做3次重复实验。
1.2.2 原球茎诱导 以MS培养基作为基本培养基,采用完全随机试验设计方法,研究细胞分裂素(6-BA、KT)和生长素(2,4-D、NAA)对白芨原球茎诱导的影响。培养21 d后统计原球茎的诱导率。原球茎诱导率=诱导出的原球茎个数/接种的外植体个数(种子粒数)。
1.2.3 壮苗生根培养 将分化出的小芽接入由不同浓度细胞分裂素6-BA和生长素NAA配比组成的9种培养基,研究白芨苗的生根数,根长,叶片数,叶长和叶宽,以取得白芨一步成苗的最适培养基。每种培养基设15瓶,每瓶均接入6株白芨小芽,培养30 d后,记录各数据。
1.2.4 移栽 选择生长势旺盛,叶片数多且根系良好的瓶苗,打开瓶盖,室内或95%遮光率的大棚内放置3~5 d,然后小心取出瓶苗,洗净根上附着的培养基。采用随机区组试验设计研究蛭石、珍珠岩、泥炭土+蛭石、泥炭土+珍珠岩四种基质对白芨组培苗移栽成活的影响。栽苗后注意遮光率和提高空气湿度,定期做好观察记录。30 d后分别在每个基质中抽取50株有代表性的苗进行调查分析,测每组内苗的成活率、植物球茎直径、苗高、叶片数、叶宽。
1.3 培养条件
培养室内培养条件为:温度(25±2)℃,光照1 800~2 500 lx,每天光照12 h;诱导和增殖生根培养均采用 MS培养基,蔗糖30 g/L,pH 6.5,琼脂7 g/L。
2 结果与分析
2.1 外植体的选择
分别以白芨蒴果、花茎和地下茎为外植体进行组织培养,结果表明,不同外植体类型的污染率都是随着消毒时间的增加而减少,培养1个月后,消毒灭菌10 min的白芨蒴果(种子)的成活率可高达96.67%,平均污染率仅为3.33%,显著低于相同处理条件下的地下茎和花茎平均感菌率(表1)。此外,以白芨花茎和地下茎作为繁殖材料,培养一段时间后地下茎变绿随后变褐色,花茎虽也有膨大的现象,但更换多种培养基和重复多次实验均未诱导出愈伤组织或芽;而以白芨种子为培养材料,通过简单培养即可诱导出白芨原球茎。由此可见,白芨组织培养以蒴果(种子)为外植体的培养效果最好。

表1 白芨不同外植体的消毒效果Tab.1 Disinfection effects of different explants of Bletilla striata
2.2 不同培养基对白芨原球茎诱导及芽分化的影响
白芨种子播种在诱导培养基上约1周后吸水膨胀,并由黄褐色变成淡绿色,进一步形成绿色小球体状(即原球茎)。试验结果表明(表2):在培养基MS+6-BA 1.0 mg/L+2,4-D 0.5 mg/L中,原球茎诱导率只有5%(处理1)。将处理1中0.5 mg/L的2,4-D改为等浓度的NAA(处理2),可使原球茎的平均诱导率由5%提高到90%,提高了17倍。说明在1 mg/L细胞分裂素6-BA存在情况下,与2,4-D相比,NAA更有利于白芨原球茎的诱导。
当保持培养基中的2,4-D浓度(0.5 mg/L)不变,将处理1中1.0 mg/L的细胞分裂素6-BA改为等浓度的KT(处理4),原球茎的平均诱导率则有5%提高到70%,提高了13倍。说明在0.5 mg/L 2,4-D存在情况下,与6-BA相比,KT更有利于白芨原球茎的诱导。而在NAA浓度(0.5 mg/L)一定的条件下,等浓度的细胞分裂素6-BA或KT处理,对白芨原球茎诱导效果相同(处理2和处理3)。
因此,在节约成本的情况下,仅采用MS+6-BA 1.0 mg/L+NAA 0.5 mg/L的培养基(处理2)对白芨原球茎进行诱导,便能达到很好的效果。但与生长素2,4-D搭配时,KT比6-BA的诱导效果好(处理1和处理4)。

表2 不同细胞分裂素和生长素诱导白芨原球茎的结果Tab.2 Effects of different cytokinin and auxin on protocorm induction of Bletilla striata
在上述不同培养基上培养约1个月后,原球茎顶部出现可见幼叶,不同培养基对白芨芽分化的诱导存在较明显的差异。处理1中诱导的白芨小芽发黄,略见绿色,虽然处理4原球茎诱导率可以达到70%,但黄化现象较处理1更严重,继续培养,芽分化的诱导效果很差。
处理2和3中原球茎诱导分化效果较好,其中处理3中的小苗每株平均有两小叶,而处理2每株仅有一片小叶。就整齐度而言,处理3芽分化效果更好;就苗高而言,处理2和处理3诱导的白芨平均苗高分别为0.3 cm和0.5 cm。由此可见,对于白芨芽的分化诱导,处理3效果最好。
综合考虑白芨原球茎诱导和芽分化的效果,筛选出白芨原球茎诱导及芽分化最适培养基配方为:MS+KT 1.0 mg/L+NAA 0.5 mg/L(处理3),在该培养基中的原球茎平均诱导率可达90%,且诱导芽的分化效果最好。
2.3 不同培养基对白芨壮苗生根培养的影响
将分化出的小芽转接入含不同浓度6-BA和NAA配比组成的9种培养基中,以筛选白芨最佳壮苗生根培养基配方。
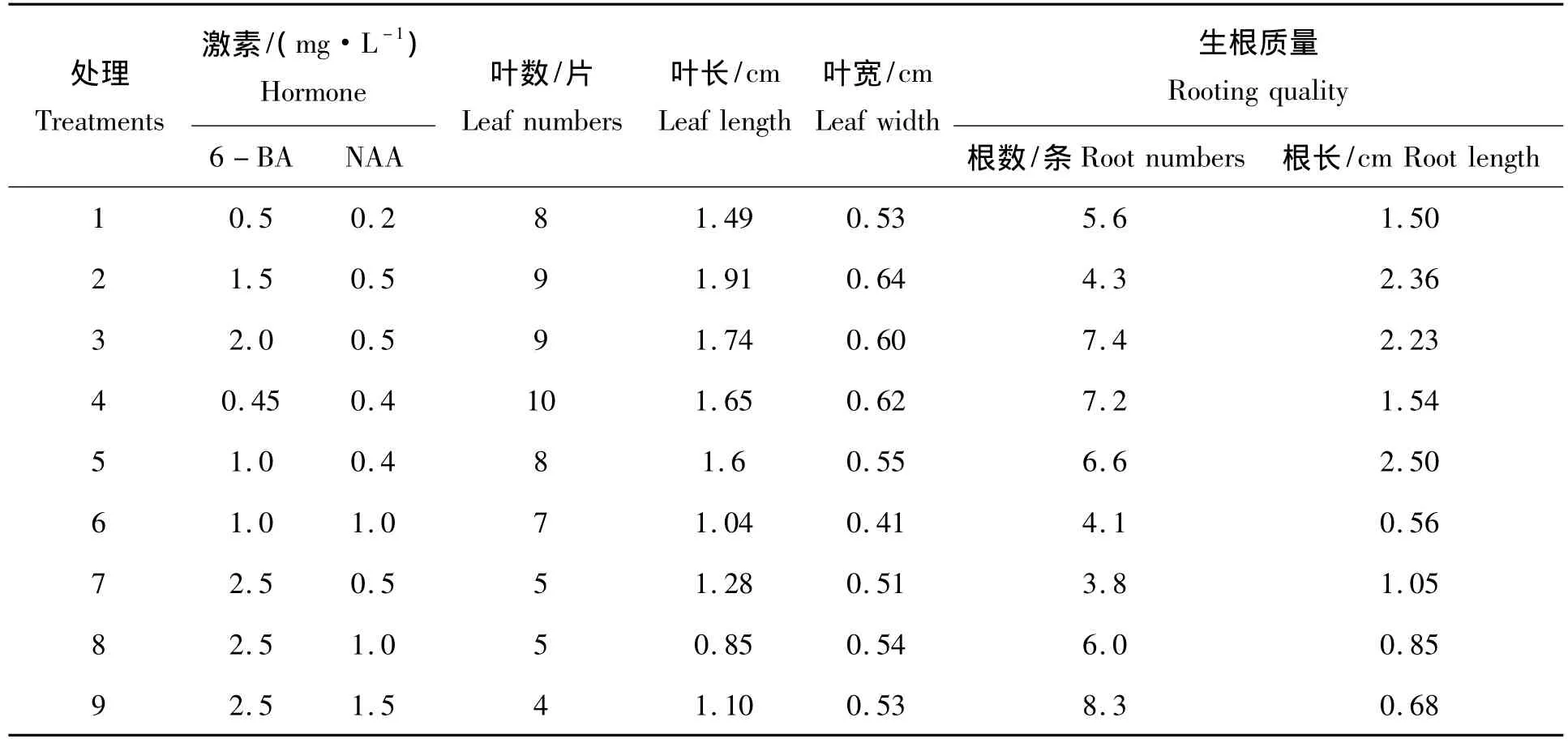
表3 不同培养基对白芨壮苗及生根培养影响Tab.3 Effects of different media on lustihood and rooting culture induction of Bletilla striata
由表3可以看出:每株苗叶片数最多的4号培养基,其次是处理2,且其叶长和叶宽值都较大。处理2、3和7,处理4和5,处理6和8之间的实验结果表明:在NAA浓度相同的条件下,植株叶片数、叶长和叶宽随BA浓度的增加而减少。而在BA浓度相同的条件下(处理5和6,处理7、8和9),植株叶片数、叶长和叶宽随NAA浓度的增加有降低趋势,NAA保持在0.5 mg/L更有利于植株生长。说明细胞分裂素与生长素只有以一定适宜浓度配比,白芨组织培养才能获得较好的生长效果。
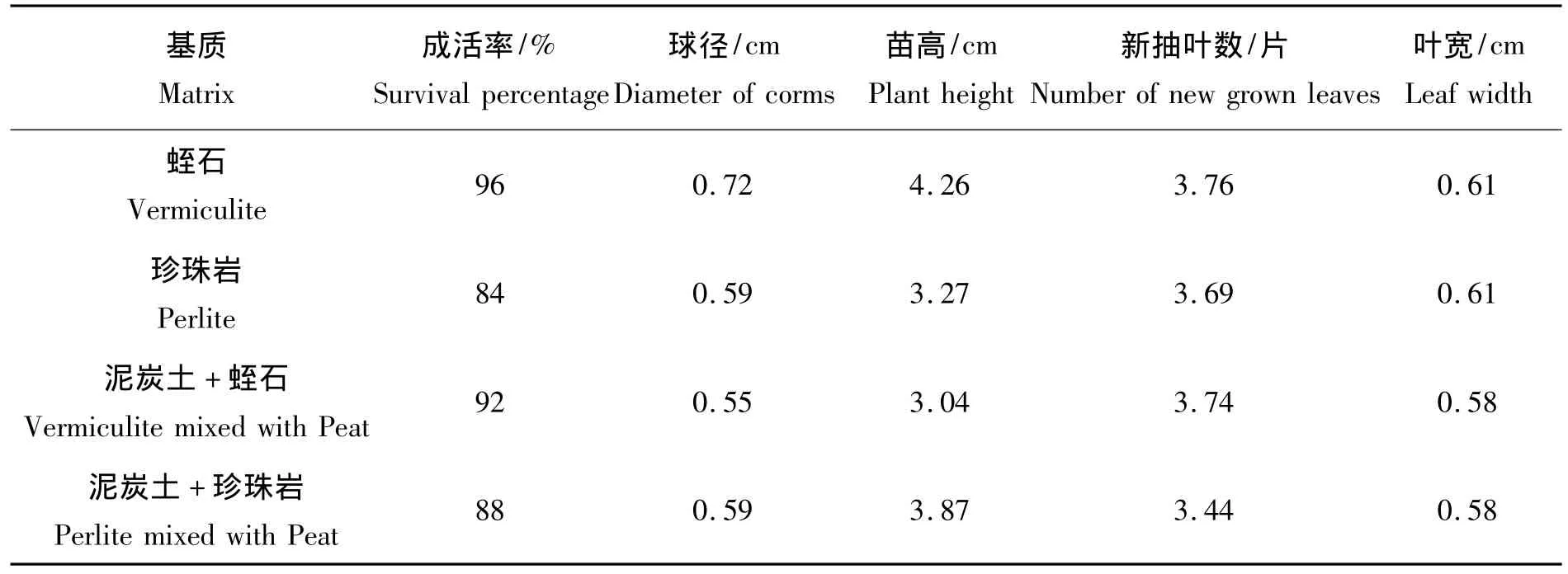
表4 不同基质对白芨移栽成活的影响Tab.4 Effects of different matrix on survival of Bletilla striata after transplant
9种培养基中的苗都能生根,综合考察苗的生根数和根长,效果较好的处理为3、4和5,其中生长的植株平均根数分别为:7.4 条、7.2 条和 6.6 条,平均根长分别为:2.23,1.54,2.50 cm。
本试验采用的是壮苗和生根培养一步成苗的方法,对白芨壮苗培养效果较好的培养基为处理2和处理4,生根较好的培养基为处理3、4和5,所以壮苗培养和生根效果都较好的培养基为处理4,即:MS+6 - BA 0.45 mg/L+NAA 0.4 mg/L。
2.4 白芨组培苗炼苗移栽
从表4可以看出不同基质移栽处理对白芨成活有不同的影响。总体上来说用蛭石作为基质来移栽白芨的试管苗的生长能力较强,存活率可达95%以上;在成活苗的平均根数、植物球根直径、苗高叶宽的数据对比分析中,可以得出用蛭石作为基质的效果是最好的,而以珍珠岩作为基质的移栽效果不理想。添加泥炭土的混合基质对移栽效果也没用明显的改变。
3 讨论与小结
本实验以白芨种子为培养材料,通过简单培养即可诱导出白芨原球茎并进行芽的分化,且壮苗培养与生根可同时进行,即一步成苗,既节约了繁殖成本和培养时间,且操作简单易行便于推广,符合市场要求(图版)。前人在对白芨原球茎的诱导过程中,培养基中都不同程度的添加了马铃薯泥、香蕉泥和椰子汁等辅助成分[9],而本实验仅采用常规激素组合对其进行诱导,效果同样显著(表2),所以在大量生产中,可以从节约繁殖成本及便于操作的角度考虑使用简单培养基成分诱导白芨原球茎。
但是同大多数兰科植物一样,培养基中生长素与细胞分裂素的种类及浓度配比对白芨原球茎诱导及芽分化方向起着决定性的作用[10]。研究发现生长素2,4-D不仅抑制白芨原球茎的诱导,也不适宜于其原球茎的分化。而等浓度的NAA与KT或6-BA的配合使用对白芨原球茎的诱导效果很好(表2)。在壮苗生根培养过程中,当培养基中生长素浓度相对细胞分裂素而言过高时,趋向于长根,抑制茎芽的生长(处理6),而当培养基中细胞分裂素相对生长素而言过高时,虽然有明显的芽分化,但使其分化苗不能正常生长而死亡(处理7)。说明在不同的诱导培养阶段,为了促进芽器官的分化或壮苗生根培养,应适当调整培养基中生长素与细胞分裂素的比例。实验筛选出白芨原球茎诱导最适培养基配方为:MS+KT 1.0 mg/L+NAA 0.5 mg/L。白芨为生根较容易植物,各处理培养基都促进了白芨生根,综合调查白芨的壮苗指标和生根情况,发现以培养基为MS+6-BA 0.45 mg/L+NAA 0.4 mg/L作用较明显。

图版说明:A:白芨蒴果;B:由白芨种子诱导出原球茎及芽的分化;C:白芨壮苗生根培养;D:生根白芨无菌苗移栽到蛭石。Explanation of plates:A:Capsule of Bletilla striata as indicated by arrow;B:Protocorm induction and bud differentiation of Bletilla striata;C:Lustihood and rooting culture of Bletilla striata;D:The sterile seedlings of Bletilla striata after rooting was transplanted into the vermiculite.
瓶苗移栽实验结果表明,白芨无菌苗最适宜的移栽生长基质为蛭石(表4)。蛭石具有良好的保水透气性能,这也与白芨性喜温暖而又湿润的环境,要求排水良好含腐殖土较多的沙壤土的特性吻合。此外,白芨瓶苗的叶较薄,出瓶后极易脱水而使叶边缘焦枯,从而影响成活率,保证移栽前期的空气湿度在80% ~90%,可提高移栽成活率。
本实验主要采用的是种子萌发方法繁殖,虽然增殖系数不高,但成苗迅速且苗的质量好。本研究中,以种子作为外植体,30 d就开始萌动,60 d小苗就分化完全,这也与韦卡娅等的研究结果相一致[11]。研究表明利用幼嫩块茎作为外植体诱导丛生芽,60 d才有小芽形成,且分化效率不高[11]。此外,白芨块茎长期在地下,受病菌和泥土污染严重,很难彻底灭菌,而且由于分化效率低、成苗所需时间长等原因,白芨块茎、侧芽等作为外植体的方法目前远不如种子萌发方法普遍。
本研究得到白芨高效成苗的技术流程为:白芨成熟尚未开裂的蒴果消毒灭菌处理后将种子播于培养基MS+KT 1.0 mg/L+NAA 0.5 mg/L进行原球茎的诱导和芽的分化,50 d后转入培养基MS+6-BA 0.45 mg/L+NAA 0.4 mg/L进行壮苗生根培养30 d,而后将生根无菌苗移栽到蛭石中,移栽初期进行适当遮荫并保持较高的空气湿度,成活率可达到96%。
[1]刘燕.园林花卉学[M].北京:中国林业出版社,2008:214.
[2]石晶.白芨属植物资源与利用[D].海口:海南大学,2010.
[3]国家药典委员会.中华人民共和国药典:1部[S].北京:中国医药科技出版社,2010:95.
[4]颈学裘,沈文照,胡晋,等.中药白芨的研究[J],药学学报,1998,3(1)75 -87.
[5]陆峻波,刘亚辉,杨永红,等.从文献分析看我国白芨研究进展[J].云南农业大学学报,2011,26(2):288-292.
[6]刘军凯.白芨细胞悬浮体系的建立及其次生代谢产物的测定[D].昆明:云南农业大学,2012.
[7]张永为,蒋福升,王寅,等.白及产业现状及可持续发展的探讨[J].中华中医药学刊,2012,30(10):2264-2266.
[8]张亦诚.白芨的生物特性及栽培技术[J].农业科技与信息,2007,(10):45.
[9]管常东,叶静,郑晓君,等.白芨组织快繁育苗技术研究进展[J].云南大学学报:自然科学版,2010,32:416-421.
[10]Miyoshil K,Mii M.Phytohormone pre-treatment for the enhancement of seed germination and protocorm formation by the terrestrial orchid,Calanthe discolor(Orchidaceae),in asymbiotic culture[J].Scientia Horticulturae,1995,63(3/4):263 -267.
[11]韦卡娅,刘燕琴,秦静,等.白及组培外植体的筛选研究[J].中国现代中药,2008,5(10):13-14.
