绒毛白蜡2个MYB转录因子的活性鉴定及其表达分析
2013-08-27彭振英范仲学毕玉平1
李 田,彭振英,范仲学,毕玉平1,*
(1.山东师范大学 生命科学学院,山东 济南 250014;2.山东省农业科学院 高新技术研究中心/山东省作物遗传改良与生态生理重点实验室,山东 济南 250100;3.滨州学院 山东省黄河三角洲生态环境重点实验室,山东 滨州256603)
转录因子是一类能够特异性作用于真核基因的顺式作用元件,从而对转录起到激活或抑制作用的一类DNA结合蛋白。基因表达的转录调控在其响应胁迫的过程中起作用的转录因子是植物中最重要的一类调节基因。近年来,发现某一转录因子的表达可以调控下游多个与之相关的功能基因的表达。因此通过利用转录因子来改良植物的品质与特性,通常比转单一功能基因的途径具有更理想的效果。
MYB家族转录因子是植物中数量最多且作用十分重要的一类转录因子,它们以含有高度保守的MYB结构域为特征,每个MYB结构域含有50~53个氨基酸残基,且每个MYB区域中一般都含有3个保守的色氨酸残基,其间隔包含18或19个氨基酸。根据所含的相邻MYB结构域的数目,可将其划分为单一MYB结构域蛋白(single-MYB)、2个串联MYB结构域蛋白(R2R3-MYB)和3个串联MYB结构域蛋白(R1R2R3-MYB)3种类型。研究表明,MYB家族转录因子广泛参与细胞内各种生命活动,在植物生长发育和应对环境胁迫过程中发挥重要作用[1-2]。
随着转录因子的研究,许多具有不同调控作用的MYB转录因子从植物中分离出来。在含有单个MYB结构域的MYB蛋白的研究中,以往发现的蛋白(拟南芥的LHY、CCAI、CPC和RTBP1,水稻的RTBP21,玉米的IBP21等)均为端粒结合蛋白,其功能主要在于维持染色体结构的完整性[3]。Dong等人在马铃薯中发现StMYB1R-1基因,是一个与植物耐逆性有关的单一MYB结构域转录因子。该基因可激活干旱诱导相关基因,通过调节细胞内水分缺失达到抗旱目的。对于MYB家族中种类最多的R2R3-MYB成员其研究相对丰富,目前发现的与植物耐逆相关的基因有很多。仅在拟南芥中就发现了许多与生物和非生物胁迫相关的基因,主要包括AtMYB2、AtMYB41、AtMYB44和AtMYB60等与抗逆相关的MYB转录因子。其中AtMYB2基因可在干旱诱导条件下高效表达,AtMYB41基因只在干旱、ABA及盐胁迫诱导下才能表达,正常生长条件下该基因不表达。另外,两者通过不同的机制提高对逆境胁迫的适应,其中AtMYB2通过调控受ABA信号诱导的基因表达来调节植物对环境变化的反应;AtMYB41则通过参与调控植物细胞的形态变化,主要是调控表皮发育及细胞增殖来增强植物对逆境的适应力[5-7]。At-MYB44是一类依赖于ABA信号诱导的参与植物非生物胁迫响应的转录因子,转基因植株通过调节气孔关闭达到提高耐逆性的目的[8]。AtMYB60基因被证实参与植物的耐旱胁迫过程,其通过脱落酸信号级联反应来调节植物气孔运动、干旱胁迫及抗病性[9]。
绒毛白蜡(Fraxinus velutina Torr.)属于木犀科白蜡树属,其耐盐性强,分布范围广,是优良的盐碱地造林绿化和城市园林绿化树种,也是我国北方沿海地区最常用的耐盐树种[10]。挖掘白蜡中的关键耐盐基因,揭示白蜡耐盐的分子机制及其所涉及的主要代谢途径,可为植物耐盐特性的遗传改良提供新的基因资源。然而,目前有关从林木中分离与耐逆相关的MYB转录因子的研究还很少。
本研究对从绒毛白蜡中克隆到的两个MYB转录因子新基因FvMYB1和FvMYB2的转录激活活性进行了分析;并初步分析了两个基因在不同组织中的表达模式,为进一步明确FvMYB1和FvMYB2植物代谢调控途径中对下游靶基因的调控机制提供了基础资料。
1 材料和方法
1.1 植物材料与总RNA提取
供试绒毛白蜡(Fraxinus velutina Torr.)品种由山东省林业科学院提供。白蜡种子播种后于温室中培养28 d后开始取材,分别剪取根、子叶、茎和叶,液氮冻存备用。采用改良CTAB法提取白蜡各组织总RNA,提取后采用DNase I(TaKaRa,大连)去除DNA。
1.2 实验材料与试剂
实验所用各种限制性内切酶及反转录试剂盒均购自Fermentas公司;所用引物均由上海生工合成;pEASY-T3载体购自北京全式金公司;酵母缺陷型培养基购自上海杰美基因医药科技有限公司;pGBKT7载体及酵母菌株AH109均由本实验室保存。其它主要常规试剂均为国产分析纯。
1.3 酵母表达效应质粒的构建和鉴定
采用引物YM1F和YM1R,YM2F和YM2R以包含目的基因的质粒为模板,分别扩增出FvMYB1和FvMYB2基因的完整开放阅读框。引物名称及序列如表1所示。扩增产物和pGBKT7载体经EcoRI和BamHI双酶切,酶切产物经琼脂糖凝胶电泳、回收后,T4连接酶将扩增片段分别连于pGBKT7酵母表达载体上。PCR筛选阳性克隆后进一步送测序,测序验证目的基因与BD(DNA-binding domain)融合表达的读码框正确后,采用LiCl法将重组质粒转化酵母菌感受态细胞AH109进行酵母表达。
1.4 β–半乳糖苷酶活性滤纸显色反应
随机挑取酵母菌单克隆,分别划线于SD/-Trp和SD/-Trp/-His/-Ade单缺和三缺营养缺陷培养基上,于30℃培养2~3 d,观察酵母菌的生长情况。取一张灭菌过的滤纸,将酵母菌影印到滤纸上,将带有酵母克隆的滤纸在液氮中反复冻融3~4次,每次10 min。将pH 7.4的 PBS 缓冲液(NaCl 8 g/L,KCl 0.2 g/L,Na2HPO41.42 g/L,KH2PO40.27 g/L)加入X-gal使其终浓度为0.1 mg/mL,混匀后倒在滤纸(菌落面朝上)上;凝固后于室温下观察,其中显蓝色的菌落其β-半乳糖苷酶活性为阳性,未显色的为假阳性。由于相互作用强弱不同,出现蓝色的时间不等(几分钟到数小时);最后拍照记录。

表1 引物Tab.1 Primers
1.5 β–半乳糖苷酶活性检测法定量分析重组质粒的转录活性
从选择性培养基平板上挑取酵母转化子菌落接种于5 mL YPDA液体培养基中,30℃,200 r/min过夜培养。取上述2 mL菌液接种于8 mL YPDA培养基中,30℃培养至细胞对数生长期(OD600=0.5~0.8),记录OD600值。将1.5 mL菌液离心弃上清,加入等体积pH 7.0的 Z - Buffer(Na2HPO4·7H2O 16.1 g/L,NaH2PO4·H2O 5.50 g/L,KCL 0.75 g/L,MgSO4·7 H2O 0.246 g/L)重悬;离心后再重悬于300 μL Z-Buffer。取上述浓缩菌液100 μL,液氮中冷冻1 min后置于37℃水浴1 min;反复冻融2次,使细胞充分裂解,同时以Z-Buffer作为对照;在上述管中每个加入300 μL Z-Buffle/β-巯基乙醇,然后再加入160 μL新鲜配制的ONPG(4 mg/mL),37℃水浴并立即开始计时;当菌液呈现黄色时,立即加入400 μL 1 mol/L的Na2CO3,并记录反应时间;12 000 r/min离心15 min后吸取上清至比色杯中,测定OD420值。每个样品重复3次。采用如下公式计算酶活:β–半乳糖苷酶活性单位=1 000×OD420/(T×V×OD600),其中T=反应时间(min),V=0.1×浓缩因子,本实验中浓缩因子为 1.5 mL/300 μL=5。
1.6 cDNA合成与半定量RT-PCR分析
cDNA第一链合成采用AMV反转录试剂盒(Fermentas,加拿大),20 μL反应体系包括:总 RNA 1 μg,Oligo(dT)18 primer 1 μL,5 × Reaction Buffer 4 μL,dNTP(10 mmol/L)2 μL,RiboLocK RNase Inhibitor(20 U/μL)1 μL,RevertAid M - MuLV Reverse Transcriptase(200 U/μL)1 μL,DEPC · H2O 11 μL。反转录cDNA于-20℃保存。
根据所获得cDNA序列设计半定量RT-PCR引物。FvMYB1半定量RT-PCR正向引物为RTM1F,反向引物为RT-M1R;FvMYB2半定量RT-PCR正向引物为RT-M2F,反向引物为RT-M2R;具体序列见表1。同时,根据文献[11]设计白蜡的actin引物,作为调整模板量的内参。引物均由上海生物工程公司合成。
20 μL的半定量 RT-PCR的反应体系为:经内参调整的适宜体积的 cDNA模板,正向引物(10 mmol/μL)1 μL,反向引物(10 mmol/μL)1 μL,dNTP Mix 10 μL,ddH2O 补齐至 20 μL。PCR 反应程序为:95℃预变性3 min;接着95℃ 30 s,58℃ 30 s,72℃ 30 s,25个循环;72℃延伸10 min,4℃保存。12 g/L琼脂糖凝胶电泳检测扩增产物。

图1 重组质粒pGBKT7-FvMYB1和pGBKT7-FvMYB2的构建Fig.1 Construction of the recombinant plasmids pGBKT7-FvMYB1 and pGBKT7-FvMYB2
2 结果与分析
2.1 酵母表达效应质粒的构建
分别在目的基因的读码框上游及下游设计引物,并在两端加上EcoRI和BamHI酶切位点,从含有目的基因全长的pEASY-T3克隆载体中扩增FvMYB1和FvMYB2的开放阅读框,将目的基因克隆到酵母表达载体pGBKT7上,构建融合表达载体pGBKT7-FvMYB1;同理构建FvMYB2的酵母融合表达载体pGBKT7-FvMYB2。重组质粒的构建过程如图1所示,构建好的重组质粒经酶切鉴定后(图2)可用于后续研究。
2.2 酵母单杂交验证转录激活功能
将不含目的基因的质粒pGBKT7和构建好的pGBKT7-FvMYB1、pGBKT7-FvMYB2质粒分别转入酵母菌株AH109中,在单缺和3缺培养基上筛选相应质粒的酵母菌转化子。其中,阴性对照pGBKT7的酵母转化子只在SD/–Trp平板上生长,不能在缺少SD/–Trp/–His/–Ade的3缺培养基上生长,而含有 pGBKT7-FvMYB1和 pGBKT7-FvMYB2质粒的酵母转化子在两种培养基上均能正常生长。滤纸显色反应表明2个载体均能显现明显的蓝色,而阴性对照则未显现蓝色,说明它们都具有转录激活功能,并激活了下游His和LacZ基因的表达(图3)。β–半乳糖甘酶活性检测结果进一步显示,虽然两者都有转录活性,但存在一定的强弱差异,pGBKT7-FvMYB1的半乳糖苷酶活性为14.55 U,而 pGBKT7-FvMYB2的半乳糖苷酶活性为20.80 U(表2)。

图2 重组质粒pGBKT7-FvMYB1和pGBKT7-FvMYB2的双酶切鉴定Fig.2 Restriction enzyme digestion of the recombinant plasmids pGBKT7-FvMYB1 and pGBKT7-FvMYB2

表2 FvMYB1和FvMYB2蛋白在酵母中的β–半乳糖苷酶活性检测Tab.2 β-Galaetosidase activity assay of FvMYB1 and FvMYB2 Proteins in yeast
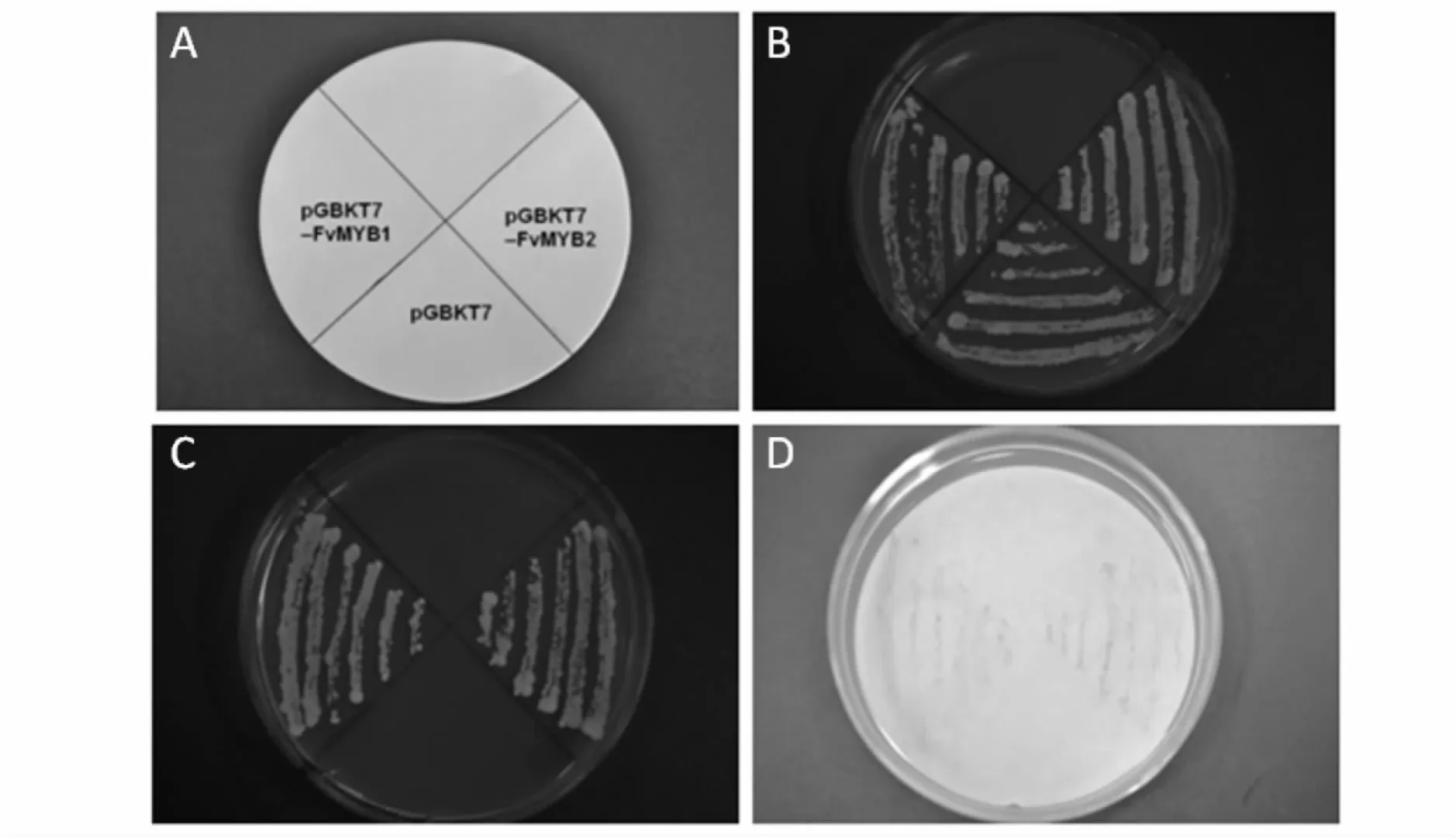
图3 FvMYB1和FvMYB2在酵母系统中的转录激活功能分析Fig.3 Transcriptional activation assay of the FvMYB1and FvMYB2 proteins by yeast expression system
2.3 组织特异性表达分析
分别提取白蜡幼苗的根、子叶、茎和叶的总RNA,利用半定量RT-PCR方法对FvMYB1和FvMYB2的组织特异性进行分析。半定量结果显示,两个基因在上述被检测组织中均有表达,但两者的表达情况存在差异。其中FvMYB1基因在茎中的表达量最高,其次是子叶和叶中的表达量,且子叶和叶两者间的表达量差异不明显,而根中表达量最低。FvMYB2基因在各组织中均有表达,且各组织间的表达量未见明显差异。实验结果还表明,在相同模板量及扩增条件下,FvMYB2基因表达量较FvMYB1的表达量要低(图4)。
3 讨论
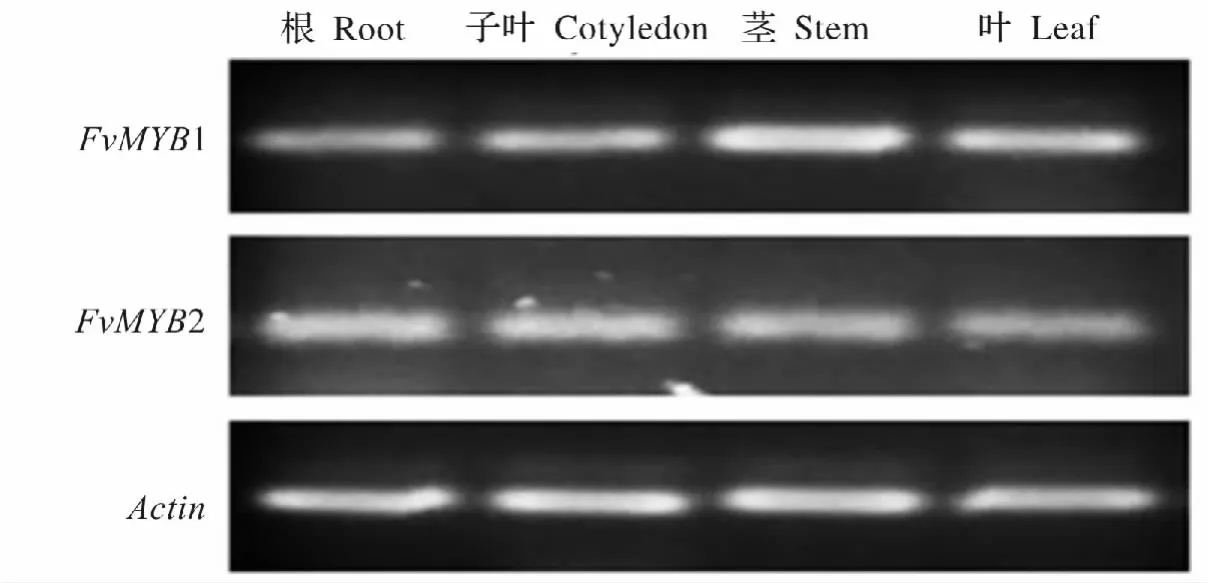
图4 FvMYB1和FvMYB2在不同组织中表达的RT-PCR分析Fig.4 Expression analysis of FvMYB1 and FvMYB2 in different tissues by RT-PCR
酵母单杂交系统可用来研究转录因子的转录活性,其原理在于真核生物的转录因子通常由一个DNA结合结构域(BD)和一个或多个其他调控蛋白相互作用的转录激活结构域(AD)组成。用于酵母单杂交系统的GAL4,其DNA结合域和转录激活域可单独作用。因此,可将待研究的转录因子与酵母GAL4的DNA结合结构域融合,如果其表达的蛋白能与目的基因作用,就可激活下游报告基因的转录,从而推测此转录因子具有转录激活活性[12-13]。自酵母单杂交技术诞生以来,其在验证转录因子的转录激活活性方面得到了广泛应用。早期Mak等[14]利用此技术发现在哺乳动物中存在螺旋-环-螺旋(bHLH)结构的转录因子,并证实其具有转录活性。Nishiyama等[15]将该技术与点突变方法结合后用于对转录活性片段Elf-1的分析,不仅证明其转录活性并指出其具激活作用的区域位于第87-175碱基。近年来,许多转录因子,如NAC类、AP2转录因子和DREB类转录因子的转录激活活性都通过这一技术得到了验证[16-18]。然而并不是所有的转录因子都具有转录激活活性,Zhao等[18]分离到的Group I和Group II两类DREB转录因子,其中后者就不具有激活活性。大多数MYB转录因子具有转录激活功能,具有转录激活功能是转录因子的一个重要特征,也是对下游相关基因表达进行有效转录调控的保证[19]。本研究通过酵母单杂交实验,验证了FvMYB1和FvMYB2在酵母中能够激活报告基因(His3、LacZ)的表达,表明这两个基因和其他植物中已克隆的MYB类转录因子具有相似的转录激活功能。β-半乳糖甘酶活性检测结果进一步显示,两者的转录活性存在一定的强弱差异,其中效应质粒pGBKT7-FvMYB2的激活活性约是 pGBKT7-FvMYB1活性的1.5倍,由此推断效应质粒 pGBKT7-FvMYB2的激活活性较pGBKT7-FvMYB1的活性高。而关于FvMYB2是否同样在植物中较FvMYB1能够表现出更高的耐逆抗性还需要通过构建植物表达载体予以进一步验证。
研究发现,不同植物中的MYB家族基因具有各异的时空表达模式。对于从植物中分离到的MYB基因,其中多数为组成型表达,即在植物的各种器官(营养器官、繁殖器官)中均有表达,如拟南芥的At-MYB33和AtMYB65等[20]。Zhang等[21]通过半定量RT–PCR方法对小麦中的数十个MYB基因在根、茎、叶、雌蕊和雄蕊的组织表达模式进行了研究。实验结果发现了小麦MYB基因中的60种特定的组织表达模式。其中一半的小麦MYB基因在所有测试组织中均有高水平表达,这些基因的组成型表达表明它们在生理和发育过程的各个方面发挥着作用。本研究通过半定量RT-PCR表明FvMYB1和FvMYB2基因在被测的各组织中也均有表达。但各自组织表达模式又呈现出一定的差异,其中FvMYB1基因表达量在茎中最高,而在根中最低;FvMYB2则在白蜡各组织中未表现出差异,但从表达强度上看,要略低于FvMYB1基因的表达。此外,植物中还存在大量的具有组织表达特异性的MYB基因。如玉米中控制花青素合成的C1和Pl基因,其中C1只在糊粉层和花中特异表达,而Pl却只在叶等营养组织中花青素的表达[22]。牵牛的An2基因则只在花冠和花粉管中表达,而花药中却不表达此基因[23]。Ban等[24]发现MdMYBA基因只存在于苹果(Malus×domestica)果皮中,该基因表达具有明显的组织和品种特性,与调控果皮颜色具有十分密切的关系。基因的特异性表达有其重要的生理意义,这是因为许多重要的基因在特定组织中选择性表达通常涉及植物自身的一些特殊生理和发育过程。植物正是通过上述基因组织表达模式来调控正常的生命活动以及适应不断变化的外部环境。
植物的抗逆性状是多基因控制的复杂性状,遗传调控机制较为复杂。上述研究表明所获得两个基因具有转录激活活性,具备典型转录因子的特征。但对于FvMYB1和FvMYB2基因的功能分析还需要借助转基因材料进行进一步的研究。因此,后续工作将继续研究不同胁迫条件下基因的表达模式变化,以及通过构建两者的过量表达载体及RNAi干扰载体,进行白蜡的遗传转化,从而对基因的功能进行更充分的鉴定。
[1]Zhu J H,Verslues P E,Zheng X W.HOS10 encodes all R2R3 -type MYB transcription factor essential for cold acclimation in plant[J].Proc Natl Acad Sci USA,2005,102(28):9966 -9971.
[2]杨致荣,王兴春,李西明,等.高等植物转录因子的研究进展[J].遗传,2004,26(3):403 -408.
[3]Yu E Y,Kim S E,Kim J H,et al.Sequence specific DNA recognition by the Myb - like domain of plant telomeric protein RTBP1[J].J Biol Chem,2000,275:24208 -24214.
[4]Dong J S,SeokJ M,Seyoun H.Expression of StMYB1R -1,a novel potato single MYB - Like domain transcription factor,increases drought tolerance[J].Plant Physiology,2011,155:1421 - 1432.
[5]Urao T,Yamaguchi- Shinozaki K,Urao S,et al.An Arabidopsis MYB homolog is induced by dehydration stress and its gene product binds to the conserved MYB recognition sequence[J].Plant Cell,1993,5:1529 -1539.
[6]Abe H,Urao T,Ito T,et al.Arabidopsis AtMYC2(bHLH)and AtMYB2(MYB)function as transcriptional activators in abscisic acid signaling[J].Plant Cell,2003,15:63 -78.
[7]Cominelli E,Sala T,Calvi D,et al.Over- expression of the Arabidopsis AtMYB41 gene alters cell expansion and leaf surface permeability[J].Plant,2008,53:53 -64.
[8]Jung C K,Seo J S,Han S W,et al.Overexpression of AtMYB44 enhances stomatal closure to confer abiotic stress tolerance in transgenic Arabidopsis[J].Plant Physiology,2008,146:623 -635.
[9]Cominelli E,Galbiati M,Vavasseur A,et al.A guard - cell- specific MYB transcription factor regulates stomatal movements and plant drought tolerance[J].Curr Biol,2005,15(13):1196 -2000.
[10]吴丽云,曹帮华.盐碱地绒毛白蜡和苦楝种子抗盐萌发机理[J].植物学报,2005,6(22):668-672.
[11]Chen Gang,Xing Zhao - Kai,Li Wen,et al.PanCloning of a novel stearoyl- acyl desaturase gene from white ash(Fraxinus americana)and evolution analysis with those from other plants[J].African Journal of Biotechnology,2011,10(79):18185 -18193.
[12]Li J J,Herskowitz I.Isolation of ORC6,a component of the yeast origin recognition complex by a one - hybrid system[J].Science,1993,262:1870 -1873.
[13]Liu J D,Wilson T E,Milbrandt J,et al.Identifying DNA - binding sites and analyzing DNA - binding domains using a yeast selection system[J].Methods,1993,5:125 -137.
[14]Mak K L,Longcor L C,Johnson S E,et al.Examination of mammalian basic helix - loop - helix transcription factors using a yeast one - hybrid system[J].DNA Cell Biology,1996,15:1 -8.
[15]Nishiyama C,Takahashi K,Ohtake Y,et al.Analysis of transactivation region of EIf-1 by using a yeast one- hybrid system[J].Biosci Biotechnol Biochem,2002,66:1105 -1107.
[16]Hu Honghong,Dai Mingqiu,Yao Jialing,et al.Overexpressing a NAM,ATAF,and CUC(NAC)transcription factor enhances drought resistance and salt tolerance in rice[J].Proc Natl Acad Sci USA,2006,103:12987 -12992.
[17]Shukla R K,Raha S,Tripathi V,et al.Expression of CAP2,an APETALA2 - family transcription factor from chickpea,enhances growth and tolerance to dehydration and salt stress in transgenic tobacco[J].Plant Physiology,2006,142:113 -123.
[18]Zhao T J,Sun S,Liu Y,et al.Regulating the drought- responsive element(DRE)- mediated signaling pathway by synergic functions of trans- active and trans- inactive DRE binding factors in Brassica napus[J].J Biol Chem,2006,281:10752 -10959.
[19]Dai Xiaoyan,Wang Yuanyuan,Yang An,et al.OsMYB2P -1,an R2R3 MYB Transcription Factor,Is involved in the regulation of phosphate - starvation responses and root architecture in rice[J].Plant Physiology,2012,159:169 -183.
[20]Gocal G F W,Sheldon C C,Gubler F,et al.GAMYB - like genes,flowering and gibberellin signaling in Arabidopsis[J].Plant Physiology,2001,127:1682 -1693.
[21]Zhang L,Zhao G,Jia J,et al.Molecular characterization of 60 isolated wheat MYB genes and analysis of their expression during abiotic stress[J].Journal of Experimental Botany,2012,63:203 - 214.
[22]Piaaza P,Procissi A,Jenkins G I,et al.Members of the C 1/pl regulatory gene family mediate the response of maize aleurone and mesocotyl to different light qualities and cytokinins[J].Plant Physiology,2002,128(3):1077 -1086.
[23]Quattrocchio F,Wing J,van der Woude K,et al.Molecular analysis of the anthocyanin gene of petunia and its role in the evolution of flower color[J].Plant Cell,1999,11:1433 - 1444.
[24]Ban Y,Honda C,Hatsuyama Y,et al.Isolation and functional analysis of a MYB transcription factor gene that is a key regulator for the development of red coloration in apple skin[J].Plant and Cell Physiology,2007,48(7):958 -970.
