臭氧处理饮用水腐植酸效果的光谱检测比较研究
2013-08-27刘洁玲杨志山
彭 丽,刘洁玲,杨志山
(四川大学 建筑与环境学院,四川 成都 610000)
1 引言
腐植酸(HA)在自然界很难被降解,天然水中HA占总有机物含量的50%~90%,(以总有机碳TOC计),是饮用水中三卤甲烷的前驱物。近年来,随着自来水原水污染的加剧和水质标准的提高,具有安全有效无副产物的部分高级氧化在自来水的深度处理中越来越广泛地得到应用,尤其以臭氧氧化研究较多。研究表明臭氧能大幅度降低三卤甲烷生成能(THMFP)[1],同时改善水中有机物的生化降解性能。而金鹏康等[2]认为腐植酸的总有机碳(TOC)浓度在整个臭氧化过程中不发生变化,仅有机物的结构发生了显著改变,改善了腐植酸的生化降解性能。黄国忠等[3]发现活性炭催化臭氧氧化可较好地去除水中的腐植酸,对腐植酸和COD的去除率分别为64.9% 和40.8%。但反应受水样pH的影响较大。
腐植酸由于分子量介于1000~3000之间,且属于一类化合物而非单组份的物质,普通气象色谱法无法检测其浓度,造成其定量和定性分析测试都很难普及。光谱学测试具有样品预处理简单、操作简便、灵敏度高等优点,因此被越来越广泛地用于天然水体溶解性有机物(DOM)光谱特征、分子量特征分析和物质组成及来源鉴别[4~6]。特定波长下紫外吸收值对可溶性有机碳的比值(SUVA)可用来区分可溶性有机物组成[7],如SUVA254nm常被用于表征腐殖质样品中的芳香性结构,其值越高芳香性越强[8]。 而 Chin 等[9]则 发 现 SUVA280nm可以提供可溶性有机质的芳香性程度、源、腐殖化程度和分子量等重要的信息,并且该值与DOM的芳香性、平均分子量均具有良好的相关性。还有研究[10]认为250和365nm处的紫外吸收值之比可以较好地反映水溶性有机质的分子状况,比值越小,则水溶性有机物的分子质量越大[11]。
本文利用光谱学方法对臭氧处理前后的自然水体浓度范围的腐植酸溶液进行测试和分析,分析各种光谱方法的差异和一致性,并对饮用水中腐植酸的预氧化工艺提出建议。
2 实验部分
2.1 药品
腐植酸:北京化学试剂公司,其傅里叶红外光谱如图1,经与特征键和基团的红外光谱对比分析,主要基团为酐、芳环、硝基、非共轭烯、酮等。由于用氢氧化钠溶解,则酐重新生成羧酸或羧酸钠盐。
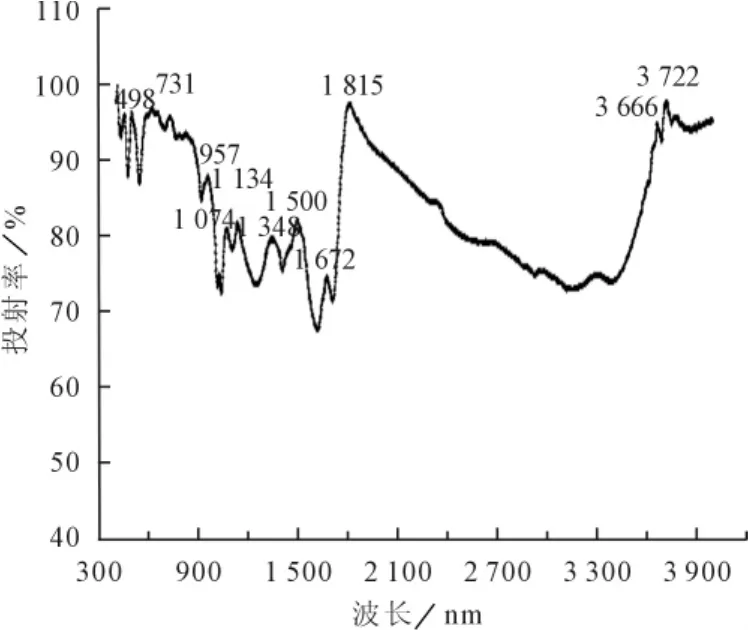
图1 商品腐植酸的傅里叶红外光谱
称取1.000g腐植酸,用少量浓度为0.1mol/L的NaOH溶解后,用去离子水定容至1L作为储备液。作为饮用水源的天然水中腐植酸的质量浓度一般为几到几十mg/L,模拟水样中腐植酸的质量浓度以20mg/L作为研究基础[3],用去离子水稀释配制模拟水样(简称水样)。
2.2 实验方法
紫外范围的扫描秒光谱特征为在200~380nm下每隔10nm读数,在较大值处每隔1nm读数,扣除不同波长下空白的吸光度值,形成吸光度变化曲线,找出最大吸收峰的特征波长。在扫描光谱特征分析实验中,取臭氧氧化时间为5s,UV照射时间为2h。
对100mL初始浓度为20mg/L的腐植酸水样进行臭氧氧化(启达臭氧发生器,型号QD-D5A-Y,臭氧产量5g/h,160W)照射氧化实验,在不同反应时间取样测定总有机碳(TOC)和紫外吸光度(UV)。
2.3 分析方法
UV254、UV250、UV280、UV365均采用上海美谱达公司生产的UV1100型紫外分光光度计、1cm石英比色皿,以去离子水作空白,在室温下测定水样在254 nm、250nm、280nm、365nm 处的吸光度。TOC 采用德国元素分析系统,liqui TOC elemntar对反应前后溶液的TOC进行测定。
3 结果与讨论
3.1 紫外范围的扫描光谱特征分析
在紫外光范围内对臭氧预氧化后的水样结果,与原液相比如图2所示。
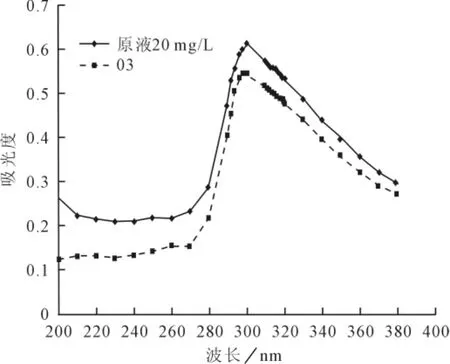
图2 预氧化紫外扫描光谱吸收
从图2可以看出,原液及臭氧氧化处理后的液体均在300nm处具有最强的吸收峰,说明腐植酸类物质在300nm处具有特征吸收峰值,可以作为判定腐植酸是否存在的依据。但其在哪个波长吸光度下或某两个吸光度比值与腐植酸浓度具有线性相关性,能够作为定量分析的依据是需要考察的内容。
3.2 TOC随臭氧氧化时间的变化
由图3可以看出,臭氧对于有机碳的去除具有较好的趋势性,随臭氧氧化时间的增加,有机碳含量逐渐减少,在9mgC/L时基本达到平衡,经简单计算可知臭氧对有机碳去除率稳定在42%左右。
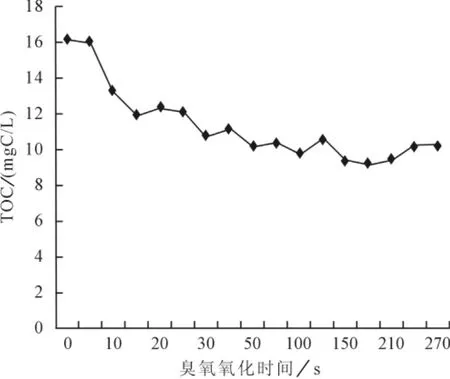
图3 臭氧氧化时间的TOC变化曲线
臭氧氧化作为饮用水的预氧化工艺,稳定的降解效果能较好地控制副产物和反应速率,设计工艺参数。由图3可知,在臭氧氧化100s以后,总有机碳的量趋于稳定。
3.3 臭氧处理光谱特征比较分析
3.3.1 UV254与 TOC
UV254是水在254nm波长下的吸光度。在此波长下的紫外吸收物质,主要是带共轭结构或含芳香环结构的不饱和有机物[13]。在实际测试中,可以利用测定UV254间接反映水中有机物浓度变化情况。
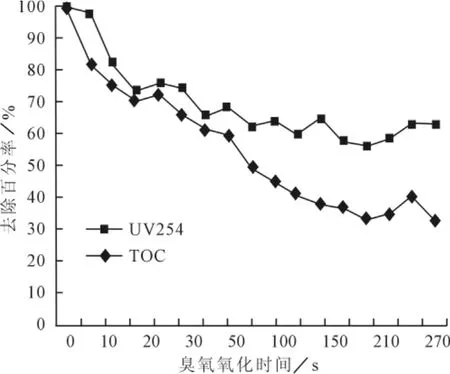
图4 UV254与TOC随臭氧氧化时间的去除率
从图4可以看出,臭氧氧化对芳香结构,臭氧有一定的作用,最多可使UV254下降65%,即使65%的芳香环打开,形成无机物或有机小分子。但同时,TOC在臭氧作用30s后处于波动状态,没有明显的减少,这与UV254的持续减少有明显区别,说明长时间臭氧作用下芳香结构能被破坏,但产物小分子大部分也属于有机物,所以依然能通过TOC的测试被反应出来。
如果目的是将有机物氧化为无机碳而不是分子量较小的有机分子,则臭氧作用时间应取小于30s。
3.3.2 SUVA280、SUVA254
SUVA254常被用于表征腐殖质样品中的芳香性结构,其值越高芳香性越强[8]。从图5可以看出臭氧较易破坏溶解性有机物的芳香性。
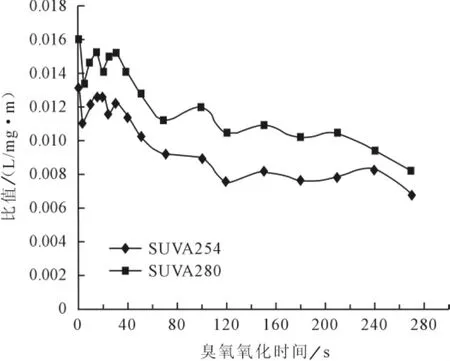
图5 臭氧氧化SUVA280与SUV254变化
而Chin等[9]则认为酚类、苯胺衍生物、安息香酸、多烯等物质在270~280nm发生π~π*电子迁移,因此选择280nm波长下的吸光度值进行研究,发现SUVA280nm与溶解性有机物的芳香性程度和分子量成正比,并且该值与DOM的芳香性、平均分子量均具有良好的正相关性。由图5可以看出,对于臭氧氧化,SUVA280与SUVA254具有较好的相关性,在芳香性的判断上与SUVA254具有一致性。
由图5可以看出臭氧氧化时间越长,其SUVA280与SUVA254均减小,说明芳香性和平均分子量越小,而在120s之后SUVA280与SUVA254均下降幅度较小。
3.3.3 UV250/UV365
E2/E3是250和365nm处的紫外吸收值之比,有研究认为E2/E3可以较好地反映水溶性有机质的分子状况,E2/E3越小,则水溶性有机物的分子质量越大[11]。
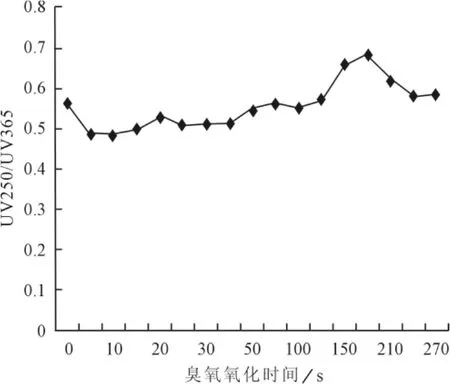
图6 臭氧氧化UV250/UV365变化
根据图6可以看到,臭氧氧化后溶液250/365nm吸光度比值前120s内都在0.5~0.6区间内缓慢增加,在臭氧氧化150s时比值增大到0.66,180s时到0.69,然后逐渐又回到0.5与0.6之间,说明臭氧氧化150s至180s时能有限地减小腐植酸内大分子的分子质量。
在基团中,键能较低的更容易被打断,其键能排序为芳环>酮>非共轭烯>硝基>羧酸,一般情况下羧酸最可能先被氧化。而有研究[14]表明小分子有机物(如一些具有乙酰基团的低分子量有机物)具有较高的氯仿生成势,可能会使氯仿生成量升高。所以,预氧化程度并非越彻底越好,如果生成物质具有更易于卤代反应的特征,预氧化就失去了减少三卤化物的作用。
4 结语
臭氧作为氧化剂对水中溶解性腐植酸有一定的效果,对于UV254和TOC,其趋势有明显的不同,说明臭氧作用前30s较多的有机碳被氧化为无机碳,而超过30s后则主要为小分子有机物;臭氧氧化腐植酸的SUVA280与SUVA254具有较好的相关性,显示大分子有机物部分被氧化为小分子;UV250/UV365的结果显示臭氧需要更长的作用时间才能能更大程度的氧化腐植酸,但其副产物不可控,导致饮用水安全性存在不确定因素。
臭氧预氧化在效果稳定性、反应迅速性和安全性方面领先,适宜作为自来水预氧化工艺,针对5g/h的产量和100mL的浓度为20mg/L的腐植酸溶液,其氧化时间可取30s,针对其他条件,更为详细的参数还需要今后深入而全面的研究。
[1]王晓昌.臭氧用于给水处理的几个理论和技术问题[J].西安建筑科技大学学报,1998,30(4):307~311.
[2]金鹏康,王晓昌,王洪波,等.水中腐植酸的臭氧化特性研究[J].西安建筑科技大学学报,2000,32(4):334~337
[3]黄国忠,丁月红,董小伟,等.活性炭催化臭氧氧化去除水中的腐植酸[J].化工环保,2007,27(3):200~203
[4]Hera N,Amya G,McKnighta D,et al.Characterization of DOM as a function of MW by fluorescence EEM and HPLC-SEC using UVA,DOC,and fluorescence detection[J].Water Res,2003,37:4295~4303.
[5]Wada S,Aokib MN,Tsuchiya Y,et al.Quantitative and qualitative analyses of dissolved organic matter released from Ecklonia cava Kjellman,in Oura Bay,Shimoda,Izu Peninsula,Japan[J].Exp Mar Biol Ecol,2007,349:344~358.
[6]Parlanti E,Wörz K,Geoffroy L et al.Dissolved organic matter fluorescence spectroscopy as a tool to estimate biological activity in a coastal zone submitted to anthropogenic inputs[J].Org Geochem,2000,31:1765~1781.
[7]Buffle J,Deladoey P,Zumstein J,et al.Analysis and characterization of natural organic matters in freshwaters.I.Study of analytical techniques[J].Hydrol,1983,44(2):325~362.
[8]McKnight DM,Boyer EW,Westerhoff PK,et al.Spectrofluorometric characterization of dissolved organic matter for indication of precursor organic materials and aromaticity[J].Limnol Oceanogr,2001,46(1):38~48.
[9]Chin YP,Aiken G,O'Loughlin E.Molecular weight,polydispersity,and spectroscopic properties of aquatic humic substances[J].Environ Sci Technol,1994(28):1853~1858.
[10]Huovinen P S,Penttil H,Soimasuo M R.Spectral attenuation of solar ultraviolet radiation in humic lakes in Central Finland[J].Chemosphere,2003,51(3):205~214.
[11]Artinger R,Buckau G,Geyer S,et al.Characterization of groundwater humic substances:influence of sedimentary organic carbon[J].Appl Geochem,2000(15):97~116.
[13]张永吉,李圭白,周玲玲.高锰酸盐复合药剂预氧化去除腐植酸色度研究[J].高技术通讯,2004(4):103~106
[14]Singer P C.Spectrofluorometric materials of precursor organic to anthropogentic[J].Water Sci Tech,1999,40(9):25.
