HPLC 测定大菟丝子中的咖啡酸含量和薄层鉴别
2013-08-25欧恒熙鲍家科曹诗伟
欧恒熙 鲍家科 曹诗伟 刘 玲
1.贵阳医学院药学院,贵州 贵阳 550004;2.贵州省药品审评认证中心,贵州 贵阳 550004;3.贵州神奇药业股份有限公司,贵州 贵阳 550004
大菟丝子为旋花科 (Cuscutaceae)菟丝子属 (Cuscuta)植物金灯藤 (Cuscuta japonica Choisy)全草的种子,又名日本菟丝子,始载于《本经》、《别录》[1]。大菟丝子为中药菟丝子的常见商品药材之一,也是我国西南地区收载于药材地方标准的习用药材。具有滋补肝肾,固精缩尿,安胎,明目,止泻等功能[2]。大菟丝子的定性、定量分析目前未见报道。据文献报道本品含大量淀粉酶、维生素A类物质及树脂样配糖体,纸层析检查栎精类及新绿原酸组成的苷类等黄酮化合物[3],郭洪祝,李家实[4]报道其中还含有咖啡酸、β-谷甾醇、花生酸、胡萝卜苷。本文以咖啡酸为指标性成分,建立大菟丝子药材中咖啡酸的高效液相色谱 (HPLC)测定方法和薄层色谱 (TLC)鉴别,并对不同产地大菟丝子中的咖啡酸进行比较,以其为大菟丝子的质量评价提供依据。
1 材料
1.1 仪器 日本岛津LC-20AD高效液相色谱仪 (SPDM20A二极管阵列检测器、CBM-20A系统控制器、CTO-20AC柱温箱、LC-20AT泵、SIL-20A自动进样器、LC2000色谱数据工作站),XS205型电子分析天平 (梅特勒-托利多仪器有限公司),CH-300型超声波清洗机 (北京创新德超声电子研究所),DK-98-11A型电热恒温水浴锅 (天津市泰斯特仪器有限公司),中药材粉碎机 (浙江温岭市林大机械有限公司)。
1.2 试药 咖啡酸 (批号 110885-200102,由中国药品生物制品检定所提供)、硅胶G薄层板 (青岛海洋化工厂),甲醇为色谱纯、分析纯,其余试剂均为分析纯,水为重蒸馏水。10批大菟丝子样品,均由贵阳中医学院陈德媛研究员鉴定为为旋花科植物金灯藤Cuscutaceae的全草的种子。药材来源见表1。
2 方法与结果
2.1 薄层色谱鉴别
2.1.1 对照品溶液的制备 取咖啡酸对照品,加甲醇制成每1ml含0.5mg的溶液,作为对照品溶液。
2.1.2 供试品溶液的制备 取本品粉末1g,加5%甲酸的甲醇溶液20ml,超声处理20min,放置过夜,滤过,滤液蒸干,残渣加水10ml使其溶解,滤过,滤液用乙酸乙酯振摇提取2次,每次10ml,合并乙酸乙酯液,蒸干,残渣加甲醇1ml使其溶解,作为供试品溶液。
2.1.3 薄层色谱条件及其结果 照薄层色谱法 (2010年版《中国药典》一部附录Ⅵ B)试验[8],吸取上述两种溶液各6 μl,分别点于同一以羧甲基纤维素纳为黏合剂的硅胶G薄层板上,以乙酸丁酯-甲酸-水 (7∶2.5∶2.5) 上层溶液为展开剂,展开,取出,晾干,105℃加热至斑点清晰。置紫外灯 (365nm)下检视,供试品色谱中,在与对照品色谱相应的位置上,显相同颜色的斑点。结果表明,10批不同产地大菟丝子药材与对照品比较均能出现相同Rf值斑点。见图1。
2.2 咖啡酸含量测定
2.2.1 色谱条件 色谱柱:Diamosil C18色谱柱 (4.6mm×200mm,5μm);以甲醇-0.1%磷酸溶液 (75∶25) 为流动相;检测波长:325nm;柱温:30℃;流速:1.0ml/min;进样量:10μl。
2.2.2 对照品溶液的制备 精密称取在110℃干燥于恒重的咖啡酸对照品 1.52mg、12.5mg,分别置于 10ml、5ml棕色量瓶中,加甲醇至刻度,摇匀,即得咖啡酸浓度为0.1520mg/ml、2.500mg/ml的对照品溶液。

2.2.3 供试品溶液的制备 取大菟丝子粉末 (过四号筛)约0.5g,精密称定,置50ml具塞锥形瓶中,精密加入5%的甲酸甲醇溶液10ml,密塞,摇匀,称定重量,过夜,超声处理30分钟,取出,再称定重量,用5%的甲酸甲醇溶液补足减失的重量,摇匀,取上清液,经0.45μm微孔滤膜滤过,取续滤液,避光保存备用,即得[7]。
2.2.4 标准曲线的绘制 精密吸取咖啡酸对照品溶液 (咖啡酸 C=0.1520mg/ml)2、4、6、8、10、12、14μl进样,按上述色谱条件测定色谱峰面积,以峰面积A对进样量(μg)进行线性回归计算,得线性回归方程为:A咖啡酸=9.6 × 105X-69203,R2=0.9999。咖啡酸在 0.3040 ~2.1280μg,与峰面积线性关系良好。
2.2.5 精密度试验 精密吸取咖啡酸对照品溶液 (咖啡酸C=0.1520mg/ml)10μl,连续进样5次测定,咖啡酸峰面值的RSD为0.3%,表明仪器精密度良好。

2.2.6 稳定性试验 取供试品溶液 (2号样品),分别于0、4、8、24h进样 10μl测定,咖啡酸面积值 RSD为0.7%,表明供试品溶液在24h内具有良好的稳定性。
2.2.7 重复性试验 对同一批大菟丝子药材 (2号样品)平行制备5份供试品溶液,分别进样测定,按干燥品计算其咖啡酸含量,其RSD分别为2.3%,表明该方法的重复性良好。
2.2.8 加样回收率试验 精密称取同一大菟丝子药材粉末(含咖啡酸2.4839 mg·g-1)5份,各约0.5 g,每份等量加入咖啡酸 (C=2.500mg/ml),按“2.2.3”项下进行样品制备并测定,计算回收率。咖啡酸的平均回收率为100.03%,RSD为0.2%,测定结果见表2。
2.2.9 样品测定 按“2.2.3”项,对10批大菟丝子药材进行测定,每批平行测定两份,测定结果见表1。
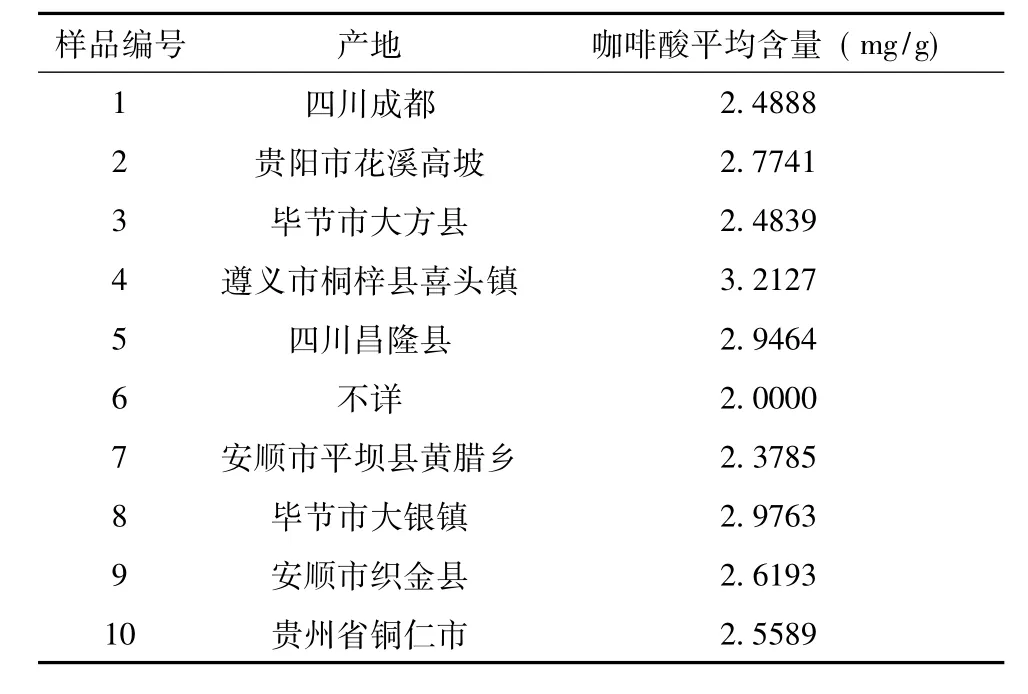
表1 药材来源及样品含量测定结果
根据10批样品测定结果分析,测定结果咖啡酸含量最高值2.9763mg/g,平均值为2.6439mg/g,各批次样品中咖啡酸含量相差不大。故暂定大菟丝子含咖啡酸不得少于 0.2%。

表2 咖啡酸加样回收率试验测定结果
3 讨论
3.1 大菟丝子药材在我国西南地区被广泛运用,但关于它的含量测定的文献未见报道,本文建立了大菟丝子药材不同产地的咖啡酸的含量检测和TLC鉴别,所建方法简便、准确、可行,重现性好,可适用于对大菟丝子药材的质量控制。
3.2 按2010版药典蒲公英标准中的咖啡酸HPLC的含量测定方法,以甲醇 -磷酸盐缓冲液 (23∶77)为流动相[5];在323nm的波长处有最大吸收,基线较稳。在本实验中用甲醇-0.1%磷酸 (25∶75)的流动相,在325nm的波长处和上述流动相作比较,后者基线更为稳定,并且减少对柱子的损害。同时,本实验也采用直接加甲醇超声30min和照《2010年版药典》加5%的甲酸甲醇溶液超声30min,放冷,直接测定其含量的方法,但对照和样品的出峰时间都不吻合。以此笔者推断大菟丝子中游历咖啡酸存在很少,而大多是以苷的形式存在于药材中。所以本实验加5%的甲酸甲醇溶液,放置过夜进行酸水解出咖啡酸来测定其含量。
3.3 本实验还采用上述相同的处理方法,鉴别和测定菟丝子药材中咖啡酸的含量,并未发现其有咖啡酸的成分。故此可否作为两种药材的区分鉴别依据值得进一步研究验证。
[1]《中华本草》编委会.中华本草[M].上海:上海科学技术出版社,1999:5864.
[2]贵州省药品监督管理局.贵州省中药材、民族药材质量标准 (2003年版)[M].贵阳:贵州科技出版社,2003.
[3] Tronchet J.Ann.Sci.Univ.Besancon.Botan .1962;2(18)101.See.CA.1963,59:18109.
[4]郭洪祝,李家实,吴楠,等.北京中医药大学学报,2000,23(2).
[5]中国药典委员会.中国药典 (一部)[S].北京:化学工业出版社,2010:331.
