传染性法氏囊病毒免疫原基因在毕赤酵母中的高效分泌表达
2013-08-24蓝胜芝徐素珍李宝臣曹玉飞赵艳敏金顺福
蓝胜芝,徐素珍,李宝臣,曹玉飞,赵艳敏,金顺福
(浙江诺倍威生物技术有限公司,浙江杭州 310018)
传染性法氏囊病(Infectious bursal disease,IBD)是一种由传染性法氏囊病病毒(Infectious bursal disease virus,IBDV)引起的急性、高度接触性传染病,常导致鸡群的大量死亡,同时导致免疫抑制[1],使得鸡群疫苗接种免疫失败而导致继发、并发疾病大量增加,造成严重的经济损失。目前常用的防治手段是疫苗接种,包括减毒疫苗和灭活疫苗,但自IBDV发现至今,新的变异株、强毒株、超强毒株不断出现[1],分子结构的改变导致病毒致病力的改变及宿主对疫苗应答的改变,使得传统疫苗已不能控制其流行,给疾病的预防与治疗带来新的困难与挑战。
传染性法氏囊亚单位疫苗的研究目前主要是基于大肠杆菌[2]和酵母这两种表达系统。比较细菌和酵母这两种宿主细胞的特性,酵母的优势非常明显[3]。甲醇毕赤酵母表达系统在所有表达系统中表达量最高,文献报道有高达12g/L,该系统能将表达的重组蛋白进行精确翻译后加工修饰,接近于天然蛋白。分泌型酵母表达载体能将目的蛋白分泌到发酵上清液中,而酵母自身的本底蛋白大部分都留在细胞中,免去了沉淀破碎和纯化等繁杂的后续处理。本研究中我们将鸡传染性法氏囊病(IBD)超强毒株(vvIBDV)主要免疫原性基因VP2借助表达载体pPICZαA使目的基因整合到毕赤酵母X-33染色体中,对VP2重组蛋白在毕赤酵母中的高效分泌表达进行了研究。
1 材料和方法
1.1 材料
1.1.1 质粒和菌株
vvIBDV 强毒株由本室分离并保存;大肠杆菌JM109由本实验室保存;受体菌株Pichia pastoris X-33(His- Mut+)、表达载体pPICZαA和抗生素ZeocinTM购自Invitrogen公司。
1.1.2 引物
上游引物(5’- CACTCGAGAAAAGAATGA CAAACCTGCAA -3’)和下游引物(5’-TAGCGGCC CTTACCTTAGGGCCCGGATTATGT-3’),由Invitrogen生物技术有限公司合成。
1.1.3 其它
限制性内切酶、T4 DNA 连接酶、高保真Taq DNA 聚合酶、DNA分子质量标准均购自大连宝生物工程公司;配制培养基用酵母抽提物、水解乳蛋白、YNB、生物素等分别购自英国OXIOD 公司与Sigma 公司;其它试剂均为进口或国产分析纯产品。
1.2 方法
1.2.1 RT-PCR扩增
参考已报道的vvIBDV的VP2基因序列,应用Oligo5.0软件在基因上下游设计一对引物。上游引物中引入酶切位点XhoI和蛋白酶KEX2的切割序列,下游引物中引入NotI酶切位点和终止密码子TAA。引物序列分别是:
上游引物 :5’-CACTCGAGAAAAGAATGACA AACCTGCAA-3’
下游引物:5’-TAGCGGCCGCTTACCTTAG GGCCCGGATTATGT-3’
下划线分别是XhoI、Not I酶切位点。斜体为蛋白酶KEX2的切割序列。此构建原因一:当重组蛋白由信号肽引导从胞内分泌至胞外时,经信号肽蛋白切割酶切割后,在目的蛋白的N端不会残留多余的氨基酸,从而不影响其天然免疫原性。原因二:在下游引物中添加TAA终止密码子,使得重组蛋白只表达VP2蛋白,而不带有酵母载体自身的c-myc epitope抗原表位和六组氨酸标签polyhistidine tag,使目的蛋白保持天然活性。
应用RT-PCR方法,从国内鸡传染性法氏囊病(IBV)众多流行株中分离出超强毒株(vvIBDV)中扩增得到IBDV主要保护性抗原VP2基因的开放编码框。
1.2.2 酵母表达载体的构建
将扩增纯化后的目的基因VP2与表达载体pPICZαA分别用XhoI/NotI进行双酶切,经1%琼脂糖凝胶回收纯化,用T4连接酶进行连接反应,得到的重组表达质粒命名为pPICZαA-VP2。将该重组表达质粒再转化大肠杆菌JM109感受态细胞,并在含有抗生素Zeocin的低盐LB培养基中分离得到阳性克隆。试剂盒提取质粒,利用XhoI/NotI对pPICZαA-VP2 重组质粒进行双酶切鉴定,利用pPICZαA载体两端的5’AOX1、3’AOX1 引物以及目的基因上下游引物进行PCR鉴定。将鉴定正确的重组质粒送至Invitrogen公司测序验证。
1.2.3 重组质粒电转毕赤酵母
按Invitrogen Pichia操作指南制备Pichia pastoris X-33感受态。取100μL感受态细胞与10μL(7-10μg)SacⅠ线性化的重组表达质粒混合,注入预冷的0.2 cm电转杯中,冰浴5 min于Bio-Rad电转仪2.0KV、5ms条件下电转化后,立即加入1 mL预冷的1 mol/L山梨醇,转移到小试管中30℃静置1h,取50、100、200μL菌液涂布于YPDS(Zeocin 100μg/mL)抗性选择平板上,30℃倒置培养2-3d,直至克隆长出。
1.2.4 高抗性(拷贝)重组菌株的筛选
载体pPICZαA中含有Zeocin抗性基因,根据文献报道,重组酵母菌株抵抗Zeocin的能力与其整合质粒拷贝数成正比,因此,用含有不同Zeocin浓度(100μg/mL -3000μg/mL)的琼脂平板可以快速筛选含多拷贝外源基因转化株。
具体操作方法是:用灭菌牙签挑取在Zeocin浓度为100μg/mL的电转平板上的单菌落,将其分别点种在Zeocin浓度为1000μg/mL、2000μg/mL、3000μg/mL的YPDS平板上。将平板倒置于恒温培养箱中,30℃培养2-3d。按菌落长势大小,从大到小挑取Zeocin浓度为3000μg/mL的YPDS平板上的20株单克隆。将此20株单克隆分别划线Zeocin浓度为100μg/mL的YPDS平板,以纯化单克隆。
1.2.5 PCR鉴定阳性克隆及其表型
外源基因整合酵母染色体的方式有两种,分别是置换重组和交叉重组,这两种重组方式相应产生两种不同的菌株分别是甲醇利用缓慢型菌株(Muts)和甲醇利用快速型菌株(Mut+)。鉴定这两种表型,较为简便的鉴别方式是PCR方法。利用表达载体的两端引物5'AOX1、3'AOX1进行PCR鉴定,若PCR扩增产物为单一片段,大小为2.0kb,则为慢速生长型转化子,缓慢利用甲醇;若PCR扩增产物除了1.3kb左右的目的基因外,还有一条约2.2kb大小的基因片断,则为快速型转化子,能够快速利用甲醇。
1.2.6 摇瓶诱导表达
将重组菌和空载体转化酵母菌单克隆分别接种于100 mL的BMGY培养基中,28-30℃,250-300 r/min培养至菌体OD600值为2-6,1500-3000g,室温离心5 min收集菌体。菌体沉淀用20mL BMMY培养基重悬,于28-30℃,250-300 r/min培养4-5 d,每隔24 h补加甲醇至终浓度为1%,并在0、24、48、60、72、84、96、108、120 h分别取少量的培养上清和菌体,以确定表达的最佳时间。诱导培养结束后,培养液12 000 r/min离心5 min,分别收集上清和沉淀,于-20℃保存备用。
1.2.7 SDS-PAGE及Bradford法蛋白浓度测定
经SDS-PAGE检测有VP2表达的上清进行Bradford蛋白浓度测定,参照试剂盒说明书配置标准蛋白浓度,以A595nm测定的OD值为纵坐标,标准蛋白含量为横坐标,在坐标轴上绘制标准曲线,另取两支干净的试管(做一重复),加入合适浓度的待测样品,使其测定值在标准曲线的范围内,测定方法同上,由样品液的吸光度查标准曲线即可求出含量。
1.2.8 表达蛋白的Westren-Blot鉴定
经SDS-PAGE检测有VP2表达的上清进行Western Blot鉴定。分别取不同时间表达上清液20μL,于12%的SDS-PAGE凝胶电泳,电泳后的聚丙烯酰胺凝胶通过电转移系统(BioRad)以200mA,1h的参数电转移至硝酸纤维素膜。电转完毕加入封闭液(5%脱脂奶粉于PBS中)4℃静置过夜,第二天取出于室温缓摇1h;用TBST洗膜,加入鸡法氏囊多克隆抗体(1:120稀释)室温缓摇2h,用TBST洗膜,加入含适量二抗(兔抗鸡1∶400)的Dilution Buffer,室温孵育1h;用TBST洗膜,DAB显色,待蛋白带的颜色达到要求(约10min),以水漂洗,终止显色,拍照记录。
1.2.9 表达蛋白的免疫原性鉴定
取不同时间发酵上清液,经乳化后,以肌肉注射的方式免疫21日龄鸡,免疫剂量为0.5ml/只;免疫后每周采集血清(共采血26周,其中第13周后改为每个月采血1次),应用Biochek 传染性法氏囊抗体检测试剂盒(ck113)进行检测,观察抗体变化规律,同时设空载体表达的发酵上清液作为对照。结果判断依据为:S/P=(待检样品平均值-阴性对照平均值)/(阳性对照平均值-阴性对照平均值。若S/P≤0.149 为阴性,S/P=0.150~0.199为可疑,S/P≥0.200 为阳性。
2 结果
2.1 含目的基因VP2重组质粒的构建与鉴定
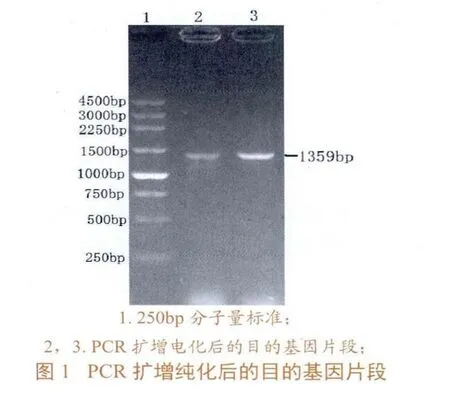
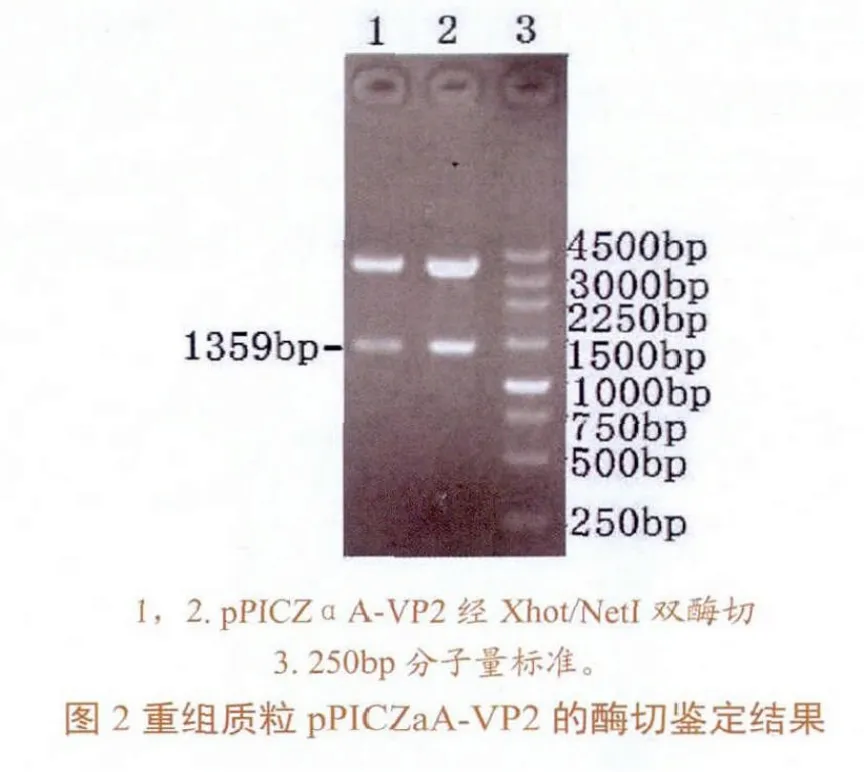
应用RT-PCR法从分离得到的vvIBDV中扩增获得目的基因,依次为模板进行PCR扩增,并纯化回收,电泳结果显示,PCR产物大小约为1359 bp,与预期大小一致(图1)。将PCR产物用XhoⅠ、NotⅠ双酶切,克隆至载体质粒pPICZαA强启动子PAOX1下游的XhoⅠ和NotⅠ双酶切窗口中,构建重组质粒pPICZαAVP2。通过XhoⅠ、NotⅠ酶切pPICZαA-VP2进行鉴定,得到大小两个片段,大片段约为3.6 kb,包含载体pPICZαA的大部分序列;小片段约为1359bp,为含VP2基因的片段。由酶切鉴定的结果可知,pPICZαA-VP2为所需的重组质粒(图2)。
2.2 重组质粒测序结果
将上述鉴定正确的重组质粒送至Invitrogen测序,测序结果翻译成氨基酸序列后发现,VP2 ORF中含有超强毒株所具有的富含丝氨酸的保守七肽区[4](S-W-S-A-S-G-S),此外在其亲水区第222、256、294和299位置上分别是超强毒株所特有的A、A、I、S,而一般弱毒株则相应是另外四个氨基酸P(或Q或T)、V、L、N。所以可以确定实验得到的是超强毒株(vvIBDV)的VP2基因,这对目前已经流行的超强毒株传染性法氏囊病的控制有着重要意义。
分析VP2基因N端序列,已经成功融合了pPICZaA 载体分泌信号肽下游的蛋白酶KEX2和STE13切割位点,保证VP2蛋白能从信号肽上成功切割,并不会残留多余氨基酸而影响其抗原性。在VP2 C 端添加终止子TAA后,已去除载体上的c-myc epitope和 polyhistidine tag。
2.3 重组质粒电转化毕赤酵母
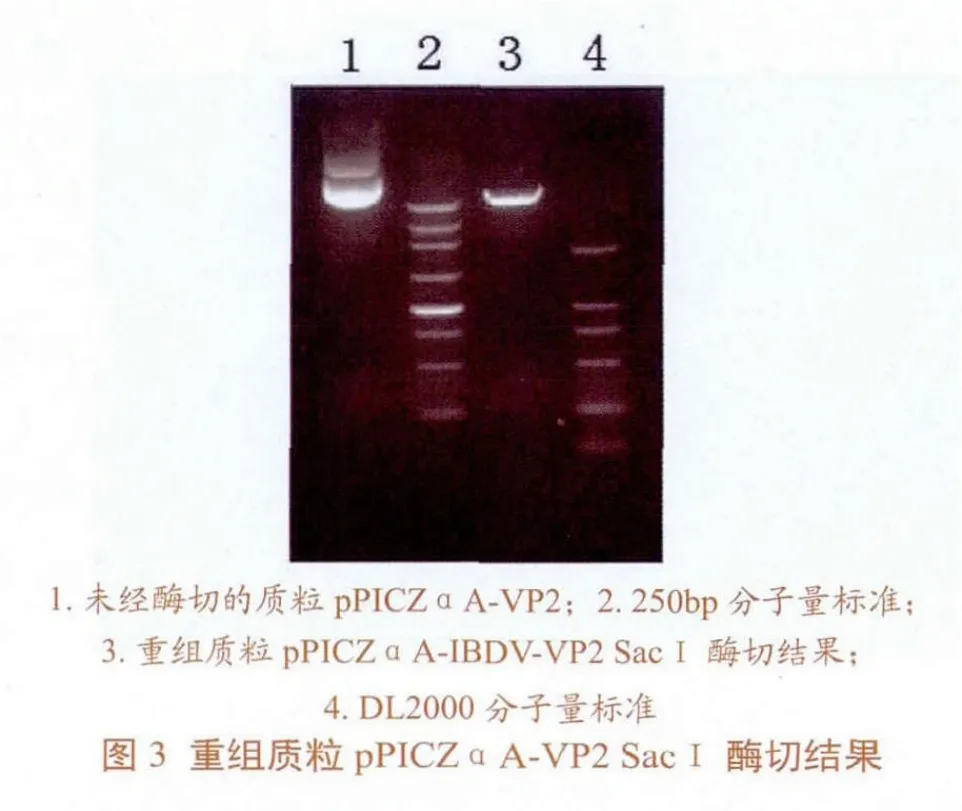
重组质粒pPICZαA-VP2经SacⅠ酶切线性化后(图3),经DNA Fragment Puri fi cation Kit纯化浓缩后,于Bio-Rad电转仪上高压脉冲电流转化宿主菌巴斯德毕赤酵母X-33,转化物涂布于含100μg/mL Zeocin的YPDS板上,28℃培养2-3 d,直至克隆长出。
2.4 PCR鉴定阳性克隆及表型
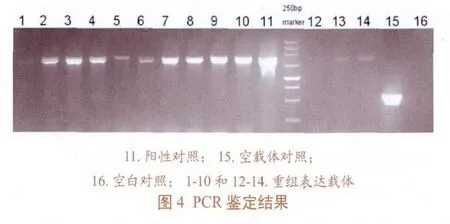
通过载体测评5’AOX1/3’AOX1进行PCR来鉴定表型(图4)。经电泳结果显示大部分工程菌是Muts,即重组质粒整合到宿主染色体上的方式是置换重组,也称双位点交换(double crosscover),发生在染色体AOX1(或aox1:ARG4)位点和表达质粒中的PAOX1及转录终止区。含PAOX1、外源基因和转录终止区的表达单位置换了染色体上完整的有功能的AOX1基因,因此产生的表达菌的表型为His+Muts(AOX1-AOX2+)。
2.5 表达产物的SDS-PAGE鉴定
按摇瓶培养方法对基因工程菌用5g/L甲醇浓度诱导培养120h。在120h的甲醇诱导培养过程中,随着诱导时间的增长,目的蛋白表达量也逐渐增多,96h显著提高,之后目的蛋白量基本不变(图5)。根据理论推算,比蛋白理论值分子量(49.8 kDa)大的66kDa应为糖基化的VP2。
2.6 Bradford法测定蛋白浓度
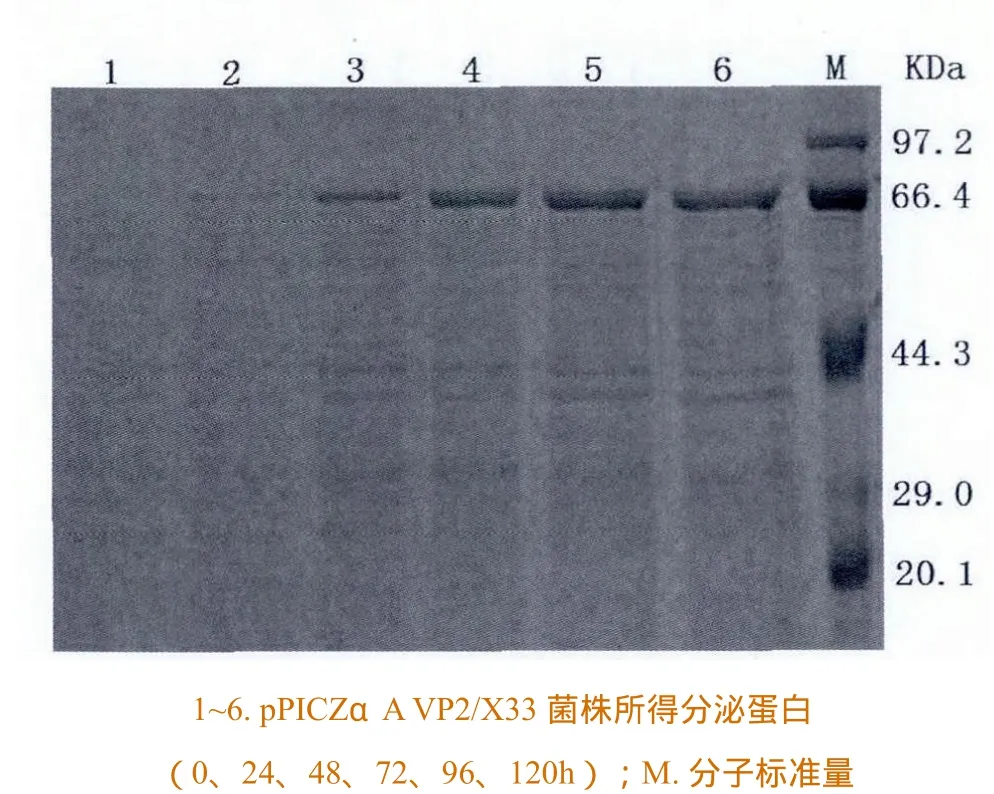
图5 分泌型表达菌株在不同发酵时间所得的蛋白上清的SDS PAGE分析
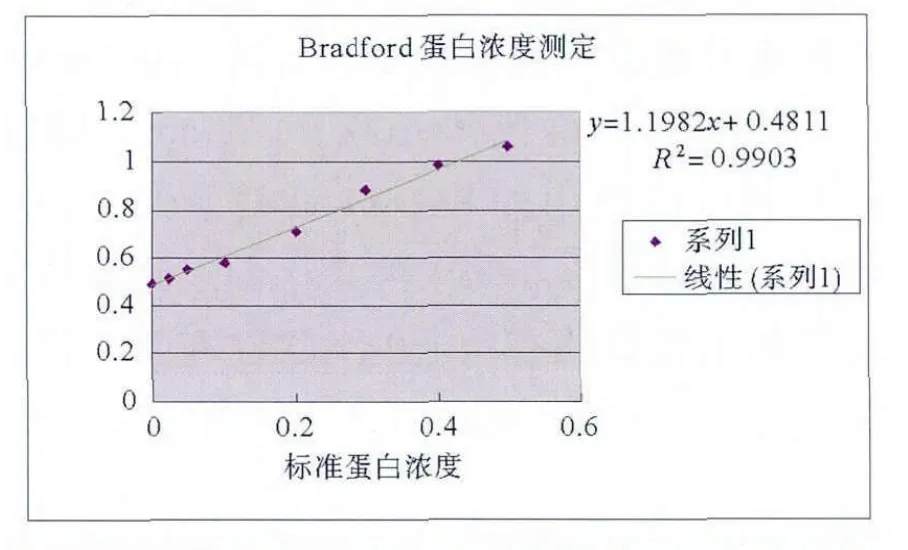
图6 BSA蛋白标准曲线
将96h收获的表达上清液,经10倍稀释后,于562 nm处测吸光度值为0.2317,由标准曲线计算样品总蛋白浓度为1.53 mg/mL(图6)。对目的蛋白条带用Image Master VDS系统进行扫描处理,得到目的蛋白占表达上清总蛋白百分含量为30%,因此最终目的蛋白浓度约为0.459mg/mL。
2.7 表达产物的Western Blot检测鉴定
将不同时间收获的表达上清进行Western Blot鉴定(图7)。结果表明,重组酵母工程菌表达的目的蛋白可以与法氏囊阳性血清发生特异性反应,该蛋白具有鸡传染性法氏囊病病毒天然蛋白的生物活性。
2.8 表达产物的免疫原性鉴定
将不同时间发酵上清液免疫鸡后采血检测抗体产生情况,以空载体表达的发酵上清液没有诱导鸡体产生中和性抗体,这可以说明,中和性抗体完全是由IBDV 主要保护性抗原VP2蛋白诱导产生。同时96h表达产物抗体水平的均一度较120h要好(即变异度更低)(图8)。96h和120h表达产物都在一免后2周左右即产生保护性中和抗体,从长时间检测情况来看,鸡组抗体水平呈有规律的动态变化,到后期呈缓慢下降趋势,亚单位疫苗在鸡体内刺激产生中和抗体的维持时间较长,具有较好的免疫原性。

图7 分泌型表达菌株在不同发酵时间所得的蛋白上清的Western blot分析
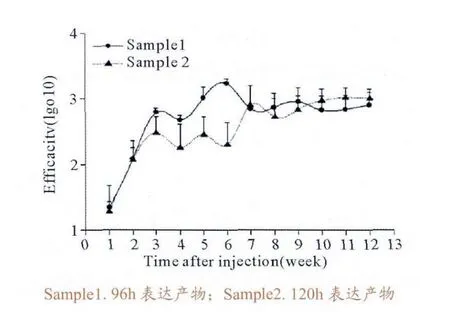
图8 间接ELISA法鉴定表达产物免疫原性
3 讨论
酵母表达载体pPICZαA上的α-factor信号肽包含83个氨基酸的前导肽及后面的一段由Lys-Arg -Glu-Ala-Glu-Ala氨基酸序列组成的间隔肽,α-factor成熟信号肽序列加工分两步,先是膜结合蛋白酶KEX2在Lys-Arg *Glu-Ala-Glu-Ala中所示的星号位置即Arg及Glu之间进行切割,接着蛋白酶STE13切割Glu-Ala重复序列,即序列Glu-Ala*Glu-Ala*中星号所示位置。图9是α-factor信号肽部分序列,其中小黑三角符合就是表示这两种酶的切割位置)。前导肽和间隔肽对蛋白的正确切割和分泌至关重要,但有时由于上述两种基因产物的切割活力不同,会在外源蛋白的N 端产生不同的切割位点,许多情况下,Stel13切割Glu-Ala重复序列的效率不高,使一些蛋白在分泌中会在N端残留有( Glu-Ala)1-2融合序列,即产生了所谓的酵母信号肽切割不完全现象,这可能会影响外源蛋白的活性。

图9.α-factor信号肽部分序列意图
为了获得具有天然活性的目的蛋白,我们做了以下设计:其一,在VP2蛋白N端融合了酵母表达载体pPICZαA上α-factor信号肽下游的四个氨基酸序列(Leu-Glu-Lys-Arg),前两个氨基酸序列是限制性内切酶XhoI的酶切位点,后两个氨基酸序列是膜结合蛋白酶KEX2的切割序列,即本研究中VP2蛋白只融合了其中一个蛋白酶KEX2的切割序列AAA-AGA(Lys-Arg),这样设计避免了STE13可能导致的不完全切割,保证表达的VP2蛋白能从信号肽上完全切割下来,不会残留多余氨基酸而影响其抗原性,保持蛋白的完整性和天然活性;其二,在VP2基因3'端添加终止子TAA,从而去除了载体上的两段序列c-myc epitope和polyhistidine tag,同样使得表达的目的蛋白不会残留除了自身以外的其他多余序列。
毕赤酵母常用的菌株有KM71H、GS115、X-33[5],这三种都为甲醇营养型酵母菌,具有不同的基因组型,外源基因插入时有不同的整合和重组方式,对于不同的重组质粒其表达效果也各不相同,因此本研究对这三个菌株都进行了转化筛选,根据转化子生长情况和蛋白表达量的高低,我们选择了X-33作为本研究中目的基因IBDV-VP2的最佳宿主菌。
因电转时电压的设置,电转时间及质粒的浓度,感受态细胞状态都对电转化效果影响较大,所以需要摸索电转化的最适电转仪参数,选择最适的质粒浓度和感受态细胞浓度。参考文献资料[6-8]并进行了多次实验摸索,本实验采用以下电转参数:0.2cm电转杯,电压2.0KV,电击时间5ms。最佳质粒浓度为:7μg到10μg(体积控制在10μL),感受态细胞100μL。在操作时,控制最后加入1M山梨醇的量,使得细胞浓度稍微有些粘稠为最好。另外,在加入1mL 0℃的1M山梨醇,30℃静置复苏1h后,再加入1mL YPD液体培养基,30℃、200r/min振荡复苏1 h,这样电转效果会更好。以上电转条件的优化解决了产生假阳性克隆,阳性克隆少,质粒稳定性低,拷贝数低等在转化时较常出现的问题。
本研究结果表明,VP2蛋白能顺利高效地分泌到培养基中,且动物实验结果显示表达的重组蛋白能够诱导机体产生特异性的抗体,这为未来该产品的产业化研究工作打下了一定的基础,但仍有许多方面需要进行摸索优化,对表达条件的优化以及Pichia pastoris表达系统的认识还需进行进一步的探讨。
[1]Van Den Berg TP,Gonze M,Meuleumans G. Acute infectious bursal disease in poultry: isolation and characterization of a highly virulent strain [J]. Avian Dis,1991,20(1): 133-143.
[2]高玉龙.鸡传染性法氏囊病毒VP2基因的原核表达与抗原性分析[J].中国生物制品学杂志,2006,19(2):143-145.
[3]马兴元,谭建华,朱平,等. 巴斯德毕赤酵母(Pichia pastoris)表达系统及其在外源蛋白生产中的优势与应用前景[J].中国兽医学报,2003,23(1):98-101.
[4]王永山.传染性法氏囊病病毒VP2基因高变区序列分析,中国预防兽医,2000,22(2):136-140.
[5]Zhang W Y,Jiang Y,Xu Z X,et al. Comparison of pichia pastoris KM71 and GS115 in the Process of Expressing Recombinant Proteins[J].Acta Academiae Medicinae Suzhou,2001,21(3):268-270.
[6]Briand L,Perez V,Huet J C,et al. Optimization of the production of a honeybee Odorant Binding protein by Pichia pastoris[J]. Protein Expression and Puri fi cation,1999,15(3):362-369.
[7]Fairlie W D,Zhang H,Brown P K,et al. Expression of a TGF-beta superfamily protein,macrophage inhibitory cytokine-1,in the yeast Pichia pastoris[J]. Gene,2000,254(1/2):67-76.
[8]Sreekrishna K,Brankamp R G,Kropp K E,et al. Strategies for optimal synthesis and secretion of heterologous proteins in the methlotrophic yeast Pichia pastoris[J]. Gene,1997,190(1):55-62.
