基于荷移反应的HPLC法测定L-半胱氨酸质量分数
2013-08-24侯晓蓉王建伟申屠超单伟光
王 笑,侯晓蓉,王建伟,申屠超,单伟光
(1.浙江工业大学 药学院,浙江 杭州 310032;2.浙江树人大学,浙江 杭州 310015)
基于荷移反应的HPLC法测定L-半胱氨酸质量分数
王 笑1,侯晓蓉1,王建伟1,申屠超2,单伟光1
(1.浙江工业大学 药学院,浙江 杭州 310032;2.浙江树人大学,浙江 杭州 310015)
建立基于荷移反应的L-半胱氨酸高效液相色谱(HPLC)定量方法.在pH 9.0的硼酸-硼砂缓冲溶液中,L-半胱氨酸与四氯苯醌于40℃水浴中恒温30 min,形成络合物(λmax=358 nm),采用高效液相色谱进行分析.结果表明:L-半胱氨酸与四氯苯醌形成了摩尔比为1∶1型稳定络合物.另外,L-半胱氨酸在5~100μg/mL质量浓度范围内具有良好的线性关系;低、中、高3个质量浓度的加样回收率分别为99.2%,99.1%和96.5%,相对标准偏差分别为1.3%,1.4%和1.3%.本方法准确、快速、简便且重复性良好,适用于L-半胱氨酸原料药的定量分析.
荷移反应;高效液相色谱;L-半胱氨酸;四氯苯醌
半胱氨酸是一种天然的,含有一个巯基基团的氨基酸,其类似物在一些生物进程中起着不可忽视的作用[1].国内外研究表明半胱氨酸有多种生物学作用,参与许多重要的细胞代谢过程,包括蛋白质合成、解毒和新陈代谢等.缺乏半胱氨酸容易引起一系列综合症,包括儿童生长缓慢、头发脱色、水肿、肝损伤、皮肤病变等[2-3].因此,半胱氨酸的质量控制方法有待进一步探索.
目前,测定半胱氨酸含量的方法主要有柱前衍生化 HPLC-MC[4]、毛细管电泳法[5]、荧光法[6-9]、电化学测定法[10]和伏安法[11-12]等.由于 L-半胱氨酸在紫外区无吸收,故在HPLC检测中主要采用荧光检测器.荷移光谱法提出于20世纪50年代,是根据Mulliken[13]在量子化学基础上提出的电荷转移理论发展起来的一种分析方法,并于1972年作为一个标题引入化学文献.它利用含有能够提供电子的n-电子基团或π-电子基团的药物与电子受体试剂形成荷移络合物.生成的荷移络合物往往在紫外或可见区具有特定的吸收峰,利用这些特性可以建立起荷移光谱法来测定药物质量分数.由于荷移络合物的形成,使吸收光谱发生较大幅度的红移,从而避开药物制剂或体液中其他物质的干扰,使其选择性显著提高,所以近年来荷移光谱法在药物分析方面得到广泛的应用.
将电子荷移理论引入高效液相色谱法的柱前衍生化,并研究了L-半胱氨酸与四氯苯醌形成荷移络合物的条件,建立了基于荷移反应的高效液相色谱法测定L-半胱氨酸质量分数的新方法.该方法操作条件易得、准确、快速、简便且重复性好,利用普遍应用于分析测试的UV检测器,干扰少,选择性高,结果令人满意,可用于测定L-半胱氨酸原料药的质量分数.目前基于荷移反应的半胱氨酸高效液相色谱法测定方法还未见文献报道,该方法也为无紫外吸收的该类药物的高效液相色谱法测定提供了新方法.
1 材料与方法
1.1 仪器与试剂
Agilent 1200高效液相色谱仪(配备G1314紫外检测器,G1311A在线脱气装置,G1329A进样器)(美国Agilent公司);UV-2450紫外/可见分光光度仪(日本Shimadzu公司);ZNHW-II型精密电子控制仪(杭州大卫科教仪器有限公司).
L-半胱氨酸标准品(98.5%,上海国药试剂公司);四氯苯醌(TCBQ)、对苯醌(p-BQ)、2,3-二氯-5,6-二氰对苯醌(DDBQ)为化学纯;无水乙醇、醋酸、硼砂、硼酸、磷酸氢二钠、柠檬酸为分析纯;甲醇为色谱纯;实验用水均为二次蒸馏水.
1.2 溶液制备
L-半胱氨酸对照品溶液.准确称取L-半胱氨酸标准品0.050 0 g,溶于50 mL蒸馏水,制得1 000 mg/L的对照品储备液.使用时稀释至所需质量浓度.
TCBQ溶液.准确称取四氯苯醌0.024 6 g,超声辅助溶于100 mL蒸馏水,制得1.0 mmol/L四氯苯醌溶液.
缓冲溶液.准确配制19.07 g/L硼砂溶液和12.37 g/L 硼酸溶液,取硼砂溶液8.0 mL 加入2.0 mL硼酸溶液中,制得pH 9.0的缓冲溶液.
1.3 实验方法
在10 mL比色管中依次加入1 mL L-半胱氨酸溶液,1 mL的硼砂-硼酸缓冲溶液(pH 9.0)和2 mL四氯苯醌溶液(1.0 mmol/L),用蒸馏水稀释至刻度,摇匀,置于40℃水浴中反应30 min后,迅速冷却至室温,用高效液相色谱进行分析.
样品分离采用Agilent®Eclipse XDBTMC18色谱柱(250 mm×4.6 mm,5μm),柱温25℃.流动相组成为30%甲醇和70%三乙胺水溶液(0.005%),流速1.0 mL/min.检测波长为358 nm,进样体积为10μL.在上述条件下,L-半胱氨酸和络合物的保留时间分别为2.4 min和6.5 min.
2 结果与讨论
2.1 L-半胱氨酸与TCBQ的反应
L-半胱氨酸与三种荷移试剂(TCBQ,p-BQ,DDBQ)的荷移反应表明,L-半胱氨酸与TCBQ发生荷移反应的灵敏度最高,因此本实验采用TCBQ作为荷移试剂.根据TCBQ的紫外吸收光谱(图1),其在287 nm处具有最大吸收;而L-半胱氨酸与TCBQ反应后,在相同条件下的最大吸收波长变化为358 nm,发生了红移现象,说明两者之间发生了反应,形成了在紫外区具有特征吸收峰的稳定荷移络合物.
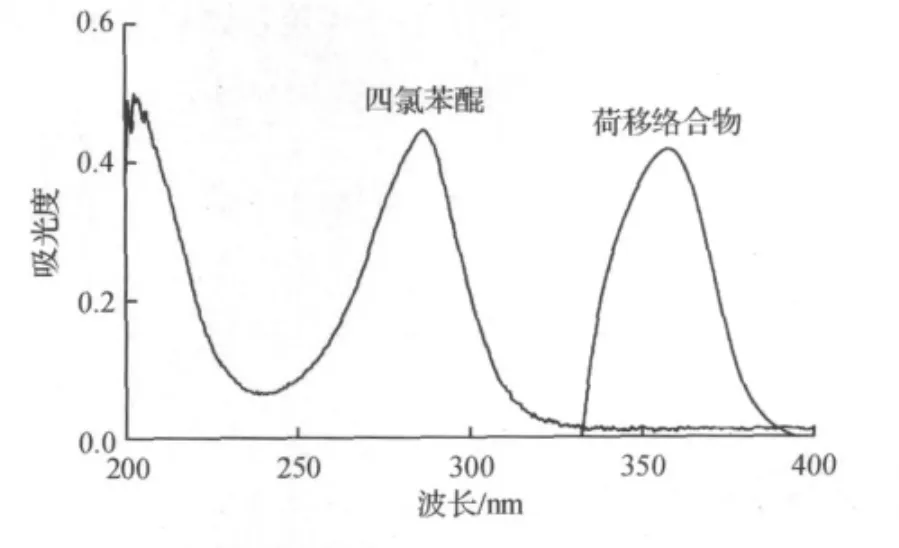
图1 四氯苯醌和荷移络合物的紫外吸收光谱Fig.1 Absorption spectra of TCBQ and charge transferring complex
在相同条件下,选用甲醇、乙醇、丙酮、乙腈、二甲基亚砜和水为溶剂进行试验.结果显示:L-半胱氨酸和TCBQ在水中反应最完全,色谱峰面积最大.因此,选用水为溶剂.在上述实验条件下,利用高效液相色谱检测参比溶液和该荷移络合物,得到如图2所示的液相色谱图.
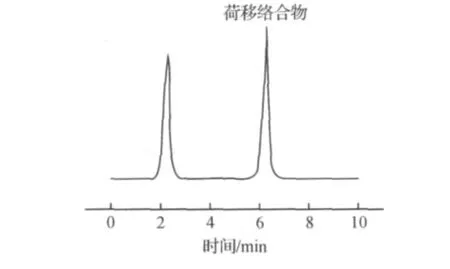
图2 荷移络合物的液相色谱图Fig.2 HPLC spectra of charge transferring complex
2.2 反应条件的影响和优化
反应pH 采用硼砂-硼酸(pH 7.0~9.0)和碳酸钠-碳酸氢钠(pH 10.0~11.0)缓冲液控制.实验结果表明:L-半胱氨酸与TCBQ在pH 9.0时具有最高的反应率,并且在该pH下,反应具有较高的灵敏度,且峰面积稳定.同时,该体系对反应影响小.
在不同的缓冲液用量下,反应所得的络合物峰面积大小几乎保持恒定.因此,反应体系选用pH 9.0的硼砂-硼酸缓冲体系(0.2 mol/L),用量为1 mL.
反应的温度对络合物的形成与稳定没有显著的影响,在40~50℃范围内,反应效率略高.而反应时间对络合物的形成有显著影响,反应经过30 min后,络合物的峰面积大小基本趋于稳定.故选择的反应温度为40℃,反应时间为30 min.
另外,还考察了TCBQ用量对反应的影响.结果表明:TCBQ溶液(1.0 m mol/L)的用量在1.5~4.0 mL内,反应完全,且TCBQ用量对测定几乎无影响.因此,选用TCBQ用量为2.0 mL.
2.3 方法学验证
待反应完成后,用HPLC测定不同放置时间的反应液.结果表明,反应液中荷移络合物稳定性良好,放置12 h后,峰面积没有明显变化;7 d的相对标准偏差仅为5.4%.
标准曲线如图3所示,将数据进行统计处理得回归方程A=13.544C(其中A为峰面积,C为L-半胱氨酸的质量浓度),线性相关系数r2=0.999 7,线性范围为0~100 mg/L.最低检测限为0.2 mg/L;最低定量限为1.0 mg/L.
根据HPLC测定,L-半胱氨酸在原料药中质量分数为95.7%.另外,该方法的回收率及精密度采用加样法检测,结果见表1.
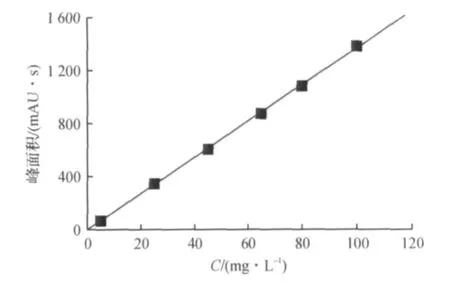
图3 标准曲线Fig.3 Standard curve
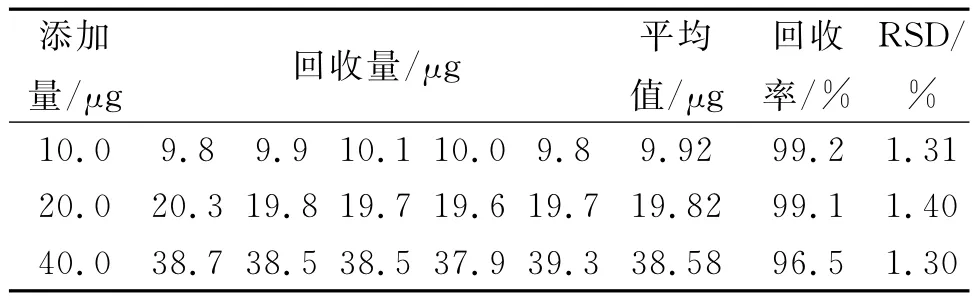
表1 样品的回收率及精密度测定结果(n=5)Table 1 Determination results of recovery and RSD of sample(n=5)
2.4 络合物组成和稳定常数测定
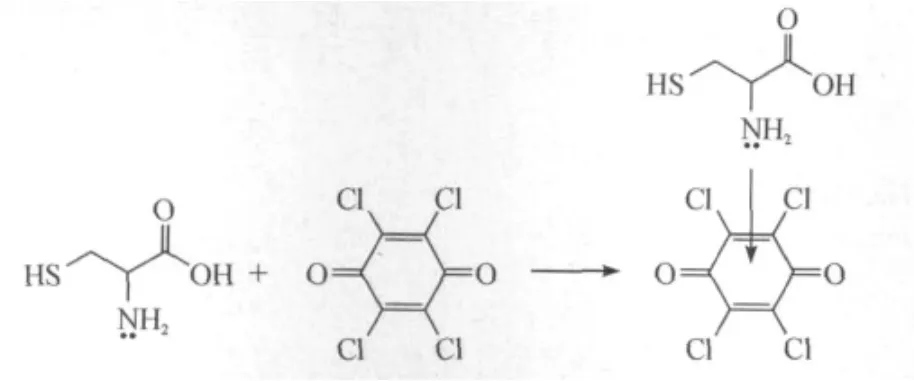
用连续变化法(图4a)和摩尔比法(图4b)测定络合物的组成,其中C1和C2分别为L-半胱氨酸和TCBQ物质的量浓度,测得L-半胱氨酸与TCBQ的络合摩尔比为1∶1.L-半胱氨酸分子中N原子上有一孤对电子对可作为电子供体,而TCBQ作为n电子受体,在水中可形成n-π型络合物.基于测得的络合物组成摩尔比为1∶1,荷移反应式为
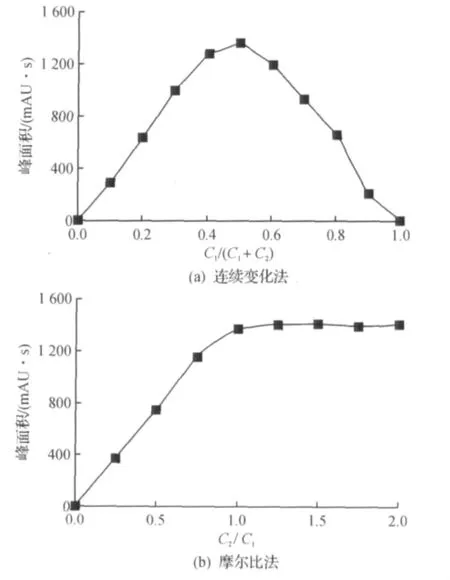
图4 检测络合物稳定性Fig.4 The stability of charge transferring complex
用稀释法测定络合物的稳定常数,在两个不同的L-半胱氨酸和TCBQ总摩尔数条件下,在同一坐标上分别作对两个不同总摩尔分数溶液的吸光度曲线(曲线Ⅰ和曲线Ⅱ),其中X v表示四氯苯醌的摩尔数和溶液总摩尔数的比值,在这二条曲线上找出吸光度相同的二点,如图5所示,则在此二点上对应的溶液的络合物浓度应相同,由此得出络合物稳定常数K=2.887×103/(mol·L).
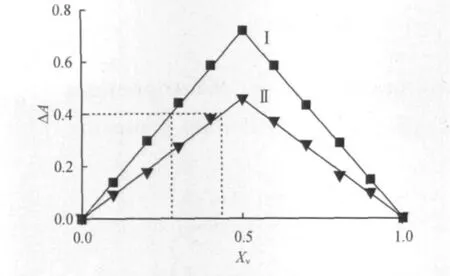
图5 吸光度-溶液组成图Fig.5 Spectrophotometry-solution composition
3 结 论
根据本实验可知:基于荷移反应的L-半胱氨酸高效液相色谱定量法,操作简便、可靠且灵敏度高,可用于L-半胱氨酸原料药的质量分数测定及其合成工艺中的中间控制.
[1]CARMEL R,JACOBSEN D W.Homocysteine in Health and Disease[M].Cambridge:Cambridge University Press,2001.
[2]LAU C W,QIN Xin-jin,LIANG Ju-ye,et al.Determination of cysteine in a pharmaceutical formulation by flow injection analysis with a chemiluminescence detector[J].Analytica Chimica Acta,2004,514(1):45-49.
[3]CHEN Xiao-qian,ZHOU Ye,PENG Xiang-jiang,et al.Fluorescent and colorimetric probes for detection of thiols[J].Chemical Society Reviews,2010,39(6):2120-2135.
[4]ANTONIO T,FRACASSETTI D,DENONI I.Determination of reduced cysteine in oenological cell wall fractions of saccharomyces cerevisiae[J].Journal of Agricultural and Food Chemstry,2010,58(8):4565-4070.
[5]ZINELLU A,SOTGIA S,SCANU B,et al.Determination of homocysteine thiolactone,reduced homocysteine,homocystine,homocysteine-cysteine mixed disulfide,cysteine and cystine in a reaction mixture by over imposed pressure/voltage capillary electrophoresis[J].Talanta,2010,82(4):1281-1285.
[6]ICHINOSE S,NAKAMURA M,MAEDA M,et al.A validated HPLC-fluorescence method with a semi-micro column for routine determination of homocysteine,cysteine and cysteamine,and the relation between the thiol derivatives in normal human plasma[J].Biomedical Chromatography,2009,23(9):935-939.
[7]LIAO Wen-sun,WU Fei-yun,WU Ye-mei,et al.Highly sensitive spectrofluorimetric determination of cysteine by Cu2+-morin complex[J].Microchimica Acta,2008,162(1/2):147-152.
[8]LIANG Si-cao,WANG Hong,ZHANG Zi-mei,et al.Spectrofluorimetric determination of cysteine by 5-maleimidyl-2-(m-methylphenyl)benzoxazole[J].Spectrochimica Acta A,2002,58(12):2605-2611.
[9]LU Jian-xin,SUN Chu-dian,CHEN Wei,et al.Determination of non-protein cysteine in human serum by a designed BODIPY-based fluorescent probe[J].Talanta,2011,83(3):1050-1056.
[10]LIU An-chang,CHEN Di-chi,LIN Chang-chuan,et al.Application of cysteine monolayers for electrochemical determination of sub-ppb copper(II)[J].Analytical Chemistry,1999,71(8):1549-1552.
[11]SPATARU N,SARADA B V,POPA E,et al.Voltammetric determination of L-cysteine at conductive diamond electrodes[J].Analytical Chemistry,2001,73(3):514-519.
[12]KOLTHOFF I M,KIHARA S.Voltammetric determination of ultratraces of albumin,cysteine,and cystine at the hanging mercury drop electrode[J].Aanlytical Chemistry,1977,49(13):2108-2109.
[13]MULLIKEN R S.Structures of complexes formed by halogen molecules with aromatic and with oxgenated solvents[J].Journal of American Chemistry Society,1950,72:600-608.
Quantification of L-cysteine by HPLC based on charge transfer reaction
WANG Xiao1,HOU Xiao-rong1,WANG Jian-wei1,SHEN-TU Chao2,SHAN Wei-guang1
(1.College of Pharmaceutical Science,Zhejiang University of Technology,Hangzhou 310032,China;2.Zhejiang Shuren University,Hangzhou 310015,China)
A method of high performance liquid chromatography(HPLC)was established for quantification of L-cysteine based on charge transfer reaction. L-cysteine reacts with tetrachloroquinone in pH 9.0 borax-boric acid buffer at 40℃for 30 min,forming a complex(λmax=358 nm),which could be detected using HPLC.The results indicated that stable complex formed with an L-cysteine/tetrachloroquinone molar ratio of 1∶1.Moreover,the determination fell into an excellent linear relation in the range of 10~150μg/mL.The recoveries were 99.2%,99.1%and 96.5%,and the relative standard deviations(RSD)were 1.3%,1.4%and 1.3%for low,middle and high three kinds added,respectively.This method is accurate,quick,simple and reproducible and can be used to quantify L-cysteine in crude drug.
charge transfer reaction;high performance liquid chromatography (HPLC);L-cysteine;tetrachloroquinone
R917
A
1006-4303(2013)02-0152-04
2012-03-12
浙江省自然科学基金资助项目(Y2080137);浙江省科技厅公益计划研究社会发展项目(2011C23006)
王 笑(1988—),女,浙江东阳人,硕士研究生,研究方向为仪器分析,E-mail:hoverxiaoxiao@hotmail.com.通信作者:单伟光教授,E-mail:swg@zjut.edu.cn.
(
陈石平)
