核苷类药物中间体2-脱氧-α-D-核糖-1-磷酸的合成
2013-08-24彭美红
钱 捷,彭美红,王 鸿
(浙江工业大学 药学院,浙江 杭州 310032)
核苷类药物中间体2-脱氧-α-D-核糖-1-磷酸的合成
钱 捷,彭美红,王 鸿
(浙江工业大学 药学院,浙江 杭州 310032)
2-脱氧-α-D-核糖-1-磷酸是酶法合成核苷类药物的重要中间体,以往的化学合成法立体选择性不高,笔者以α/β混合构型的1-氯-3′,5′-二(O-对氯苯甲酰基)-2-脱氧-D-核糖为原料,采用结晶诱导不对称转化技术,合成了单一构型的2-脱氧-α-D-核糖-1-磷酸盐,HPLC测定其α构型含量为96.8%,总收率82.14%.考察了反应物投料比,反应时间,反应温度等因素的影响,得到了较佳工艺条件为:投料摩尔比为1∶3,-5~0℃下结晶诱导反应23 h然后在含有3%环己胺的甲醇溶液中,45℃下反应36 h脱除保护基.该工艺反应条件温和、操作简单、产物立体选择性好且收率高,是经济价值较高的合成路线.
2-脱氧-α-D-核糖-1-磷酸;结晶诱导不对称转化;核苷
核苷类药物与天然核苷具有相似的结构,在体内能够直接作用或干扰核酸的合成,具有良好的抗肿瘤、抗病毒和抗菌等活性[1-2].2-脱氧-α-D-核糖-1-磷酸是酶法合成核苷类药物的重要中间体[3-6],然而以往化学合成得到的终产物往往是α-核苷和β-核苷的混合物,立体选择性差,其产率较低.结晶诱导不对称转化技术是基于热力学控制立体选择性合成单一异构体的前沿技术[7-10],它是采用结晶诱导剂使其中一种构型以晶体的形式析出,能够解决核苷类药物合成过程中无法得到单一构型的问题,尤其是在工业应用上具有显著的效果.
1 材料与方法
在文献[11]的基础上以α/β混合构型的1-氯-3′,5′-二(O-对氯苯甲酰基)-2-脱氧-D-核糖为原料,采用结晶诱导不对称转化技术合成单一构型的核苷类药物中间体2-脱氧-α-D-核糖-1-磷酸,其合成路线如下:

1.1 主要试剂
1-氯-3′,5′-二(O-对氯苯甲酰基)-2-脱氧-D-核糖(上海元吉化工有限公司);正磷酸(国药集团化学试剂有限公司);乙腈(天津四友精细化工有限公司);正三丁基胺(国药集团化学试剂有限公司);环己胺(上海凌峰化学试剂有限公司);4-甲基-2-戊酮(国药集团化学试剂)其他溶剂均为分析纯或化学纯.
1.2 主要仪器
X-4数字显示显微熔点测定仪(北京泰克仪器设备有限公司);Micolet 6700红外光谱仪(美国Thermo公司);ZF-2紫外光谱仪(上海安亭电子仪器厂);R-201旋转蒸发仪(上海申胜生物技术有限公司);Bruker ANANCEⅢ(500M)核磁共振仪(瑞士Bruker公司);Agilent 1200高效液相色谱仪(安捷伦科技有限公司).
1.3 合成方法
1.3.1 3′,5′-O-二(4-苯甲酰氯)-2-脱氧-α-D-核糖-1-磷酸二环己基胺盐(化合物Ⅰ)的合成
取98%的正磷酸7.02 g投入三角烧瓶,加入乙腈100 mL,加入正三丁胺5.6 mL,4A分子筛10 g搅拌至磷酸溶解,低温冷却至-5℃,加入1-氯-3′,5′-二(O-对氯苯甲酰基)-2-脱氧-D-核糖8.5 g在氮气保护下搅拌反应13 h后,再加入正三丁基胺16.0 mL,继续反应8 h得到酒红色的透明液体,过滤除去分子筛,滤液蒸干得到红棕色糖浆状物质.糖浆状物质用四甲基二戊酮溶解后,水洗3次,所得有机相冷却至0℃,加入环己胺5.6 mL搅拌反应1 h析出白色沉淀,过滤,滤饼用四甲基二戊酮、丙酮洗涤,真空干燥得到白色固体12.78 g.
1.3.2 2-脱氧-α-D-核糖-1-磷酸二环己基胺(化合物Ⅱ)的合成
取3′,5′-O-二(4-苯甲酰氯)-2-脱氧-α-D-核糖-1-磷酸二环己基胺盐7.02 g溶于甲醇120 mL,加入环己胺3.0 mL,40℃搅拌反应24 h,反应液浓缩,最终沉淀物用乙醇洗涤,真空干燥得到白色固体3.46 g.
2 结果与讨论
2.1 3′,5′,-O-二对氯苯甲酰基2-脱氧-α-D-核糖-1-磷酸二环己胺盐(化合物Ⅰ)的合成
2.1.1 化合物Ⅰ的结构表征
化合物Ⅰ经熔点测定,红外及核磁共振氢谱表征其结构正确:熔点mp:176~178℃(文献值179~180℃);IR (KBr):2 942 cm-1,2 869 cm-1,1 723 cm-1;1H NMR(CD3OD):8.08(2H,ddd),8.01(2H,ddd),7.50(2H,ddd),7.48(2H,ddd),6.01(1 H,ddd),5.49(1 H,ddd),4.87(1 H,ddd),4.67(1 H,dd),4.61(1 H,dd),4.54(1 H,dd),2.92(2 H,dd),2.58(1 H,dddd),2.42(1H,dddd),1.96(4H,m),1.81(4 H,m),177(2H,m)
2.1.2 氯糖与磷酸的投料比比对化合物Ⅰ收率的影响
由于磷酸加入后会改变反应体系的pH值,因此核糖-1-氯化物与磷酸的投料比影响化合物Ⅰ的收率.在核糖用量为8.48 g,温度为-5℃,三丁基胺用量为11.2 mL条件下改变磷酸的用量反应23 h,考察核糖-1-氯化物与磷酸的投料比对化合物Ⅰ收率的影响.其结果如图1所示.
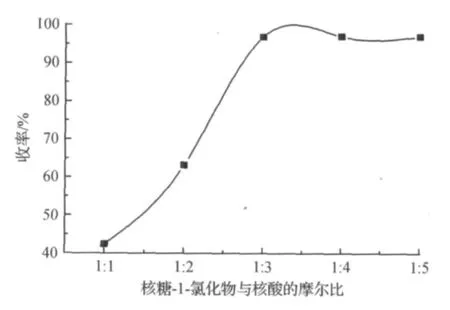
图1 核糖-1-氯化物与磷酸的比值对收率的影响Fig.1 Influence of molar ratio of nucleoside-1-chlorides and phosphoric acid on the yield of compoundⅠ
由图1可以看出:当磷酸与核糖以摩尔比1∶1反应时,目标产物收率很低,磷酸的用量必须过量很多才能使反应进行的完全,当磷酸与核糖的摩尔比达到3∶1时反应产物的收率迅速提高,当超过3∶1后产物收率有少量的提高.从经济角度考虑,磷酸与核糖以摩尔比3∶1反应时产物有最大收率.
2.1.3 溶剂用量的影响
溶剂的用量对产物的收率有直接影响,尤其在工业化应用中直接影响产品的经济效益.在其他条件不变的情况下考察溶剂乙腈用量对化合物Ⅰ收率的影响.乙腈用量对化合物Ⅰ收率的影响结果如图2所示.

图2 乙腈用量对化合物Ⅰ收率的影响Fig.2 Influence of the amount of acetonitrile on the yield of compoundⅠ
实验过程中发现当选择60 mL的乙腈量时,核糖-1-氯化物不能完全溶解,搅拌过程中出现结块,成团的现象.继续往反应液中加入20 mL后,块状物之溶解,形成一个均匀的乳浊液,在加入三丁基胺后可以完全溶解为澄清透明溶液.由表可以看出,当乙腈用量为80 mL时,其产物收率只有78.21%,增加溶剂的用量产物的收率提高,其原因可能是乙腈用量不够,反应物没有完全溶解.当增加到120 mL后,继续增加溶剂用量,产物收率不再提高.因此从经济和安全的角度考虑,当核糖为8.48 g时,乙腈的最佳用量为120 mL.
2.1.4 三丁基胺用量对产物收率的影响
三丁基胺在反应过程中作为一个重要的试剂,起到一个催化剂的作用,同时三丁基胺是本实验中关键技术“结晶诱导不对称转化技术”的结晶诱导剂,它能够与反应液中α/β混合构型的核糖-1-磷酸中的α构型结合,从而打破反应液中的平衡,使β构型不断的向α构型转化,最终形成α构型的核糖-1-磷酸三丁基胺盐.其结晶诱导过程如下:

在其他条件不变的条件下,考察三丁基胺用量对化合物收率的影响,其反应结果如图3所示.

图3 核糖-1-磷酸与三丁基胺的摩尔比对化合物Ⅰ收率的影响Fig.3 Influence of molar ratio of nucleoside-1-chlorides and tri-n-Butylamine on the yield of compoundⅠ
在实验过程中发现当核糖-1-氯化物与三丁基胺以1∶1的摩尔比反应时无法得到白色固体,原因可能是核糖-1-氯化物与当量的三丁基胺结合形成的化合物不稳定.由图可以看出:核糖-1-氯化物与三丁基胺用量的摩尔比为1∶3时反应产物有最大收率.
2.1.5 反应时间对产物收率的影响
在其他条件保持不变的条件下,考察反应时间对化合物Ⅰ收率的影响,其结果如图4所示.

图4 反应时间对化合物Ⅰ收率的影响Fig.4 Influence of reaction time on the yield of compoundⅠ
由图4可以看出:随着反应时间的延长,产物收率也随之增加,当反应超过15 h后产物颜色逐渐变深,20 h后产率达到最大值,随着反应时间继续增加反应物产率没有明显增加,当反应时间延长到30 h后,产率有所下降.其原因可能是反应时间短的情况下,反应未完全,随着反应时间过长,体系发生了副反应.因此控制反应时间20~25 h可以达到最大收率.
由于3′,5′-O-二对氯苯甲酰基-2-脱氧-D-核糖-1-氯化物极不稳定,需在0℃以下,无水条件下保存,因此实验的反应温度控制在-5~0℃,未研究其他反应温度对产物收率的影响.
2.2 2-脱氧-α-D-核糖-1-磷酸二环己胺盐(化合物Ⅱ)的制备
2.2.1 化合物Ⅱ的结构表征
化合物Ⅱ经过熔点测定,红外及核磁共振氢谱数据表征其结构正确:熔点mp:166~167℃(文献值168~169 ℃);IR (KBr):2 939 cm-1,2 853 cm-1,2 238 cm-1,1 630 cm-1;1H NMR(D2O):5.67(1 H,dd),4.14~4.07(2H,ddd),3.60(1 H,dd),3.52(1H,dd),3.07(2H,m),2.28~2.23(1 H,ddd),1.99(1H,ddd),1.89(4H,m),1.71(4H,m),1.57(2H,m),1.29~1.21(8H,m),1.12(2H,m).
2.2.2 用环己胺甲醇溶液脱去保护基时环己胺含量对收率的影响
在其他条件相同的情况下,用环己胺体积分数为1%,2%,3%,4%,5%,6%,7%,10%,20% 的甲醇溶液来脱去保护基,考察碱体积分数对产物收率的影响(图5).

图5 碱用量对化合物Ⅱ收率的影响Fig.5 Influence of the amount of base on the yield of compoundⅡ
从图5可以看出:当环己胺的用量为1%时,产物的收率为11.3%,其原因可能为碱的用量不够.当环己胺的体积分数达到4%时,产物的产率最高.随着环己胺浓度的增加,产物的收率逐渐降低.其原因可能是环己胺体积分数过高之后,产物在溶液中的溶解度增大.
2.2.3 反应温度对化合物Ⅱ收率的影响
在其他条件不变的情况考察25,35,45,55℃等反应温度对化合物Ⅱ收率的影响.其结果如图6所示.
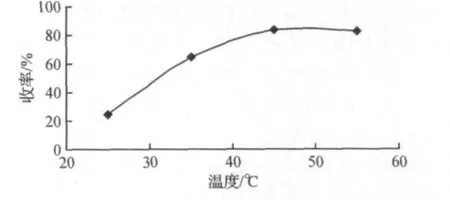
图6 反应温度对化合物Ⅱ收率的影响Fig.6 Influence of the reaction temperature on the yield of compoundⅡ
由图6可以看出:在反应时间为48 h的情况下,随着反应温度的升高,产物的收率不断增加,当温度升高到45℃后,在相同反应时间内,反应温度升高后产物的收率不再继续增加.因此从经济的角度考虑选择反应温度为45℃较为理想.
2.2.4 用环己胺甲醇溶液脱去保护基时反应时间对收率的影响
在其他条件不变的情况下,选择反应14,20,24,28,32,36,40,44,72 h考察反应时间对产物收率的影响(图7).

图7 反应时间对化合物Ⅱ收率的影响Fig.7 Influence of the reaction time on the yield of compoundⅡ
从图7中可以看出:在环己胺,甲醇以及温度一定的条件下,反应时间对化合物Ⅱ的收率影响较大,反应液从开始到12 h以内反应液为透明澄清液,反应时间在13 h后开始变浑浊,随着反应时间的延长,反应液开始由无色变成乳白色,同时有少量的絮状沉淀产生,化合物Ⅱ的质量也在不断增加,当反应时间延长到36 h时产物的质量增加较少,继续延长反应到72 h,产物的质量也没有明显变化.因此在反应温度为45℃的条件下,从经济的角度考虑反应的最佳时间为36 h.
3 结 论
以α/β混合构型的1-氯-3′,5′-二(O-对氯苯甲酰基)-2-脱氧-D-核糖为原料,采用结晶诱导不对称转化技术,以三丁基胺为催化剂经过三步合成得到了单一构型的3′,5′-O-二对氯苯甲酰基2-脱氧-α-D-核糖-1-磷酸二环己胺,并用IR,1HNMR对其结构进行了表征.合成3′,5′-O-二对氯苯甲酰基-2-脱氧-α-D-核糖-1-磷酸二环己胺的最佳条件为核糖与磷酸的投料摩尔比为1∶3,三丁基胺用量为核糖摩尔量的三倍,反应温度为-5~0℃,反应时间为23 h,其α构型含量为96.8%.2-脱氧-α-D-核糖-1-磷酸二环己胺的合成采用甲醇弱碱溶液脱除保护基,研究了脱除保护基的最佳条件为含有3%环己胺的甲醇溶液,反应温度为45℃,反应时间为36 h,总收率为82.14%.
[1]姚其正.核苷化学合成[M].北京:化学工业出版社,2005.
[2]何军林,张礼和.尿苷的结构改造与细胞毒活性研究[J].药学学报,1998,34(1):29-33.
[3]LING F,INOUE Y,KIMURA A.Purification and characterization of anovel nucleoside phosphorylase from a Klebsiella sp and is't use in the enzymatic production of adenine arabinoside[J].Applied and Environmental Microbiology,1990,56(12):3830-3834.
[4]LIANG Sheng-hua,LI Wen-zhou,GAO Tong,et al.Enzymatic synthesis of 2′-deoxyadenosine and 6-methylpurine-2′-deoxyriboside by Escherichia coli DH5αoverexpressing nucleoside phosphorylases from Escherichia coli BL21[J].Journal of Bioscience and Bioengineering,2010,110(2):165-168.
[5]樊华伟,傅绍军,邵志宇,等,核苷类药物酶法合成研究进展[J].生物技术通讯,2005,16(6):690-692.
[6]TRELLES J,FERNADEZA M,LEWKOWICZ E,et al.Purine nucleoside synthesis from uridine using immobilized Enterobacter gergoviae CECT 875 whole cells[J].Tetrahedron Letters,2003,44:2605-2609.
[7]BERKES D S,JAKUBEC P,WINKLEROVA D,et al.CIAT with simultaneous epimerization at two stereocenters.Synthesis of substitutedβ-methyl-α-homophenylalanines[J].Organic& Biomolecular Chemistry,2007,5(1):121-124.
[8]VEDEJS E,DONDE Y.Crystallization-induced asymmetric transformation of a tertiary phosphine[J].The Journal of Orgnic Chemistry,2000,65(8):2337-2343.
[9]JAKUBEC P,BERKES D,POVAZANEC F.Crystallizationinduced asymmetric transformation.application to conjugate addition of benzylamine to amides of benzoylacrylic acid[J].Tetrahedron Letters,2004,45(24):4755-4758.
[10]BRANDS K M J,DAVIES A J.Crystallization-Induced diastereomer transformations[J].Chemical Reviews,2006,106(7):2711-2733.
[11]KOMATSU H,AWANO H.First Stereoselective Synthesis of 2-Deoxy-α-D-ribosyl-1-phosphate: novel application of crystallization-induced asymmetric transformation[J].The Journal of Organic Chemistry,2002,67(15):5419-5420.
Synthesis of a intermediate of nucleosides:2-deoxy-α-D-ribosyl-1-phosphate
QIAN Jie,PENG Mei-hong,WANG Hong
(College of Pharmaceutical Science,Zhejiang University of Technology,Hangzhou 310032,China)
2-deoxy-α-D-ribosyl-1-phosphate is a important intermediate for synthesizing nucleosides.2-deoxy-α-D-ribosyl-1-phosphate was synthesized from 1-chloro-3′,5′-di-(4-chlorobenzoyl)-2-deoxy-D-ribose by crystallization-induce asymmetric transformation,The yield of the product was 82.14%with 96.8 percent ofαconfiguration by HPLC.The influence factors of raw ratio,reaction time and reaction temperature were investigated.The optimum reaction conditions were determined as follows:The molar ratio of raw ratio was 1:3,reaction temperature was-5~0℃,the reaction time was 23 h.The protect group was released with weak-base solution,reacted at 45 ℃for 36 h in methanol with 3%cyclohexane.The process is mild reaction condition,good stereoselectivity,convenient to operate with low cost and high yield.This application is proved to be a technique with a higher economic value.
2-deoxy-α-D-ribosyl-1-phosphate;crystallization-induce asymmetric transformation;nucleosides
TQ463
A
1006-4303(2013)02-0138-05
2012-02-17
浙江省科技计划项目(2009C13033-1)
钱 捷(1962-),男,江苏扬州人,副教授,硕士,研究方向为药物合成,E-mail:qianjie@zjut.edu.cn.
(
陈石平)
