超滤法纯化茯苓多糖的工艺优化
2013-08-24颜继忠李行诺
颜继忠,廖 倩,李行诺
(浙江工业大学 药学院,浙江 杭州 310032)
超滤法纯化茯苓多糖的工艺优化
颜继忠,廖 倩,李行诺
(浙江工业大学 药学院,浙江 杭州 310032)
研究超滤法分离纯化茯苓多糖的工艺条件.以截留分子量为10 k Da的超滤膜对茯苓多糖进行超滤分离,采用单因素试验和正交试验,研究压力、温度和初始料液比三个因素对茯苓多糖超滤的影响,并以膜通量和截留率为评价指标,优化最佳超滤条件.实验结果表明:茯苓多糖的最佳超滤条件为压力0.225 MPa、温度25℃、初始料液比2 g/L.在此条件下茯苓多糖的截留率为77.32%,多糖制品的质量分数由42.86%提高到88.40%.说明超滤法是纯化茯苓多糖的有效方法之一.
茯苓;多糖;超滤;截留率
茯苓为多孔菌科真菌茯苓Poria cocos(Schw.)Wolf的干燥菌核,是一味使用历史悠久的传统中药,被列入中药八珍之一,主产于云南、福建、安徽等地[2].茯苓的主要成分为多糖和三萜,其中多糖含量占茯苓干重的84%以上[3].现代药理研究发现茯苓多糖在抗肿瘤、抗疲劳、抗衰老及防治神经退行性疾病等方面具有显著作用[4-7].此外还有降血糖、抗炎、抗白血病等作用[8-10].由于多糖的生理活性与其结构、分子量及溶解度等因素密切相关,因此如何有效地分离纯化多糖是多糖研究的首要任务之一.超滤是一种新型膜分离技术,利用不同的孔径截留不同分子量的物质,因其具有操作简单、条件温和、分离效率高、可防止热敏物质失活等优点,已成为多糖分离纯化研究的重要手段.
笔者首次采用微滤结合超滤法分离纯化茯苓多糖,据文献[11]报道茯苓多糖的分子量分布范围是26~268 k Da,因此本试验先采用0.2μm的聚砜膜微滤除去茯苓多糖溶液中的大分子杂质,再将透析液通过10 k Da超滤装置对茯苓多糖进一步纯化研究,并优化超滤试验操作条件,测定所得产品中茯苓多糖的质量分数,为茯苓多糖及超滤技术在医药领域和保健品行业中的开发应用提供理论依据.
1 材料与方法
1.1 材料与试剂
茯苓多糖提取物由浙江惠松制药有限公司提供.无水乙醇、浓硫酸、苯酚和葡萄糖等均为分析纯.
1.2 仪器与设备
UV754紫外-可见分光光度计(上海菁华科技仪器有限公司);Flow Mem-001螺旋膜小试设备、截留分子量为0.2μm和10 k Da的聚砜膜(厦门世达膜有限公司);JA2003N电子天平(上海精密科学仪器有限公司);RE2000旋转蒸发器(上海亚荣生化仪器厂);真空冷冻干燥仪(2.5 L,美国LABCONCO公司);Milli-Q纯水仪(美国Millipore公司).
1.3 方 法
1.3.1 工艺流程
茯苓多糖提取物→加入四倍体积无水乙醇,4℃沉淀24 h→收集沉淀→洗涤→真空冷冻干燥→多糖粗品→加去离子水溶解→布氏漏斗过滤→微滤→超滤→浓缩→真空冷冻干燥→多糖制品.
1.3.2 超滤方法
采用螺旋膜小试设备纯化茯苓多糖,准确称取茯苓多糖按一定料液比溶解,将盛放料液的大烧杯放入恒温水浴锅控温,透过液采用量筒收集,膜通量与截留率计算公式如下[12]:

式中:J为膜通量,L/m2·h;V为超滤时间内透过液的体积,L;S为有效膜面积,m2;T为超滤时间,h.

式中:R为多糖截留率,%;V2,ρ2分别为超滤后截留液的体积和多糖浓度;V1,ρ1分别为超滤前提取液的体积和多糖浓度.
1.3.3 茯苓多糖超滤的单因素试验
1)压力对茯苓多糖超滤的影响
茯苓多糖的初始料液比为2 g/L,通过0.2μm膜微滤后,将透过液定容至1 000 mL,在选用10 KDa的膜,控制温度为25℃,压力分别为0.20,0.25,0.30 MPa,以膜通量和截留率为评价指标.考察不同压力对茯苓多糖超滤的影响.
2)温度对茯苓多糖超滤的影响
茯苓多糖的初始料液比为2 g/L,通过0.2μm膜微滤后,将透过液定容至1 000 mL,再选用10 k Da的膜,控制压力为0.25 MPa,温度分别为25,35,45℃,以膜通量和截留率为评价指标.考察不同温度对茯苓多糖超滤的影响.
3)初始料液比对茯苓多糖超滤的影响
茯苓多糖提取物的初始料液比分别为1,2,3 g/L,通过0.2μm膜微滤后,将透过液定容至1 000 mL,再选用10 k Da的膜,控制超滤压力为0.25 MPa,温度为25℃,以膜通量和截留率为评价指标.考察不同初始料液比对茯苓多糖超滤的影响.
1.3.4 茯苓多糖超滤的工艺优化
以压力、温度、初始料液比三个因素设计L9(33)正交试验,以膜通量和截留率为评价指标,确定茯苓多糖的最佳超滤工艺.试验设计的因素水平表见表1.
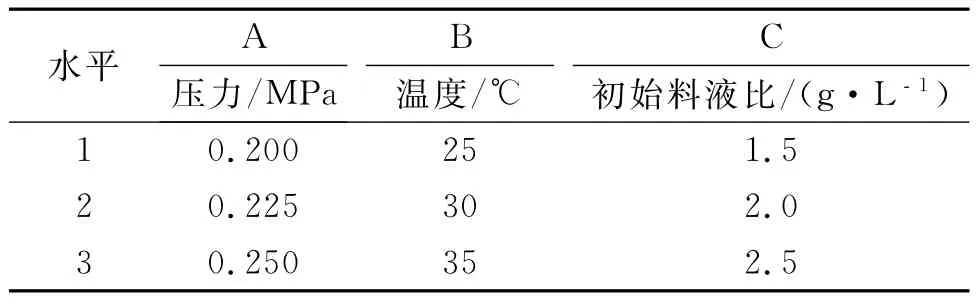
表1 茯苓多糖超滤工艺的正交试验因素与水平Table 1 Factors and levels in L9(33)orthogonal array design for optimal polysaccharide ultrafiltration process
1.4 分析评价
1.4.1 茯苓多糖的测定方法
总糖测定采用苯酚-硫酸法[13].

2 结果与分析
2.1 茯苓多糖超滤的单因素试验
2.1.1 压力对茯苓多糖超滤的影响
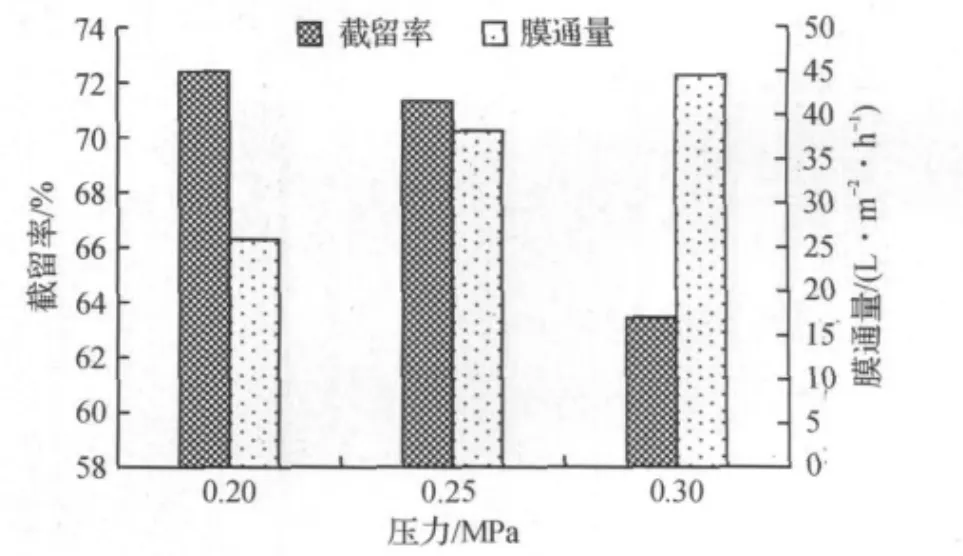
图1 压力对截留率和膜通量的影响Fig.1 Effect of pressure on the retention of polysaccharides and the membrane flux
由图1可知:随着压力的增大,膜通量显著增大.但当压力大于0.25 MPa时,由于膜表面的浓差极化作用加剧,开始形成膜面凝胶层,导致阻力大大增加,因而膜通量的增加减少[14].当压力在0.25 MPa时,截留率较好.综合考虑,压力范围选择在0.20~0.25 MPa之间.
2.1.2 温度对茯苓多糖超滤的影响
由图2可知:随着温度的升高,截留率降低而膜通量增大.这是因为在一定范围内,升高温度使溶液粘度下降、扩散系数和传质系数增大、多糖溶解度增大,浓差极化相应减小,所以导致膜通量逐渐增大而截留率降低[15].此外也有报道指出当温度高于50℃时会导致多糖的活性降低以及滤膜的性能发生改变[16].因此综合考虑,操作温度控制在35℃以下为宜.
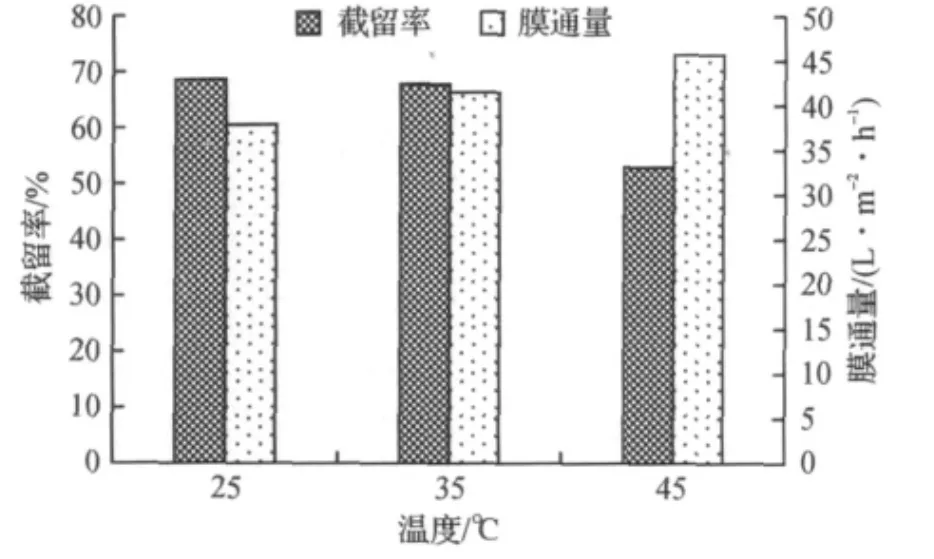
图2 温度对截留率的影响Fig.2 Effect of temperature on the retention of polysaccharides and the membrane flux
2.1.3 初始料液比对茯苓多糖超滤的影响
由图3可知:随着初始料液比的增加,茯苓多糖的膜通量逐渐减小.这是因为随着初始料液浓度的增大,料液的粘度增大,溶质扩散系数减小,浓差极化加重,造成膜通量下降.当料液比为2 g/L时,截留率最佳.理论上多糖应尽量稀释减少膜的污染以及多糖的损失,但考虑到膜分离后多糖溶液需浓缩冻干,如果溶液体积过大,不仅消耗能量而且浪费时间,因此,初始料液比选择在2 g/L左右较为适宜.
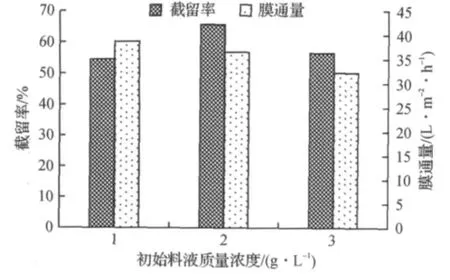
图3 初始料液比对截留率的影响Fig.3 Effect of material/liquid ratio on the retention of polysaccharides and the membrane flux
2.2 茯苓多糖超滤的工艺优化
压力、温度、初始料液比的L9(33)正交试验设计及数据处理见表2.
由表2的直观分析可知:影响茯苓多糖平均膜通量主次关系是A>B>C,即操作压力的影响最大,其次是温度,初始料液比的影响最小.影响茯苓多糖截留率的主次关系是B>A>C,即温度的影响最大,其次是压力,初始料液比的影响最小.因此从k值上综合考虑确定最优工艺组合条件为A2B1C2,即操作压力0.225 MPa、温度25℃、初始料液比2 g/L.
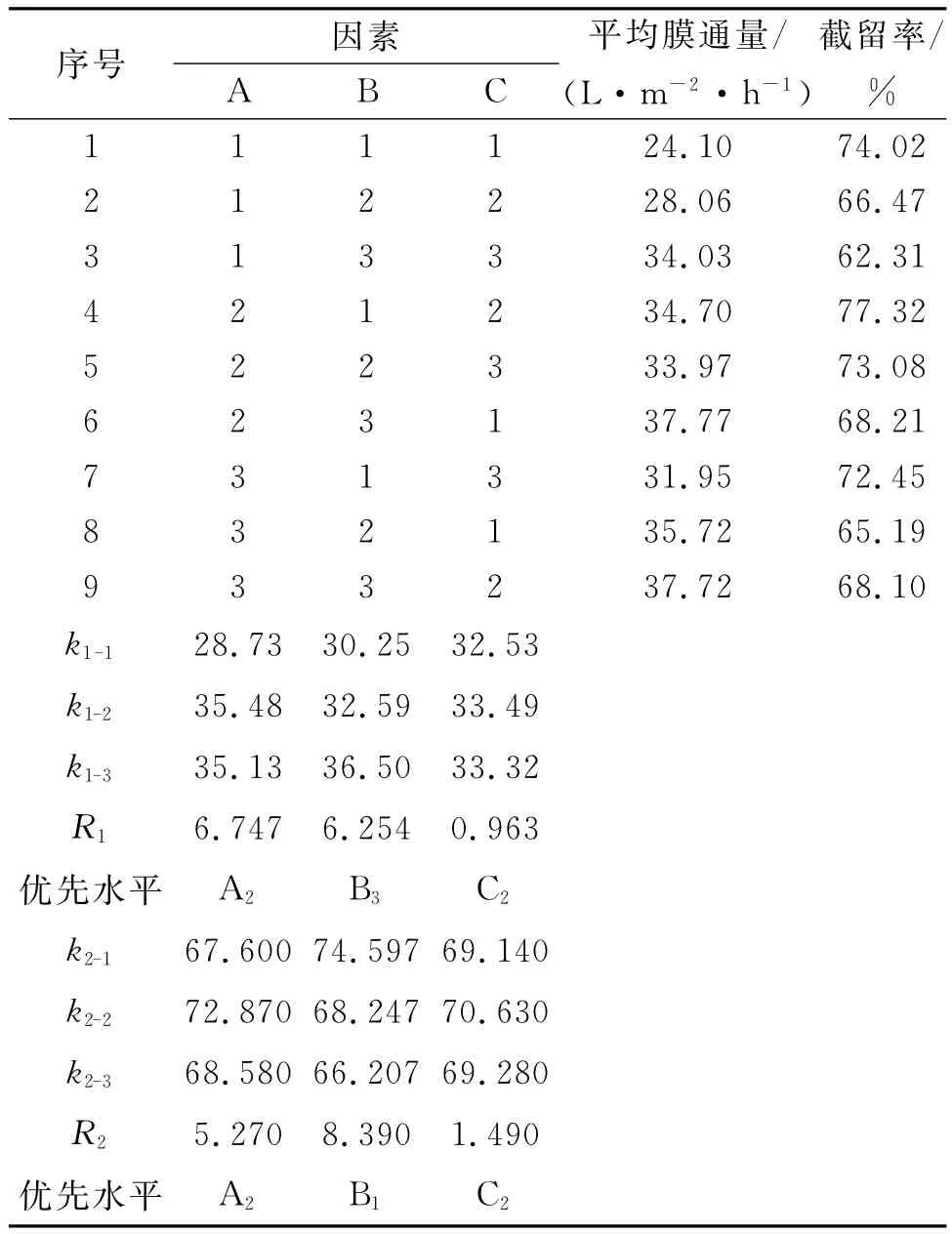
表2 L9(33)正交试验设计及结果1)Table 2 result of L9(33)orthogonal array design tests for optimal polysaccharides ultra filtration process
3 结 论
采用10 k Da聚砜膜超滤茯苓多糖的最佳工艺条件为操作压力0.225 MPa、温度25℃、初始料液比2 g/L.在此条件下茯苓多糖的截留率为77.32%,平均膜通量为34.70 L/(m2·h),多糖制品的质量分数由42.86%提高到88.40%.
超滤法能有效除去茯苓多糖中的大分子蛋白、多酚、色素等物质,且与传统的除蛋白和脱色方法相比,操作简单、条件温和,不仅可以有效避免多糖在操作过程中活性降低,还大大提高了多糖的纯度,也提高了多糖进一步分离纯化的效率.不过聚砜膜的寿命较短,在多次重复超滤过后,膜通量会逐渐降低,清洗后也很难恢复到原来的膜通量,需及时更换新膜.因此随着膜材料的日益改进,超滤法将是多糖纯化工艺发展的新趋势.
[1]胡斌,杨益平,叶阳.茯苓化学成分研究[J].中草药,2006,37(5):655-658.
[2]林标声.茯苓多糖的发酵、提取及其理化、结构性质鉴定的研究[D].开封:河南大学,2008.
[3]付玲,于淼.茯苓研究的新进展[J].新疆中医药,2005,23(3):79-83.
[4]HUANG Qi-lin,JIN Yong,ZHANG Li-na,et al.Structure,molecular size and antitumor activeities of polysaccharides from Poria cocos mycelia produced in fermenter[J].Carbohydrate Polymers,2007,70:324-333.
[5]ZHANG M,CHIU L C,CHEUNG P C,et al.Growth-inhibitory effects of a heta-glucan from the mycelium of Poria cocos on human breast carcinoma MCF-7 cells:cell-cycle arrest and apoptosis induction[J].Oncol Rep,2006,15(3):637-43.
[6]侯安继,陈腾云,彭施萍,等.茯苓多糖抗衰老作用研究[J].中药药理与临床,2004,20(3):10-11.
[7]安文林,张兰,李雅莉,等.茯苓水提液对叠氮钠致原代培养的新生大鼠海马神经细胞线粒体损伤的影响[J].中国药学杂志,2001,36(7):450-454.
[8]LI T H,HOU C C,CHANG C L,et al.Anti-Hyperglycemic properties of crude extract and Triterpenes from Poria cocos[EB/OL].[2011-12-08].http://www.hindawi.com/journals/ecam/2011/128402/.
[9]LEE K Y,JEON Y J,Polysaccharide isolated from Poria cocos sclerotium induces NF-κB/Rel activation and iNOS expression in murine macrophages[J].International Immunopharmacology,2003,3:1353-1362.
[10]CHEN Y Y,CHANG H M.Antiproliferative and differentiating effects of polysaccharide fraction from fu-ling(Poria cocos)on human leukemic U937 and HL-60cells[J].Food and Chemical Toxicology,2004,42:759-769.
[11]CHEN Xiao-yu,XU Xiao-juan,ZHANG Li-na,et al.Chain conformation and anti-tumor activities of phosphorylated(1→3)-β-D-glucan from Poria cocos[J].Carbohydrate Polymers,2009,78:581-587.
[12]王子尧,陈彦,孙文秀.超滤法分离丹皮多糖的研究[J].膜科学与技术,2009,29(5):98-100.
[13]张惟杰.糖复合物生化研究技术[M].第2版.杭州:浙江大学出版社,1994:36-37.
[14]顾觉奋.分离纯化工艺原理[M].北京:中国医药科技出版社,2002:166.
[15]韩永萍,刘扬平.膜法分级纯化姬松茸子实体多糖的研究[J].中草药,2006,37(3):365-368.
[16]焦光联,杨艳,何葆华,等.超滤提取黄芪多糖的工艺研究[J].化学与生物工程,2010,27(8):58-61.
Purification of polysaccharide from Poria cocos by ultrafiltration membrane technology
YAN Ji-zhong,LIAO Qian,LI Xing-nuo
(College of Pharmaceutical Science,Zhejiang University of Technology,Hangzhou 310032,China)
Ultrafiltration of polysaccharide from Poria cocos was investigated by examining the effects of pressure,temperature and material/liquid ratio on the membrane flux and retention using single factor method coupled with orthogonal array design.Results showed that the optimal values of the above parameters were determined as follows:pressure 0.225 MPa,temperature 35℃,material/liquid 2 g/L.In the optimal conditions,the retention of polysaccharides was 96.56%,the content was increased from 42.66%to 88.4%.The result showed that it was suitable to separate the polysaccharides from Poria cocos by ultrafiltration.
Poria cocos;polysaccharide;ultrafiltration;retention
R283.5
A
1006-4303(2013)02-0122-04
2012-03-07
浙江省科技厅中药现代化重大专项“药用真菌多糖类活性物质高效分离与筛选关键技术”(2009C13029)
颜继忠(1964—),男,福建永春人,教授,硕士,研究方向为中药药效成分提取分离与质量控制,E-mail:yjz@zjut.edu.cn.
(
陈石平)
