鱼藤素诱导食管癌Ec-109细胞株凋亡
2013-08-22白美玲李玉珍金春亭
白美玲 李玉珍 金春亭
(河北北方学院基础医学院病理教研室,河北 张家口 075000)
食管癌就诊时多为中晚期患者,临床上一般采取手术结合化疗。而常规的药物治疗副作用大,效果欠佳,故新的抗癌药物的研发迫在眉睫。近年来一些学者尝试从植物中提取有效成分成为寻找抗癌药物的新途径。鱼藤素是鱼藤属植物及灰叶属植物中提取的一种黄酮类化合物,具有抗病毒、抗肿瘤作用,本实验采用多种方法与手段通过体外观察鱼藤素对食管癌细胞的影响。
1 材料与方法
1.1 主要药物及试剂 人食管癌细胞株Ec-109购自中国医学科学院肿瘤医院肿瘤研究所,河北北方学院实验中心冻存保留。鱼藤素购自ALEXIS公司,纯度为95.6%,用DMSO溶解配成10 mmol/L的储存液,等量分装,-20℃保存,使用前用RPMI1640稀释。RPMI1640培养基为美国Gibco公司产品,胎牛血清(FCS)购自杭州四季青生物工程材料有限公司。Annexin V/PI双染试剂盒为美国BD公司产品。
1.2 实验方法
1.2.1 Ec-109细胞培养与分组 将人食管癌细胞株Ec-109细胞用含10%胎牛血清的RPMI-1640培养基在含有5%CO2、37℃恒温培养箱中进行培养。观察细胞生长进入对数生长期后,用0.25%的胰蛋白酶消化细胞,细胞计数后进行传代培养,待细胞贴壁后,将实验分为5组:对照组(加入等量培养液)及5、10、20 和40 nmol/L鱼藤素组。
1.2.2 荧光显微镜下观察细胞形态 将不同浓度鱼藤素药物组及对照组作用24 h的Ec-109细胞悬液少许滴在干净的载玻片上,通过荧光显微镜观察其形态学改变。
1.2.3 Annexin-V FITC/PI双标法流式细胞术检测细胞早期凋亡 收集不同浓度药物组及对照组作用24 h的Ec-109细胞,每组计数1×106个细胞,离心,弃去上清液,用PBS缓冲液洗涤两遍,再按照流式试剂盒的说明向细胞中分别加入185μl缓冲液,5μl Annexin V和10μl PI,混匀避光20 min,离心后弃去上清,再加入冷PBS洗涤一次,用500μl PBS缓冲液悬起细胞,采用流式细胞仪进行细胞早期凋亡检测。
1.2.4 线粒体跨膜电位的检测 将鱼藤素作用24 h的Ec-109细胞计数并调整细胞密度为1×106/ml,离心,弃去培养基;再用无血清的培养基洗涤Ec-109细胞两遍,离心,悬浮Ec-109细胞,标记罗丹明123(Rho 123),使其终浓度为10μg/ml,混匀;在37℃、5%的CO2培养箱中孵育30 min;PBS缓冲液洗涤两遍,弃去上清;上流式细胞仪进行检测。
1.2.5 免疫组化法检测Bcl-2蛋白与Bax蛋白的表达 常规免疫组化染色法,将5、10、20与40 nmol/L鱼藤素组分别作用于Ec-109细胞24 h后,观察Bcl-2蛋白与Bax蛋白表达情况,并与未加鱼藤素的对照组进行对比。
1.3 统计学处理 采用SPSS16.0统计软件进行数据处理,计量资料以x±s表示,组间比较行q检验。
2 结果
2.1 荧光显微镜下观察EC-109细胞的形态学改变 对照组细胞大小一致,细胞核呈弥散均匀的蓝色荧光,实验组可见细胞体积缩小,胞质浓缩,胞核固缩,染色质边集,核碎裂,染色质分割成块,细胞核呈致密浓染的颗粒状荧光和形成凋亡小体等典型的凋亡细胞形态改变(图1)。
2.2 鱼藤素对食管癌Ec-109细胞凋亡的影响 鱼藤素处理Ec-109细胞24 h后,用Annexin V-FITC和PI双染法对Ec-109细胞标记后经流式细胞仪检测,结果显示鱼藤素对食管癌Ec-109细胞有明显的诱导细胞凋亡和促进细胞死亡作用,5、10、20和40 nmol/L鱼藤素用药组细胞早期凋亡率分别为(4.37±0.35)%、(6.71±0.14)%、(15.62±0.21)% 和(19.78±0.15)%,与对照组自发早期凋亡率(1.10±0.08)%相比均有显著差异(P<0.05),并随鱼藤素浓度的升高,凋亡率也相应增高,呈正相关。
2.3 鱼藤素对食管癌Ec-109细胞线粒体跨膜电位的影响本实验数据显示对照组Ec-109细胞的荧光强度最强,给予5 nmol/L鱼藤素作用24 h后,出现了一个明显的未被罗丹明123染色的峰,随着鱼藤素浓度的增加,弱荧光部分Ec-109细胞含量逐渐增多,细胞荧光强度逐渐减弱,荧光像素向左移动逐渐增多,说明细胞的线粒体跨膜电位逐渐降低,细胞凋亡或坏死的数量也增加。若把对照组荧光强度看作100%,5、10、20与40 nmol/L鱼藤素组荧光指数分别为(93.40±0.70)%、(80.29±0.66)%、(71.15±0.59)%、(63.51±0.53)%。5 nmol/L鱼藤素组与对照组差异不明显(P>0.05),而10、20与40 nmol/L鱼藤素组较对照组相明显下降(P<0.05)。
2.4 Bcl-2蛋白、Bax蛋白在食管癌Ec-109细胞中表达的免疫组化结果 Bcl-2蛋白与Bax蛋白表达阳性均表现为细胞质或细胞膜出现灶性或弥漫分布的棕黄色颗粒,我们以阳性细胞的数量和颜色综合判断两种蛋白的表达情况。实验结果显示(图2)对照组Bcl-2蛋白与Bax蛋白表达均高,鱼藤素组Bcl-2蛋白表达量随着药物浓度的升高而降低,而Bax蛋白随着用药浓度的升高而增高。
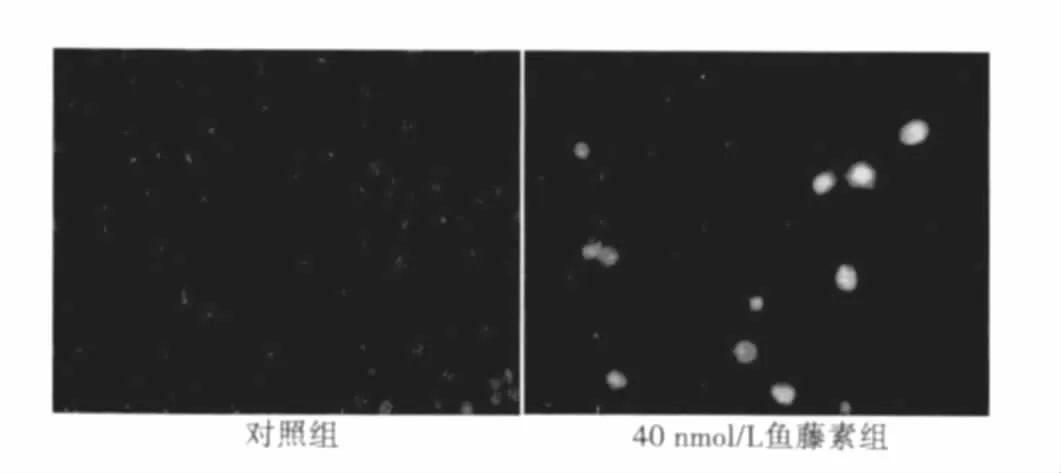
图1 对照组与实验组的细胞形态(×400)
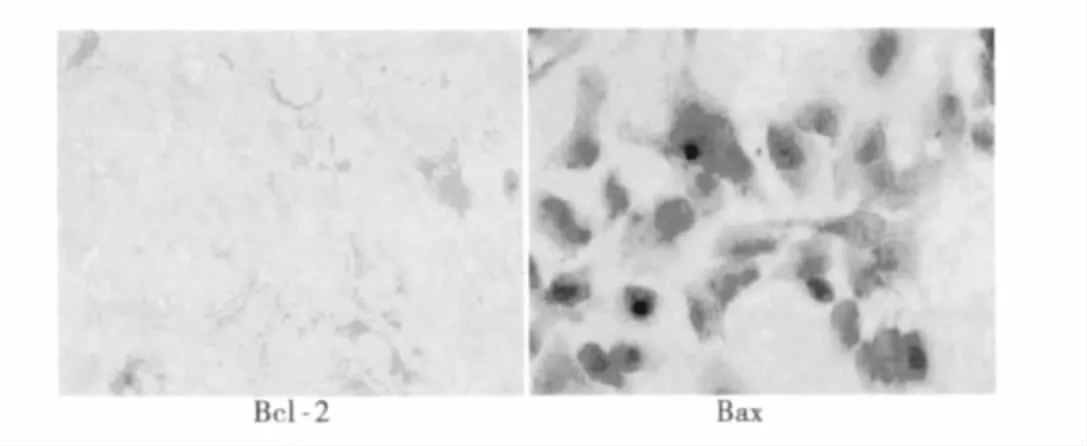
图2 40 nmol/L鱼藤素用药组Bcl-2蛋白、Bax蛋白的表达情况(DAB,×400)
3 讨论
现在普遍认为〔1〕,大多数抗肿瘤药物都可通过诱导肿瘤细胞凋亡的形式杀灭肿瘤细胞从而达到良好的治疗效果,有报道提示〔2,3〕鱼藤素对非小细胞肺癌有明显的诱导凋亡作用,而对正常人体细胞没有杀伤作用。为探讨鱼藤素对食管癌Ec-109细胞的凋亡作用,本实验发现,药物浓度与作用时间呈剂量-时间依赖关系,这与文献报道的药物浓度范围一致〔4〕。
近年来体外实验证实〔5〕,线粒体是处于调控肿瘤细胞的凋亡的中心位置,机体有多种信号途径可以诱导细胞凋亡,但所有这些途径都可能集中于细胞的线粒体。本实验结果表明随着鱼藤素浓度的增高,Ec-109细胞的荧光强度逐渐降低,表明Ec-109细胞的线粒体跨膜电位(△Ψm)逐渐降低,细胞凋亡或坏死渐多。我们推断是由于鱼藤素导致线粒体膜电位损伤,使得进入细胞内的荧光染料减少,检测到的荧光变弱,而线粒体跨膜电位的崩溃导致NADPH耗尽,随后呼吸链上过氧化阴离子过度产生,引发呼吸链的解聚,最终伴随三磷酸腺苷合成不足甚至合成停止,加速了细胞凋亡或坏死的进程。线粒体作为细胞活性氧如氧反应产物的主要来源之一,凋亡刺激使线粒体产生的氧反应产物增多,也促进了细胞凋亡〔6〕。
Bcl-2和Bax是Bcl-2基因家族中的重要成员,在细胞凋亡调控机制方面起重要作用〔7〕。Bcl-2蛋白主要表达于线粒体膜与核膜上,其在线粒体水平上即可对抗各种凋亡刺激,主要体现在增强线粒体膜电位,维持线粒体膜的完整性,从而抑制线粒体释放促凋亡蛋白,已有研究显示Bcl-2蛋白还具有直接抗氧化作用〔8〕。Bax在正常细胞中主要定位表达于细胞质,在细胞受到死亡信号刺激后,发生构像变化,从细胞质转移到细胞器膜上,尤其是线粒体外膜上,与抗凋亡蛋白Bcl-2形成异源二聚体〔9〕,拮抗Bcl-2,使Bcl-2丧失对凋亡的抑制作用,引起细胞器功能丧失和各种促凋亡因子的释放,最终导致细胞的凋亡。从本实验结果显示,鱼藤素作用于Ec-109细胞能够上调Bax表达且下调Bcl-2表达,这说明鱼藤素通过上述某些途径激活了促进食管癌细胞凋亡的基因,同时也能够下调抑制凋亡的基因,这种双重作用的结果导致了凋亡的产生。
本文结果表明鱼藤素可导致线粒体跨膜电位的开放,同时促进凋亡蛋白的释放及下调抗凋亡蛋白含量,从而诱导食管癌细胞的凋亡,为鱼藤素的临床应用提供体外实验证据。
1 吕冬霞,刘 娜,范晓艳,等.灰树花多糖对人宫颈癌HeLa细胞凋亡的影响〔J〕.中国老年学杂志,2011;31(4):1215-7.
2 Lee HY.Molecular mechanisms of deguelin-induced apoptosis in transformed human bronchial epithelial cells〔J〕.Biochem Pharmacol,2004;68(6):1119-24.
3 Ji BC,Yu CC,Yang ST,et al.Induction of DNA damage by deguelin is mediated through reducing DNA repair genes in human non-small cell lung cancer NCI-H460 cells〔J〕.Oncol Rep,2012;27(4):959-64.
4 刘红利,陈 燕,吴秋珍,等.鱼藤素对淋巴瘤Daudi细胞株细胞增殖细胞凋亡的影响及其机制〔J〕.中华肿瘤杂志,2007;9(3):176-80.
5 陆 雯,薛耀明,朱 波,等.低糖诱导的HUVEC-12细胞氧化损伤与线粒体膜电位的关系〔J〕.中华内科杂志,2011;50(10):873-6.
6 Hua YY,Wang XS,Zhang Y,et al.Intense picosecond pulsed electric fields induce apoptosis through a mitochondrial-mediated pathway in He La cells〔J〕.Mol Med Rep,2012;5(4):981-7.
7 Chen X,Wang J,Qin Q,et al.Mono-2-ethylhexyl phthalate induced loss of mitochondrial membrane potential and activation of Caspase3 in HepG2 cells〔J〕.Environ Toxicol Pharmacol,2012;33(3):421-30.
8 Métrailer RI,Pagano A,Carnesecchi S,et al.Bcl-2 protects against hyperoxia-induced apoptosis through inhibition of the mitochondria dependent pathway〔J〕.Free Radic Biol Med,2007;42(7):1062-74.
9 Lalier L,Cartron PF,Juin P,et al.Bax activation and mitochondrial insertion during apoptosis〔J〕.Apoptosis,2007;12(5):887-96.
